В последние десятилетия во всем мире отмечается рост распространенности аллергических заболеваний (АЗ), прежде всего бронхиальной астмы (БА), аллергического ринита и атопического дерматита. АЗ страдает от 10 до 30% населения многих индустриально развитых странах, а в экологически неблагоприятных регионах эта цифра превышает 50%. Тенденция к увеличению заболеваемости будет прослеживаться и далее, без перспективы снижения [10]. В Республике Беларусь общая заболеваемость БА составила: в 2000 г. — 495 случаев на 100 тыс. населения, в 2001 г. — 570,0; в 2002 г.—588,9; в 2003 г. — 614,1 [6 — 8]. Отмечено увеличение заболеваемости аллергическим ринитом: в 2002 г. — 102,3 случая на 100 тыс. населения; в 2003 г. —112,1; остается высокой заболеваемость атопическим дерматитом: в 2002 г. — 251,5, в 2003 г. —243,4 случая на 100 тыс. населения.
Вместе с тем показатели официальной статистики по частоте встречаемости АЗ ниже реальных в 5—10 раз [15], что объясняется несколькими причинами: во-первых, низкой обращаемостью больных с легкими формами заболевания в связи с их недостаточной осведомленностью о болезни, невниманием к своему здоровью; во-вторых, недостаточной настороженностью врачей первичного звена — терапевтов, педиатров, оториноларингологов и др. в отношении аллергии и отсутствием скрининговых тест-систем для ее диагностики. Кроме того, гиподиагностика АЗ обусловлена отдаленностью проживания части населения от учреждений здравоохранения и (или) отсутствием в них аллергологических кабинетов и стационаров.
Поздняя диагностика АЗ, несвоевременно назначенное или неэффективное специфическое лечение ведут к утяжелению и хронизации патологического процесса, появлению неспецифических и инфекционных осложнений, снижению качества жизни и инвалидизации больных. Важность проблемы определена не только с медицинской, но и с экономической позиции ввиду широкого распространения АЗ, их хронического течения, необходимости длительной терапии, значительных финансовых затрат для государства и пациентов. К примеру, прямые затраты на лечение одного больного БА в России составляют (в зависимости от степени тяжести заболевания) от 54 до 1500 $ США в год (в среднем около 400 $) [21], в Республике Беларусь — 160 — 930 $ [12].
К сожалению, несмотря на появление новых дорогостоящих фармакологических препаратов, уровень заболеваемости и смертности от БА не претерпел серьезных изменений, зато увеличилось количество тяжелых форм, резистентных к терапии. Современные ингаляционные глюкокортикостероиды (иГКС), обладающие выраженной противовоспалительной активностью, угнетают реакции организма лишь в период их применения, а после прекращения приема возникает рецидив заболевания. Стабилизаторы мембран тучных клеток, антилейкотриеновые препараты также незначительно влияют на характер реагирования организма больного на причинно-значимый аллерген. Использование бронхолитических препаратов — β2-агонистов короткого и длительного действия, метилксантинов, холинолитиков или комбинированной терапии (иГКС и β2-агонисты длительного действия) обеспечивает уменьшение симптомов заболевания, но не предупреждает прогрессирование БА и нередко приводит к нежелательным побочным эффектам. Условно контролируемое течение БА в странах Западной Европы наблюдается лишь у 5% больных, тогда как у 70% заболевание носит неконтролируемый прогрессирующий характер [4]. В связи с рецидивами БА у пациентов возникает стойкая фармакологическая зависимость, однако ни одно из средств фармакотерапии или их комбинация не излечивает аллергию.
ВОЗ признано, что наиболее эффективным методом противорецидивного лечения БА и других АЗ является аллерген-специфическая иммунотерапия — аллерговакцинация (АВ) [44]. Метод основан на введении в организм больного возрастающих доз причинно-значимого аллергена, что приводит к формированию иммунологической толерантности, результатом которой является уменьшение или полное исчезновение клинических симптомов заболевания, предупреждение его прогрессирования и исключение зависимости от фармпрепаратов.
Нами изложены современные взгляды на специфическую аллерговакцинацию как наиболее эффективный, экономически выгодный способ профилактики рецидивов АЗ и представлен собственный опыт ее применения.
Механизмы аллерговакцинации. Эффект АВ обусловлен аллергенспецифическими и неспецифическими механизмами, включающими:
• изменение изотипа антител у больного: увеличение продукции «блокирующих» IgG4-, IgG1-, sIgA- и sIgM-антител, уменьшение синтеза IgE -антител [5, 14, 28, 31, 43, 44];
• образование антиидиотипических антител [31, 43, 44];
• переключение Т-клеточного ответа с Th2 на Th1 тип с изменением профиля цитокинов, что приводит к уменьшению IgE -аллергенспецифической тканевой реактивности [28, 31, 44];
• супрессию иммунного ответа посредством увеличения пула аллергенспецифических клеток-супрессоров [5, 14, 28];
• индукцию апоптоза Th2, участвующих в активации синтеза IgE [5, 14, 28, 31];
• избирательную активацию изоферментных систем клеток, разрушающих аллерген [14];
• усиление деградации и утилизации аллергенов вслед-ствие повышающейся в процессе АВ абзимной активности иммуноглобулинов [3].
Формирование иммунологической толерантности при АВ зависит от многих факторов: способа введения, дозы, вида и формы антигена, а также возраста, пола и генотипа больного. Помимо парентеральной толерантности хорошо достигается мукозальная пероральная толерантность [43].
Показания для аллерговакцинации. Необходимо как можно более раннее выявление больных с рецидивами аллергических заболеваний – БА, аллергическим ринитом, поллинозом, атопическим дерматитом. Врач любой специальности должен направить такого больного к аллергологу для обследования и решения вопроса об АВ, наиболее эффективной в ранний период развития болезни.
Основные диагностические критерии аллергии [14, 23]:
• наличие характерных анамнеза и клинических проявлений;
• пароксизмальное, приступообразное течение и быстро наступающая ремиссия при элиминации аллергенов; наоборот, резкое обострение в случае повторного контакта с ними;
• наследственная предрасположенность к аллергии;
• характерные повреждения ткани при местном аллергическом процессе;
• эозинофилия крови, мокроты, секретов и других биологических жидкостей и выделений;
• положительные кожные аллергические пробы со специфическим аллергеном;
• наличие специфических IgЕ-антител в сыворотке крови и секретах, IgG-антител; обнаружение сенсибилизированных лейкоцитов (базофилов, нейтрофилов и Т-лимфоцитов);
• эффективность антиаллергической фармакотерапии.
Основание для назначения АВ — доказанная взаимосвязь клинических проявлений болезни с конкретным аллергеном исходя из анамнеза и результатов специфического обследования (кожного и лабораторного тестирования), указывающая на атопический IgE -зависимый механизм заболевания, а также невозможность прекращения контакта больного с аллергеном [38, 44]. В подтверждение «виновности» аллергена проводятся провокационные (назальные, конъюнктивальные, ингаляционные или пероральные) тесты. Тщательный подбор больных для выполнения АВ имеет определяющее значение в эффективности данного вида лечения.
Наиболее часто АВ проводится аллергенами домашней пыли, микроклещей домашней пыли, пыльцы растений, ядом или экстрактами тела перепончатокрылых. Возможно лечение бактериальными, грибковыми и эпидермальными аллергенами. АВ эффективна при атопической БА легкого и среднетяжелого течения, поллинозе, аллергическом рините, аллергическом конъюнктивите, инсектной аллергии, атопическом дерматите. Отличные и хорошие результаты АВ при инсектной аллергии отмечены у 95% пациентов, при пыльцевой аллергии — у 80—90%, при бытовой — у 70–85%, при грибковой — у 60—70% [14, 23, 38, 28, 44].
Абсолютно неприемлемы и дискредитируют метод рекомендации о назначении АВ лишь в случае неэффективности предшествующей медикаментозной терапии [44]. Напротив, при проведении АВ на наиболее ранних стадиях аллергического заболевания достигается высокая ее эффективность. Рецидивы заболевания, неэффективная фармакотерапия приводят к формированию полисенсибилизации к аллергенам, утяжелению течения и необратимым осложнениям заболевания, что исключает возможность достижения хороших результатов лечения или является противопоказанием для назначения АВ.
Одно из условий, определяющих успешность лечения, — соблюдение больным элиминационного (гипоаллергенного) режима, включающего комплекс мероприятий по ограничению контакта с причинно-значимыми аллергенами и провоцирующими аллергию факторами окружающей среды. Большое значение имеет обучение пациента («астма-школа», беседы, рекомендации, план действий при различных обстоятельствах и др.), а также соблюдение пациентом рекомендаций врача [1, 14, 38, 44].
Противопоказания к применению АВ: обострение АЗ, тяжелые иммунодефициты, тяжелая астма, лечение β2-адреноблокаторами, тяжелые заболевания сердечно-сосудистой, нервной и эндокринной систем с нарушением их функций, онкологические, аутоиммунные заболевания, болезни крови, острые инфекционные заболевания и обострения хронической инфекции, тяжелые психические расстройства.
Принципы проведения аллерговакцинации. Высокодозовую АВ начинают с минимальной дозы аллергена, которая не вызывает симптомов аллергии, затем продолжают введение возрастающих доз аллергена до достижения оптимальной максимальной дозы – такого количества аллергена, которое обеспечивает клинический эффект без развития побочных системных реакций. Предпочтительнее использовать круглогодичную схему введения аллергена, оптимальная длительность которой должна составлять не менее 3—5 лет. При отсутствии такой возможности может быть применена предсезонная иммунотерапия — аллергены вводятся в течение нескольких недель или 3—4 месяцев до контакта с причинно-значимыми аллергенами.
По темпу наращивания дозы аллергена различают классический, краткосрочный, ускоренный, молниеносный и шок-метод. В аллергологическом стационаре чаще используются более короткие схемы вакцинации, несомненным преимуществом которых является быстрое достижение поддерживающей дозы аллергена. Безопасность ускоренных курсов вакцинации значительно возрастает при введении аллергена через слизистые оболочки носа или желудочно-кишечного тракта. Проведение специфической иммунотерапии в короткие сроки без каких-либо побочных реакций возможно при применении аллергоидов, обладающих меньшей аллергенностью.
Пути введения лечебных аллергенов. Наиболее часто в клинической практике используются инъекционные пути введения аллергенов в организм больного: подкожный, внутрикожный и скарификационный. Инъекции делают ежедневно, а после достижения максимальной дозы аллергена — один или два раза в месяц. При использовании депонированных форм аллергенов инъекции выполняют раз в 1 или 2 недели. Недостатком этих методов является необходимость получения пациентом большого количество инъекций, что ограничивает свободу перемещения и усиливает зависимость от врача. При подкожном введении аллергена не исключается вероятность развития анафилактических реакций, вызванных быстрой его абсорбцией или попаданием непосредственно в кровоток. Наиболее часто для АВ используются стандартизированные водно-солевые экстракты аллергенов, а также модифицированные формы аллергенов, которые обладают сниженной аллергенной и сохраненной иммуногенной активностью. Изучаются возможности применения фрагментов молекул аллергенов, сохраняющих Т-клеточные эпитопы аллергенов, молекул естественных аллергенов с блокированными В-клеточными эпитопами [36, 42]. Разрабатываются рекомбинантные и синтетические пептиды аллергенов, могущие изменять функциональную активность Т-лимфоцитов, но не обладающие IgE -связывающей способностью [32, 35, 39, 40].
В последние годы отмечается повышенный интерес к мукозальной АВ, включающей интраназальный, ингаляционный, энтеральный (сублингвальный, орофарингеальный, пероральный) пути введения аллергена. Интраназальная АВ нашла применение в практике детских аллергологов [2, 37].
Ингаляционный метод введения аллергена получил меньшее распространение из-за трудоемкости процедуры, необходимости использования специальной аппаратуры и хорошо обученного медперсонала, противоречивости сведений о его безопасности и эффективности [11, 29, 37].
Преимущество энтеральных методов АВ — высокая безопасность, удобный режим и безболезненность процедуры, экономия времени. Сублингвальный метод предусматривает удерживание аллергена под языком в течение 1—2 минут с последующим проглатыванием или удалением. При орофарингеальной АВ агаро-желатиновые блоки с введенными в них разовыми дозами аллергена или таблетированные аллерговакцины удерживают за щекой до полного рассасывания. При пероральной АВ аллерген в каплях, капсулах или таблетках немедленно проглатывается. В качестве пероральных аллерговакцин используются водно-солевые экстракты аллергенов; глицериновые аллергены или водно-солевые экстракты аллергенов, смешанные с чистым глицерином; лиофилизированный микст-аллергоид пыльцы; аллергены, помещенные в биодеградирующие микросферы, предохраняющие от разрушения и освобождающие его в заданное время. Конструируются специальные мукозальные аллерговакцины – рекомбинантные и синтетические пептиды, вакцины, комплексированные с адъювантами или носителями [28].
Эффективность пероральной АВ варьирует от 55 до 95%, что вызвано отсутствием специальных форм энтеральных аллерговакцин, максимально контактирующих с системой иммунитета желудочно-кишечного тракта. Многие исследователи указывают на необходимость изучения эффективности пероральной АВ в рандомизированных плацебо-контролируемых испытаниях [37, 41, 44].
Нами изучена эффективность высокодозовой пероральной АВ (суммарная курсовая доза аллерговакцины 83 450 PNU) у 160 больных атопической БА [16, 17]. Лечение проводилось новыми пероральными аллерговакцинами в форме порошков, капсул или суспензии, содержащих комплекс бытовых аллергенов, конъюгированных с волокнистыми или гелевыми носителями-сорбентами, не всасывающимися в желудочно-кишечном тракте. Положительный эффект пероральной АВ отмечен у 92,1% больных. Отличные и хорошие результаты достигнуты у 65,7%, удовлетворительные — у 26,4%, неудовлетворительные — у 7,9% пациентов, причем клиническая эффективность пероральной и подкожной АВ была сопоставима. После АВ изотипический спектр антител к причинно-значимым бытовым аллергенам в сыворотке крови больных претерпевал значительные изменения: снижались уровни IgE -, IgA- и IgG4-антител и повышались уровни IgG2-, IgM-антител [18]. Пероральный метод отличался более высокой безопасностью — местные реакции отсутствовали, на долю легких системных реакций пришлось 13,1%, тогда как при подкожной АВ местные реакции наблюдались у 47%, системные — у 39,4% больных (Р<0,05).
После низкодозовой пероральной АВ (22 пациента с атопической БА, суммарная курсовая доза аллерговакцины — 500 PNU) положительные результаты отмечены у 69%, уровень IgE -антител достоверно снизился у 71%, увеличение титра IgG4-антител имело место у 51% больных. Полученные обнадеживающие результаты подтверждают возможность индукции пероральной толерантности низкими дозами аллерговакцины.
Использование перорального метода АВ позволило сократить продолжительность основного курса стационарного лечения, увеличить количество бессимптомных дней, уменьшить число госпитализаций и, следовательно, снизить затраты на фармакотерапию.
Безопасность аллерговакцинации. При введении аллерговакцин могут возникать местные реакции – гиперемия, зуд, отек ткани, в ряде случаев требующие коррекции схемы аллерговакцинации, а также не угрожающие жизни системные реакции — ринит или приступ БА, крапивница, отек Квинке, которые хорошо поддаются лечению. Крайне редко при АВ наблюдается анафилактический шок. Так, в аллергологическом отделении Витебской областной клинической больницы ежегодно 1900—2100 больным выполняется 60 000—70 000 тестов с аллергенами (в том числе 600—700 провокационных). За 25 лет работы отделения (1980—2005 гг.) зарегистрирован лишь один случай легкого анафилактического шока при проведении кожных проб с пыльцевыми аллергенами, специфическая иммунотерапия проведена 15860 больным, при этом какие-либо тяжелые анафилактические реакции не отмечались.
В Саратовском аллергологическом центре частота анафилактического шока за 30-летний период работы составила 0,0007% (общее число инъекций аллергенов — 438 030, зарегистрирована 1 анафилактическая реакция на 146 010 инъекций) [1].
По данным зарубежных авторов, на 12 286 инъекций аллергенов отмечено всего 10 (0,07%) системных реакций, из них 1 (0,01%) анафилактическая [30]. При замене инъекционных схем АВ на пероральные вероятность развития аллергических реакций будет практически исключена.
Многолетний опыт применения АВ в различных странах и собственные данные свидетельствуют, что соблюдение методических аспектов выполнения процедуры обеспечивает высокую безопасность лечения. В целях предупреждения развития нежелательных осложнений лечения ВОЗ рекомендовано проведение АВ только врачами-аллергологами специализированных стационаров и/или аллергологических кабинетов.
Комбинированная терапия аллергических заболеваний. В настоящее время проведение АВ при аллергических заболеваниях не противопоставляется применению фармакотерапии. Напротив, рекомендуется введение аллерговакцин в комплексе с базисными противовоспалительными и/или антимедиаторными препаратами, что позволяет стабилизировать состояние больного в более ранние сроки [38]. Высокоэффективна комбинированная терапия иГКС и аллергенами, в основе которой лежит синергический противовоспалительный эффект, по мере достижения которого производится постепенная отмена фармакотерапии [24, 27].
При аллергических заболеваниях, осложненных вторичными иммунодефицитами, показано одновременное применение АВ и иммуномодуляторов. Доказана эффективность АВ в комбинации с полиоксидонием, диуцифоном, ликопидом [9], миелопидом [25], рекомбинантным гамма-интерфероном, циклофероном [22], вобэнзимом [26], внутримышечным введением иммуноглобулина, а также приемом милдроната, альфа-2b интерферона [13].
Мы с успехом сочетаем АВ с аутосеротерапией [14, 19]. Метод аутосеротерапии высокоэффективен для метаболической и иммунокорригирующей терапии. В сыворотке крови содержится широкий спектр цитокинов (интерлейкины, простагландины, серотонин и др.), и ее введение при гиперергических реакциях позволяет «десенсибилизировать» организм к биологически активным веществам, а также воздействовать на системы их инактивации [14].
Экономическая эффективность аллерговакцинации. Аргументом в пользу аллерговакцинации служит низкая стоимость курса в сравнении с медикаментозной терапией. Согласно рекомендации консенсуса по бронхиальной астме GINA-2002 [4], больным БА легкого персистирующего течения показана ежедневная базисная противовоспалительная терапия кромонами или иГКС в средних терапевтических дозах 200–800 мкг/сут, применение по потребности β2-агонистов, что в денежном выражении составляет от 40,2 $ (терапия будесонидом) до 205 $ (терапия кромонами) на одного больного в год.
Больным БА средней степени тяжести показано круглогодичное назначение иГКС в высоких дозах — 800—2000 мкг/сут или сочетание иГКС в средних дозах с β2-агонистами длительного действия, по потребности — β2-агонисты короткого действия. Стоимость терапии одного больного БА среднетяжелого течения будесонидом (на сегодняшний день это самый дешевый иГКС — одна доза стоит 0,038 $) составляет не менее 98,3 $ в год. Стоимость фармакотерапии другими иГКС достигает 300 $ в год на одного больного.
Аллерговакцинация, напротив, воздействуя на все стадии развития аллергической реакции, в том числе на иммунологическую, является относительно дешевым методом иммунотерапии. По результатам нашего исследования, стоимость подкожного метода АВ на год составляет 6,4 $, внутрикожного — 29 $, перорального высокодозового — 26,5 $, перорального низкодозового — 3,4 $ [24].
Таким образом, затраты на проведение аллерговакцинации одному больному с легким течением БА как минимум в 7 раз меньше стоимости терапии инталом в сочетании с β2-агонистами короткого действия. Затраты на круглогодичную терапию будесонидом и β2-агонистом короткого действия оказались на треть выше затрат на аллерговакцинацию (рис.1).
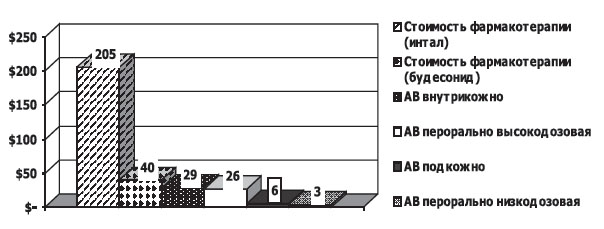
Рис.1. Стоимость фармакотерапии и различных методов аллерговакцинации больных БА легкого течения
Стоимость лечения одного больного БА средней степени тяжести в 3,5 раза дороже стоимости аллерговакцинации (рис.2).
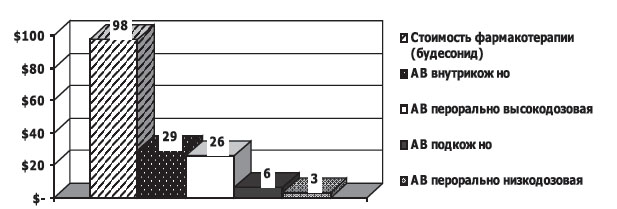
Рис.2. Стоимость фармакотерапии и различных методов аллерговакцинации больных БА средней степени тяжести
Фармакоэкономические исследования, проведенные в США, показали, что стоимость терапии одного больного АР и БА антигистаминными препаратами и топическими ГКС в течение 5 лет составила 10200 $, а стоимость АВ — 4700 $ США [34]. Другая группа исследователей сообщает, что общие затраты при лечении АР составили 1129±321 $ на одного больного, тогда как проведение АВ в течение 4-го года — 950±352 $ США [33]. В Институте иммунологии Российской Федерации сопоставили стоимость медикаментозной терапии (в течение двух лет) пациента, страдающего поллинозом, с затратами двух последовательно проведенных курсов АВ с учетом медикаментозной терапии в последующий сезон поллинации, которые составили 2718,8 руб. и 1880,6 руб. соответственно [20].
Кроме того, АВ дает значительный экономический эффект, который складывается из уменьшения расходов на фармакотерапию, стационарную, амбулаторно-поликлиническую и скорую медицинскую помощь и, следовательно, является наиболее экономически эффективным методом достижения стойкой ремиссии аллергического заболевания.
Таким образом, аллерговакцинация является эффективным методом лечения и профилактики рецидивов аллергических заболеваний, который имеет ряд преимуществ перед фармакотерапией:
• исключается фармакозависимость больного, так как после прекращения лечения длительно сохраняется безлекарственная ремиссия;
• предупреждается прогрессирование заболевания и развитие его осложнений;
• предупреждается расширение спектра сенсибилизирующих аллергенов;
• снижается или исключается потребность в дорогостоящих лекарственных препаратах, сокращаются затраты средств как пациента, так и системы здравоохранения, общества в целом;
• предупреждается инвалидизация больных.
При выявлении аллергического заболевания должна использоваться «опережающая» тактика — проведение процедуры аллерговакцинации в наиболее ранние сроки. Для успеха лечения важно соблюдать критерии отбора, применять наиболее эффективные и безопасные способы введения аллергенов, максимально «индивидуализировать» схему лечения, при необходимости использовать радикальную комбинацию с фармакотерапией.
Как известно, успех в терапии АЗ в значительной степени зависит от квалификации каждого практикующего врача, знания и умения которого позволяют выбрать верную стратегию и тактику ведения больного. Представляется крайне своевременным включение метода аллерговакцинации в стандарты по лечению больных аллергическими заболеваниями.
Литература
1. Астафьева Н.Г. // Пульмонология. — 2004. — N 1. – С. 99—104.
2. Балаболкин И.И., Рылеева И.В., Юхтина Н.В. и др. // Педиатрия. -– 2006. — N 2.— С. 81—85.
3. Генералов И.И., Новиков Д.К. // Иммунопатология, аллергология, инфектология. – 1999. — N 1. – С. 57—60.
4. Глобальная стратегия лечения и профилактики бронхиальной астмы. Пересмотр 2002 г. — М.: Атмосфера, 2002.
5. Гущин И.С. Аллергическое воспаление и его фармакологический контроль. — М.: Фармарус Принт, 1998.
6. Здравоохранение в Республике Беларусь: Офиц. стат. сб. за 2001 г. — Мн.: ГУ РНМБ, 2002.
7. Здравоохранение в Республике Беларусь: Офиц. стат. сб. за 2002 г. — Мн.: ГУ РНМБ, 2003.
8. Здравоохранение в Республике Беларусь: Офиц. стат. сб. за 2003 г. — Мн.: ГУ РНМБ, 2004.
9. Ильина Н.И., Михеева Г.Н., Червинская Т.А. // Intern. J. Immunoreabilitation. – 1997. — N 7. – С. 79—83.
10. Ильина Н.И., Хаитов Р.М. // Астма. – 2001. — Т. 2, N 1. — С. 35—38.
11. Колосова Т.С. Комбинированная специфическая иммунотерапия атопической бронхиальной астмы и оценка ее эффективности: Автореф. дис. … канд. мед. наук. — Киев, 1990.
12. Лаптева И.М., Цыбин А.К., Борщевский В.В., Тябут В.В. // Актуальные проблемы пульмонологии: IV Республ. науч.-практ. конф.: Тез. докл. — Минск: ООО “Доктор Дизайн”, 2002. — С. 4—7.
13. Медуницина Е.Н., Латышева Т.В., Ярилин А.А. // Intern. J. Immunoreabilitation. – 2000. — Т. 2, N 2. – С. 22.
14. Новиков Д.К. Клиническая аллергология. — Минск: Выш. школа, 1991.
15. Новиков Д.К., Новикова В.И. // Клиническая аллергология и иммунология. Иммунодиагностика и иммунореабилитация (сб. науч. тр. 2-й Междунар. конф. и 1-го съезда БААКИ). – Минск—Витебск, 1998. — С. 43–56.
16. Новиков Д.К., Выхристенко Л.Р. // Аллергология и иммунология. — 2003. — Т. 4, N 2. – С. 37—50.
17. Новиков Д.К., Выхристенко Л.Р., Новиков П.Д. и др. // Астма. — 2001. — Т. 2, N 2. — С. 24—34.
18. Новиков П.Д., Выхристенко Л.Р. // Иммунопатология, аллергология, инфектология. – 2005. — N 3. – С. 50—60.
19. Новиков Д.К., Новикова В.И., Доценко Э.А. Бронхиальная астма у взрослых и детей. —Москва—Витебск, 1998.
20. Павлова К.С., Курбачева О.М. // Проблемы стандартизации в здравоохранении. – 2005. — N 4. — С. 47—55.
21. Пунин А.А., Старовойтов В.И., Ковалева С.В., Голубков М.А. // Пульмонология. —1999. — N 1. — С. 68–71.
22. Сидорович И.Г., Татаурщикова Н.С., Сеславина Л.С. и др. // Аллергия, астма и клиническая иммунология: Отчетные м-лы по программе «Вакцины нового поколения и медицинские диагностические системы будущего». — 2001. – N 1. – С. 52—54.
23. Скепьян Н.А. Аллергические болезни: дифференциальный диагноз, лечение. — Мн.: Беларусь, 2000.
24. Смирнова О.В. Сравнительная оценка эффективности комбинированных методов иммунотерапии больных атопической бронхиальной астмой: Автореф. дис. … канд. мед. наук. — Витебск, 2005.
25. Сокуренко С.И., Федосеев А.Н., Бондаренко Н.Л., Караулов А.В. //Успехи клинической иммунологии и аллергологии / Под ред. А.В. Караулова. — М.: Регионарное отделение РАЕН, 2001. — Т. 2.
26. Фролова С.А. // Мед. иммунология. — 2001. – Т. 3, N 2. – С. 172—173.
27. Черняк Б.А., Воржева И.И. // Аллергология. — 2000. — N 2. — С. 51—56.
28. Allergen immunotherapy — therapeutic vaccines for allergy and asthma // Pneumologie. — 1999. – V. 53, Suppl. 12. — P. 1—4.
29. Bousquet J., Michel F. В. // Proceedings of XVI Еuropean Congress of Allergology and Clinical Immunology (Madrid). – 1995. — Р.717—722.
30. Businco L., Zannino L., Cantani A.Р. 44-47. et al. // Pediatr. Allergy Immunol. – 1995. — N 6. –
31. Durham S.R., Till S.J. // Allergy Clin. Immunol. – 1998. –V. 102, N 2. – Р. 3—53.
32. Hartl A., Kiesslich J. // Allergy Clin. Immunol. — 1999. — N 1. — Р. 107—113.
33. Kumar P., Kamboj S., Rao P. et al. // Allergy Clin. Immunol. Intern. — 1997. – V. 9, N 5. – Р. 133–135.
34. Law A.W., Reed S.D., Sundy J.S. et al. // J. Allergy Clin. Immunol. — 2003. — N 111. – Р. 296—300.
35. Marcotte G.V., Braun C.M., Norman P.S. et al. // J. Allergy Clin. Immunol. — 1998. — N 101. – Р. 506—513.
36. Norman P.S., Ohman J.L., Long A.A. et al. // Amer. J. Respir. Crit. Care Med. — 1996. — N 154. — Р. 1623—1628.
37. Passalacqua G., Canonica G.W. // J. Investig. Allergol. Clin. Immunol. — 1996. — N 6. — Р. 81—87.
38. Patterson R. Allergic Diseases. — Lippincott-Raven, 1997.
39. Реnе J., Desroches A., Paradis L. et al. // J. Allergy Clin. Immunol. — 1998. — N 102. – Р. 571—578.
40. Raz E., Spiegelberg H.L. // Intern. Rev. Immunol. — 1999. —V. 18, N 3. — Р. 271—289.
41. Ulrich N., Bodo N., Harald R. // Pneumol. Immunol. Charite. — 1998. — V. 95, N 36. – Р. 1713–1716.
42. Wallner B.P., Gefter M.L. // Allergy. — 1994. — V. 49. — P. 302.
43. Wheeler W., Drachenberg K.J. // Allergy. — 1997. —V. 52. – Р. 602—612.
44. WHO Position Paper. Allergen immunotherapy: therapeutic vaccines for allergic diseases // Allergy. — 1998. – V. 53, Suppl. 44. — Р. 1—42.
Медицинские новости. - 2007. - №4. - С. 36—41.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.