Внимание! Статья адресована врачам-специалистам
Alieva A.M., Rahimova N.J.
Scientific Research Institute of Pediatrics named after K. Farajova, Azerbaijan
The role of TLR2 and TLR4 and fecal S100A12 in the diagnosis
of necrotic enterocolitis in premature newborns
Резюме. Несмотря на очевидные успехи неонатальной медицины, некротический энтероколит (НЭК) остается одним из наиболее тяжелых заболеваний, сопровождающихся высокой летальностью и инвалидизацией новорожденных. Особую актуальность в неонатальной гастроэнтерологии приобретает поиск новых биомаркеров для ранней диагностики НЭК у новорожденных. Целью исследования явилась оценка роли фекального белка S100A12 и определение уровня экспрессии TLR2 и TLR4 в диагностике НЭК у недоношенных детей. К комплексному клинико-лабораторному и инструментальному обследованию были привлечены 100 недоношенных детей с НЭК. Для исследования концентрации фекального S100A12 применялся иммуноферментный метод. Уровни экспрессии генов TLR2 и TLR4 в клетках крови определяли методом полимеразной цепной реакции в реальном времени (RT-qPCR).
Ключевые слова: некротический энтероколит, TLR2, TLR4, фекальный S100A12, иммунная система, недоношенные новорожденные.
Медицинские новости. – 2023. – №5. – С. 77–80.
Summary. Despite the obvious successes of neonatal medicine, necrotic enterocolitis (NEC) remains one of the most severe diseases accompanied by high mortality and disability of newborns. Of particular relevance in neonatal gastroenterology is the search for new biomarkers for the early diagnosis of necrotic enterocolitis in newborns. The aim of the study was to evaluate the role of fecal protein S100A12 and to determine the level of TLR2 and TLR4 expression in the diagnosis of necrotic enterocolitis (NEC) in premature babies. 100 premature infants with necrotic enterocolitis were involved in a comprehensive clinical, laboratory and instrumental examination. To study the concentration of fecal S100A12, an enzyme immunoassay was used. The expression levels of TLR2 and TLR4 genes were determined by real-time polymerase chain reaction (RT-qPCR).
Keywords: necrotic enterocolitis, TLR2, TLR4, fecal S100A12, immune system, premature newborns.
Meditsinskie novosti. – 2023. – N5. – P. 77–80.
У недоношенных детей некротический энтероколит (НЭК) является основной причиной заболеваемости и смертности. Несмотря на то, что к настоящему времени были достигнуты значительные успехи в профилактике и лечении этого заболевания, уровень смертности и заболеваемости, связанных с НЭК, существенно не изменился [1–3]. Хотя факторы, влияющие на развитие НЭК, еще точно не известны, считается, что недоношенность является наиболее важным фактором риска развития НЭК [4].
В этой связи актуальность для неонатологии представляет проблема поиска качественных маркеров активности кишечного воспаления. В последнее время в диагностике НЭК используются неинвазивные методы, один из них – фекальный S100A12 [5, 6].S100A12 обладает противовоспалительной активностью. После секреции он передает сигналы воспаления через TLR4, активируя моноциты, вызывает воспаление и приводит к активации цитокинов (IL-1?, IL-6 и IL-8) [7–9]. Поэтому определение концентрации фекального S100A12 как неинвазивного маркера,отражающего нейтрофильное интестинальное воспаление, имеет важное значение в диагностике НЭК в неонатальном периоде.
Исследования показали, что Толл-рецепторы (TLR), особенно TLR2 и TLR4, как индукторы воспалительных реакций играют основную роль в патогенезе НЭК [10, 11]. TLR4 является одним из наиболее важных путей, играющих ключевую роль в патогенезе НЭК, и опосредует баланс между повреждением и восстановлением в кишечнике недоношенных. Считается, что TLR4-опосредованный дисбаланс между провоспалительной и противовоспалительной сигнализацией в эпителии кишечника недоношенных приводит к развитию НЭК [12]. У недоношенных детей уровни TLR4 остаются повышенными как до, так и после рождения, что обусловлено нормальным онтогенезом экспрессии генов. Это вызывает бактериальную транслокацию, системный сепсис и развитие НЭК у младенцев [13, 14].
TLR2 и TLR4 сверхэкспрессируются в энтероцитах плода человека, в то время как экспрессия TLR2 и TLR4 очень низкая или отсутствует в эпителии кишечника здорового взрослого человека [15]. Сообщалось, что экспрессия TLR2 и TLR4 изменяется у младенцев с НЭК [16]. Хотя в литературе подчеркивается, что TLR2 и TLR4 эффективны в патогенезе новорожденных с НЭК, исследования очень ограничены и в основном сосредоточены на TLR4. Поэтому целью данного исследования было определить и сравнить экспрессию TLR2 и TLR4 у недоношенных новорожденных с НЭК и здоровых недоношенных новорожденных.
Цель исследования – оценить роль фекального белка S100A12 и определить уровни экспрессии генов TLR2 и TLR4 в диагностике некротического энтероколита у недоношенных детей.
Материалы и методы
К комплексному клинико-лабораторному и инструментальному обследованию были привлечены 100 недоношенных детей. В данное исследование были включены новорожденные с некротическим энтероколитом, с гестационным возрастом менее 37 недель, находящиеся на стационарном лечении в отделениях«Анестезиологии, реанимации и интенсивной терапии новорожденных» и «Недоношенных детей» Научно-исследовательского института педиатрии им. К. Фараджевой. В контрольную группу вошли условно здоровые недоношенные дети (n=32) из родильного дома №7. Все обследуемые дети были разделены на две группы: I группу составили 66 новорожденных, из которых 44 больных с НЭК с массой более 1500 г и 22 условно здоровых недоношенных детей с массой более 1500 г. Во II группу вошли 34 новорожденных: из них 24 недоношенных с НЭК с массой менее 1500 г и 10 недоношенных с массой менее 1500 г без НЭК.
Таблица 1. Уровень S100A12 у недоношенных с НЭК и массой тела более 1500 г
|
S100A12
|
Group
|
N
|
Mean
|
St.error
|
Min
|
Max
|
Sig PF
|
Pu
|
|
Control
|
22
|
276,8
|
46,0
|
105
|
921
|
0,000
|
0,000
|
|
NEC
|
44
|
1924,7
|
67,3
|
74
|
2618
|
|
Total
|
66
|
1375,4
|
107,3
|
74
|
2618
|
Образцы кала обследуемых детей были изучены в лаборатории НИИ педиатрии им. К. Фараджевой по методуиммуноферментного анализа (ИФА, ELISA) с использованием реактивов HumanS100A12 ELISA (BioVendor). Образцы кала недоношенных детей с НЭК были взяты в первый месяц жизни детей. Обследования проводились в начале заболевания и через 2 недели в динамике.
Таблица 2. Уровень S100A12 у недоношенных с НЭК и массой тела менее 1500 г
|
S100A12
|
Group
|
N
|
Mean
|
St.error
|
Min
|
Max
|
Sig PF
|
Pu
|
|
Control
|
9
|
478,8
|
128,1
|
112
|
1262
|
0,000
|
0,000
|
|
NEC
|
25
|
1945,6
|
80,0
|
1105
|
2522
|
|
Total
|
34
|
1557,3
|
131,0
|
112
|
2522
|
Дляизучения экспрессии генов TLR2 и TLR4 в исследование было включено в общей сложности 70 недоношенных новорожденных, в том числе 40 новорожденных с НЭК и 30условно здоровых недоношенных новорожденных. Генетические тесты были проведены в Институте генетических ресурсов в Баку (Азербайджан) и лаборатории DIAGEN в Анкаре (Турция). Учитывая недоношенность и малый вес детей, находящихся под нашим контролем, объем взятой крови составил 0,5 мл.
Уровни экспрессии генов определяли методом полимеразной цепной реакции в реальном времени (RT-qPCR). Для обеспечения высококачественного выделения общей РНК использовали набор для выделения общей РНК (набор для сыворотки/плазмы miRNeasy, Qiagen, Германия). Процедуры проводили в соответствии с протоколом производителя.
ДанныеToll-подобных рецепторов, полученные в ходе исследования, были проанализированы с помощью программы SPSS 23.0 (Statistical Package for Social Sciences, Чикаго, Иллинойс, США). Результаты показаны в виде среднего значения (X) ±стандартного отклонения (SD). Уровень статистической значимости был принят при 95% доверительном интервале, р<0,05.
На основе теста Шапиро – Уилка на уровни экспрессии генов были исследованы внутригрупповые распределенияи определено, что распределение было нормальным во всех группах генов. Для попарных сравнений групп использовался t-критерий Стьюдента для независимых групп.
Результаты и обсуждение
Проведено проспективное исследование 100 новорожденных с некротическим энтероколитом, поступивших на стационарное лечение в НИИ педиатрии в отделении реанимации и интенсивной терапии и недоношенных детей. В основном наблюдаемые дети родились от матерей с отягощенным акушерско-гинекологическим анамнезом (токсикоз – 91 случай, гестоз – 19, угроза выкидыша – 28, анемия – 51, внутриутробные инфекции – 34, острые вирусные инфекции – 34, артериальная гипертензия – 17, преждевременная отслойка плаценты с кровотечением – 6, мутные околоплодные воды – 58). Возраст матерей колебался от 17 лет до 41 года, в среднем составив 26,5лет. У матерей основной группы первая беременность была у 42 матерей, повторная (2–5) беременность была у 58 женщин. У 16 матерей беременность наступила после экстракорпорального оплодотворения. Естественные роды были у 48 женщин, оперативные роды – у 52 женщин. Роды двойней отмечались в 20% случаев, тройней – в 0,2%. Включенные в обследование недоношенные были рождены при сроке гестации от 25 до 37 недель (32,8), с массой тела от 450 до 2500 г (1721,1 г). Среди наблюдаемых новорожденных мальчиков было 45, девочек 55. Всем детям в неонатальном периоде было проведено комплексное клинико-инструментальное и лабораторное исследование.
Анализируя некоторые показатели периферической крови у недоношенных с НЭК с массой более 1500 г, были выявлены низкие уровни гемоглобина (p<0,01), эритроцитов (p<0,01), лейкоцитов (p<0,01) и тромбоцитов (p<0,01). Аналогичные изменения в клиническом анализе крови (анемия, лейкопения, тромбоцитопения (р<0,05)) отмечались у недоношенных с НЭК с массой менее 1500 г.
Изучение уровня S100A12 в кале у новорожденных с НЭК выявило, что уровень фекального S100A12 был достоверно выше по сравнению с новорожденными контрольной группы. Уровень S100A12 у недоношенных с НЭК и массой тела более 1500 г был в 6,9 раза выше по сравнению с контрольной группой (p<0,01). У недоношенных с НЭК и массой тела менее 1500 г этот показатель превышал контроль в 4,1 раза. Изучение фекального уровня S100A12 в динамике заболевания показало значительноеповышение его в начальнойстадии и понижение в конце заболевания. Среди обследованных новорожденных 15 (21,4%) пациентов имели перфорацию с ухудшением состояния, из них 11 детей с низкой массой тела, 4 ребенка с массой тела менее 1500 г. 16 (22,8%) детей умерли (6 детей с массой тела более 1500 г, 10 детей с массой тела менее 1500 г). Именно у этой категории детей (с перфорацией и умершие) снижение уровня S100A12 в кале в динамике заболевания не наблюдалось, что совпадает с патологическими результатами клинико-лабораторных исследований. У 52 (76,4%) новорожденных детей, у которых в динамике наблюдалось улучшение клинической картины, уровень S100А12 в кале соответственно приближался к нормативным показателям.
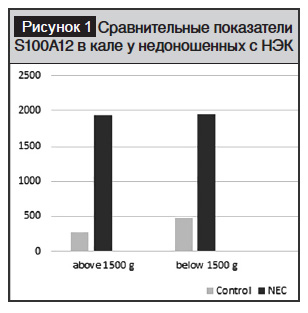
Согласно данным проведенных исследований, у младенцев с перфорацией отмечался повышенный уровень S100A12, который на фоне проведенияпротивовоспалительного лечения достоверно снижался. Учитывая изменения противовоспалительной активности S100A12 как ответной реакции организма на медикаментозное лечение, использование этого маркера позволяет осуществлять динамический контроль над клиническими признаками и течением заболевания. Следовательно,фекальный S100A12 можно использовать в качестве неинвазивного прогностического маркера развития НЭК у недоношенных детей с различной массой тела при рождении.
В нашем исследовании было проведено изучение экспрессии генов TLR2 и TLR4 у условно здоровых недоношенных и у недоношенных с диагностированным НЭК, имеющим массу тела более и менее 1500 г. Как видно из таблицы 3, относительные уровни экспрессии генов TLR2 и TLR4 у новорожденных с массой тела более 1500 г превышали показатели контрольной группы, хотя эти изменения были статистически не достоверны. В группе недоношенных с массой тела ниже 1500 г было обнаружено, что уровни экспрессии генов TLR4 и TLR2 различаются между группами (р<0,05). Уровень экспрессии гена TLR4 во II группе составил -4,81±4,01 у пациентов с НЭК и 0±1,07 в контрольной группе. Уровень экспрессии гена TLR2 составил -5,11±3,27 в группе больных и 0±0,78 в контрольной группе (р<0,05).
Таблица 3. Относительные уровни экспрессии генов TLR2 и TLR4 у новорожденных с НЭК (log2)
|
Показатель
|
Пациенты (n=20)
|
Контроль (n=15)
|
p
|
|
Выше 1500 г
|
|
TLR4
|
-0,24±2,65
|
0±3,59
|
0,891
|
|
TLR2
|
-1,22±2,58
|
0±3,59
|
0,375
|
|
Ниже 1500 г
|
|
TLR4
|
-4,81±4,01
|
0±1,07
|
<0,001
|
|
TLR2
|
-5,11±3,27
|
0±0,78
|
<0,001
|
На рисунке 2 обобщены данные об относительных уровнях экспрессии генов (2^-ddCt) у новорожденных. Относительная экспрессия TLR4 (2^-ddCt) у пациентов (выше и ниже 1500 г) составила 6,37 и 0,2 соответственно, в то время как в здоровой группе эти значения составляли 3,87 и 1,20. С другой стороны, относительная экспрессия TLR2 (2^-ddCt) была рассчитана для обеих групп: 1,67 и 0,11 для пациентов (выше и ниже 1500 г); у детей контрольной группы она была определена как 3,31 и 1,10.

В результате анализа относительной экспрессии (2^-ddCt) TLR4 y недоношенных с НЭК с массой тела выше 1500 гбыло обнаружена более высокая экспрессия TLR4 по сравнению со здоровыми новорожденными. Уровень относительной экспрессии (2^-ddCt) TLR2 y недоношенных с НЭК с очень низкой массой тела был достовернонижепоказателей контрольной группы (p<0,001). В результате анализа относительной экспрессии (2^-ddCt) TLR2(выше и ниже 1500 г), мы обнаружили, что она выше у здоровых новорожденных. Обнаружение экспрессии гена TLR4 в крови новорожденных с экстремально низкой массой тела при рождении считается предиктором дальнейшего развития НЭК.
Таким образом, у пациентов с некротическим энтероколитом выявлено повышение экспрессии TLR2 и TLR4 на уровне генов лейкоцитов в перифической крови по сравнению с условно здоровыминоворожденными. Данные показатели могут рассматриваться в качестве возможных маркеров диагностики и прогноза некротического энтероколита у недоношенных новорожденных с массой тела ниже 1500 г.
Заключение
Согласно полученным результатам, на основании достоверного повышения концентрации фекального S100A12 у недоношенных с некротическим энтероколитом можно сделать вывод, что S100A12 является важным маркером воспаления кишечника.Этот показатель может использоваться в качестве предиктора раннего выявления и контроля лечения недоношенных, которые входят в группу риска по развитию НЭК, в том числе осложненного течения с перфорацией. После секреции S100A12 передает сигналы воспаления через TLR4, активируя моноциты, вызывает воспаление, приводящее к активации цитокинов. Поэтому определение концентрации фекального S100A12 как неинвазивного маркера, отражающего нейтрофильное интестинальное воспаление, имеет важное значение в диагностике и прогнозе НЭК в неонатальном периоде.
Учитывая значительную роль TLR2 и TLR4 в патогенезе НЭК, в нашем исследовании изучена экспрессиягенов TLR2 и TLR4 у недоношенных новорожденных с НЭК и здоровых недоношенных новорожденных.
В результате изучения относительной экспрессии (2^-ddCt) TLR2 и TLR4 генов установлено статистически значимое изменение экспрессии этих генов в клетках периферической крови у глубоконедоношенных новорожденных с развившимся НЭК.
Таким образом, повышение уровня фекального S100A12 наряду с изменением экспрессии TLR2, TLR4, особенно у недоношенных детей с весом менее 1500 г, вызывая воспалительный процесс, приводит к увеличению поражения слизистой оболочки эпителия кишечника и способствует более агрессивному течению НЭК.
Л И Т Е Р А Т У Р А
1. Есиркепова А.Д., Сейдинов Ш.М. // Вестник Каз НМУ. – 2018. – №1. – С.134–136.
2. Трунова Т.Ю., Разин М.П., Ершкова М.М. // Вятский медицинский вестник. – 2019. – №1 (61). – С.31–35.
3. Карпова И.Ю. Некротизирующий энтероколит у новорожденных (новые способы прогнозирования и лечения): дисс. … д-ра мед.наук. – Омск, 2017.
4. Guillet R., Stoll B.J., Cotten C.M., et al. // Pediatrics. – 2006. – Vol.117, N2. – e137–e142.
5. Wassel J., Wallage M., Brewer E. // Annals of Clinical Biochemistry: International Journal of Laboratory Medicine. – 2012. – Vol.49, N1. – P.55–58. https://doi.org/10.1258/acb.2011.011106
6. Hessels J., Douw G., Yildirim D.D., et al. // Clinical Chemistry and Laboratory Medicine. – 2012. – Vol.50, N6. – P.79–82. https://doi.org/10.1515/cclm-2011-0855
7. Huang S.M., Chang Y.H., Chao Y.C., et al. // Molecular Nutrition & Food research. – 2013. – Vol.57, N12. – P.2264–2268. https://doi.org/10.1002/mnfr.201300275
8. Chiou J.W., Fu B., Chou R.H., Yu C. // PLoS One. – 2016. – Vol.11, N9. – https://doi.org/10.1371/journal.pone.0162000
9. Foell D., Wittkowski H., Kessel C., et al. // American Journal of Respiratory and Critical Care Medicine. – 2013. – Vol.187, N12. – P.1324–1334. doi: 10.1164/rccm.201209-1602OC
10. Lu P., Sodhi C.P., Hackam D.J. // Pathophysiology. – 2014. – Vol.21, N1. – P.81–93.
11. Le Mandat Schultz A., Bonnard A., Barreau F., et al. // PLoS One. – 2007. – Vol.2, N10. – e1102.
12. Hackam D.J., Sodhi C.P. // Cellular and Molecular Gastroenterology and Hepatology. – 2018. – Vol.6, N2. – P.229–238.
13. Hackam D.J., Good M., Sodhi C.P. // Semin Pediatr Surg. – 2013. – Vol.22, N2. – P.76–82.
14. Afrazi A., Sodhi C.P., Richardson W., et al. // Pediatr Res. Mar. – 2011. – Vol.69, N3. – P.183–188.
15. Fusunyan R.D., Nanthakumar N.N., Baldeon M.E., Walker W.A. // Pediatr Res. Apr. – 2001. – Vol.49, N4. – P.589–593.
16. Le Mandat Schultz A., Bonnard A., Barreau F., et al. // PloS one. – 2007. – Vol.2, N10. – e1102–e1102.
Медицинские новости. – 2023. – №2. – С. 77-80.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.