Внимание! Статья адресована врачам-специалистам
Lyudmila Kazeko, PhD, Associate Professor, Head of the 1st Department of Therapeutic Dentistry of the Belarusian State Medical University, Minsk
Evgeny Cherstvy, MD, Professor of the Department of Pathological Anatomy of the Belarusian State Medical University, Minsk
Kseniya Ruksha, Postgraduate Student of the Department of Pathological Anatomy of the Belarusian State Medical University, Minsk
Anna Portyanko, MD, Head of the Republican Molecular Genetic Laboratories of Carcinogenesis N.N. Alexandrov National Cancer Centre of Belarus, Minsk District, Belarus
Features of expression of matrix metalloproteinase-7 at different periodontitis
Цель. В ходе исследования определяли особенности экспрессии матриксной металлопротеиназы-7 (ММР-7) при быстропрогрессирующем и хроническом периодонтите.
Материалы и методы. Исследование проведено на биоптатах десны 27 пациентов, из них 12 пациентов с быстропрогрессирующим периодонтитом, 15 – с хроническим периодонтитом.
Результаты. При сравнении полученных результатов не было выявлено статистически значимых различий в экспрессии ММР-7 в группах с различным течением патологии, что свидетельствует о том, что ММР-7 не является диагностически значимой для определения характера течения заболевания.
Ключевые слова: матриксная металлопротеиназа-7, периодонтит, матрилизин.
Современная стоматология. – 2019. – №1. – С. 60–64.
Objective. The study is devoted to the determination of the characteristics of the expression of matrix metalloproteinase-7 (MMP-7) in patients with aggressive and chronic periodontitis.
Materials and methods. The study was performed on biopsy specimens of the gums of 27 patients, of which 12 patients were with aggressive periodontitis, 15 patients were with chronic periodontitis.
Conclusion. There were no statistically significant differences in the expression of MMP-7 in groups with different pathologies. The results of the study indicate that MMP-7 is not diagnostically significant for determining the nature of the disease.
Keywords: matrix metalloproteinase-7, periodontitis, matrilysin.
Sovremennaya stomatologiya. – 2019. – N1. – P. 60–64.
Периодонтит – инфекционное заболевание, характеризующееся воспалением десны и потерей периодонтальных тканей, включающих периодонтальную связку, цемент и альвеолярную кость. Заболевание имеет высокую распространенность (практически 100%), тяжелая форма встречается у 9–15% взрослого населения во всем мире [1, 6, 21]. Основной характеристикой периодонтита является прогрессирующая утеря прикрепления зуба и деструкция костной ткани. Скорость течения заболевания может значительно варьировать. В ряде случаев течение периодонтита приобретает «агрессивный» (быстропрогрессирующий) характер, приводит к ранней потере зубов. Быстропрогрессирующий характер течения периодонтита наблюдается, как правило, у соматически здоровых молодых людей (до 35 лет), в то время как хроническое течение периодонтита характерно для людей старшего возраста. Как хронический, так и быстропрогрессирующий периодонтит может протекать в тяжелых формах и приводить к потере зубов и вторичной адентии. Несмотря на небольшую распространенность быстропрогрессирующего периодонтита среди населения, сложности в ранней диагностике и лечении, быстрая потеря зубов в короткие сроки диктуют необходимость разработки методов ранней диагностики патологии.
Начало и течение периодонтита связано со специфической субгингивальной микрофлорой, образующей биопленку. Периодонтит наиболее часто ассоциируется с деятельностью Aggregatibacter actinomycetemcomitans, Tannerella forsythia, Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium nucleatum и Eikenella corrodens. Липополисахариды, вырабатываемые микроорганизмами биопленки, инициируют высвобождение медиаторов воспаления, в том числе цитокинов (IL-1, IL-6, IL-8 и др.), простагландинов и активных форм кислорода. Клинически процесс начинается как гингивит, затем происходит разрушение эпителия прикрепления, его апикальная миграция, сопровождающаяся образованием периодонтальных карманов, рецессией десны, подвижностью зубов и их патологической миграцией. Гистопатологически происходит гиперплазия десневого эпителия, соединительная ткань становится более васкуляризированной и инфильтрированной воспалительными клетками, преимущественно лимфоцитами, плазматическими клетками, нейтрофилами.
Активация провоспалительных цитокинов в ответ на микробные продукты также стимулирует активацию протеолитических ферментов, в том числе матриксных металлопротеиназ (ММР) – семейства цинк-зависимых эндопептидаз, которые участвуют в дезорганизации компонентов экстрацеллюлярного матрикса. Семейство ММР включает 24 структурно связанных, но генетически различных энзима, которые являются основными белками, ответственными за ремоделирование экстрацеллюлярного матрикса, и, как предполагается, участвуют в патогенезе периодонтита [7, 16, 18]. Экстрацеллюлярный матрикс представляет собой сложную многокомпонентную систему, обеспечивающую функционирование и физиологические свойства соединительной ткани. Коллаген является основным внеклеточным компонентом десны и периодонтальной связки, и при периодонтите происходит его альтерация. При активном прогрессировании болезни деструкция коллагена осуществляется преимущественно за счет MMP, которые играют ключевую роль в разрушении компонентов соединительной ткани. В зависимости от точек приложения разлагаемого субстрата и клеточной локализации, ММР разделены на 6 подгрупп: коллагеназы (MMP-1, -8 и -13), желатиназы (MMP-2 и -9), матрилизины (MMP-7 и -26), стромелизины (MMP-3, -10, -11 и -19) и другие мембранные ассоциации MMP (MMP-14, -15, -16, -17, -24 и -25). Кроме того, они могут взаимодействовать с различными биологически активными веществами, включающими цитокины, хемокины, компоненты комплемента, сывороточные белки, сигнальные белки и сывороточные молекулы, тем самым моделируя иммунный ответ [8, 16, 18]. Активность ММР контролируется уровнем экспрессии генов, влияющих на синтез их проферментов и специфических ингибиторов – тканевых ингибиторов матриксных металлопротеиназ (TIMP) [7, 15, 16, 18]. Нарушение соотношения синтеза и активации ММР и TIMP вызывает дисбаланс в разрушении тканей и восстановлении экстрацеллюлярного матрикса [17, 18]. Регуляция активности ММР имеет решающее значение для гомеостаза тканей [10, 17, 18]. Каждая MMP имеет субстратную специфичность, которая характеризуется способностью расщеплять практически все компоненты экстрацеллюлярного матрикса и базальных мембран [14, 19]. ММР участвуют в широком спектре физиологических процессов, включая морфогенез, заживление ран, ремоделирование тканей, ангиогенез и иммунный ответ на инфекцию [14, 23].
ММР-7, известная также как MMP-7, MPSL1, PUMP-1, матрилизин – фермент, кодируемый геном MMP-7 [11]. Участок ДНК, кодирующий человеческую MMР-7, был выделен в 1988 году Muller и соавт. [20], а фермент был открыт Sellers и Woessner в матке крыс также в 1988 году [25]. ММР-7 локализуется в хромосоме 11 q22.3, состоит из 267 аминокислот, отличается от большинства представителей металлопротеиназ тем, что в структуре не хватает домена С-терминального протеина гемопексина [4] и отличается наименьшим размером среди всех известных ММР [13, 24]. Отсутствие гемопексина обусловливает меньшее сродство ММР-7 к TIMP-1 [3].
ММР-7 определяется в аппарате Гольджи, органелле, вовлеченной в посттрансляционное преобразование и сортировку белков, играющей важную роль в процессах апоптоза, митоза и клеточной миграции. В отличие от других MMP, которые синтезируются в ответ на повреждение, ММР-7, в основном, вырабатывается в здоровом экзокринном эпителии и эпителии слизистых оболочек различной локализации, а не клетками соединительной ткани [2, 13]. ММР-7 синтезируется в виде профермента (про-ММР-7) и активируется эндопротеиназами и плазмином. В очаге воспаления уровень содержания ММР-7 несколько увеличивается (в том числе за счет расширения спектра клеток, ее синтезирующих, который включает эпителиальные клетки, фибробласты, нейтрофилы, лимфоциты), что может в итоге провоцировать активацию каскада реакций расщепления белковых субстратов, в основном, компонентов экстрацеллюлярного матрикса и нематриксных белков. При этом основными точками приложения действия ММР-7 являются компоненты экстрацеллюлярного матрикса, такие как коллаген III, IV, V, IX, X, XI типов, фибронектин, эластин, казеин, желатин [12, 20]. ММР-7 связывается с плазматической мембраной эпителия холестерол-содержащим доменом. Прикрепленная ММР-7 активна и резистентна к ингибированию TIMP. В свою очередь, активная форма MMР-7 активирует про-ММР-9 и ММР-2, наряду с TIMP-1.
Эти субстраты моделируют клеточные процессы, что дает основание предполагать, что ММР-7 может играть центральную роль в процессах инвазии, метастазирования и воспаления [22]. ММР-7 вовлечена в клеточную пролиферацию и апоптоз. Экспрессия ММР-7 ассоциируется с целым рядом онкологических заболеваний различной локализации: раком пищевода, колоректальным раком, гепатоцеллюлярной карциномой, раком поджелудочной железы, почечноклеточным раком.
О роли ММР в патогенезе периодонтитов известно недостаточно, а имеющиеся данные весьма противоречивы. Изучение характера экспрессии ММР при патологии периодонта в настоящее время представляет не только научный, но и практический интерес как с позиции объяснения некоторых аспектов патогенеза различных форм периодонтитов, так и определения значения характера экспрессии различных групп и типов ММР для ранней диагностики и прогнозирования характера течения периодонтита уже на этапе его манифестации и персонификации тактики ведения пациентов с патологией периодонта путем проведения своевременных индивидуальных профилактических мероприятий, направленных на предупреждение прогрессирования процесса, и индивидуализации терапии в зависимости от характера течения процесса.
Цель исследования – определить особенности экспрессии матриксной металлопротеиназы-7 в тканях периодонта при различном характере течения периодонтита.
Материалы и методы
Исследование проводилось на базе 1-й кафедры терапевтической стоматологии Белорусского государственного медицинского университета (Республиканская клиническая стоматологическая поликлиника). В исследование были включены пациенты с быстропрогрессирующим (n=12) и хроническим (простым и сложным) периодонтитом (n=15). Критериями включения в исследование явились клинико-рентгенологические признаки деструкции периодонта и возраст пациентов для быстропрогрессирующего периодонтита от – 18 до 35 лет, для хронического (простого и сложного) периодонтита – 36–60 лет. Критериями исключения явились: возраст пациентов до 18 лет и старше 60 лет; беременность или лактация (женщины); медицинский или психиатрический риск, нарушающий получение анамнестической информации; наличие острого инфекционного процесса челюстно-лицевой области; наличие сопутствующей соматической и инфекционной патологии; остеопороз и хронические заболевания, связанные с риском его развития; прием медикаментов, влияющих на минеральную плотность костной ткани (при подозрении на быстропрогрессирующее течение периодонтита). Было получено информированное согласие пациентов на участие в исследовании.
Стоматологическое обследование включало оценку гигиены полости рта (OHI-S), оценку тяжести воспаления десны (GI), определение глубины зондирования периодонтальных карманов и утери прикрепления (LA), также фиксировались рецессия десны, поражение фуркации, патологическая миграция зубов, их по-движность, наличие окклюзионной травмы; результаты регистрировались в перио-донтальной карте. Уровень и характер резорбции костной ткани оценивали при помощи панорамной рентгенографии и компьютерной томографии. Всем пациентам проведена профессиональная гигиена и закрытый кюретаж, во время которого выполнена биопсия мягких тканей периодонта.
Для оценки экспрессии ММР-7 в тканях периодонта было проведено иммунногистохимическое исследование биопсийного материала десен 27 пациентов, в 12 случаях из которых имел место быстропрогрессирующий периодонтит, в 15 – хронический периодонтит (простой и сложный).
Фрагменты ткани фиксировались в формалине, после чего изготавливались гистологические срезы толщиной 2,5 мкм и монтировались на предметные стекла, обработанные 3-аминопропилтриэтоксисиланом. Демаскировка антигенов проводилась в течение 30 с при температуре 125 ?С в нагреваемой барокамере Pascal (DAKO, Дания) в буфере pH 9,0. В качестве первичных использовались моноклональные мышиные антитела к ММР-7 (клон ID2, Invitrogen, США, 1:500). Инкубация с коктейлем из первичных антител проводилась в холодильной камере при 4 °C в течение 18 ч. Детекция связавшихся антител осуществлялась при помощи полимерной системы визуализации BioGenex Super Sensitive TM (SS) Polymer-HRP IHC Detection System (BioGenex, США). В качестве хромогена использовался диаминобензидин (DAKO, Дания), контрокрашивание проводилось гематоксилином Майера. В качестве положительного контроля использовались срезы толстой кишки с колоректальным раком, где паттерн окраски ММР-7 заведомо известен, в качестве отрицательного контроля применялось исключение инкубации с первичными антителами из протокола окрашивания.
В рамках проведения морфометрического анализа иммуногистохимической экспрессии ММР-7 выполнялась съемка гистологических препаратов каждого из случаев в 3 случайных непересекающихся полях зрения таким образом, чтобы поле зрения включало участок эпителия и стромы десны в равном соотношении. Оценка экспрессии ММР-7 проводилась отдельно в эпителиальном и стромальном компарт-ментах. В каждом поле зрения с помощью программы Aperio Image Scope v9.0 происходило автоматическое разделение пикселей по цвету в зависимости от интенсивности иммуногистохимического окрашивания. В дальнейшем, согласно преобладающему цвету (более 50% площади иммунопозитивных участков), экспрессию учитывали как отрицательную (синий цвет, показатель интенсивности более 220), слабую (желтый цвет, показатель интенсивности более 175–220), умеренную (оранжевый цвет, показатель интенсивности более 100–175) или выраженную (коричневый цвет, показатель интенсивности более –100).
Статистический анализ проводился с использованием пакета STATISTICA 12. Для оценки характера распределения полученных данных использовали критерий Шапиро – Уилка (W). Уровень статистической значимости устанавливался р<0,05. Сравнение бинарных признаков проводили с использованием точного (двустороннего) критерия Фишера. Сравнение независимых выборок по полуколичественным признакам осуществлялось с использованием дисперсионного анализа непараметрических данных ANOVA и определением критериев Краскела – Уоллиса (Н-критерий) для 3 и более выборок и Манна – Уитни (U-критерий) с целью парного сравнения выборок.
Результаты и обсуждение
Экспрессия ММР-7 наблюдалась во всех изученных случаях с различной степенью интенсивности. При иммуногистохимическом окрашивании ткани десны как при быстропрогрессирующем, так и при хроническом периодонтите для ММР-7 была характерна преимущественно ядерная или перинуклеарная локализация как в соединительной ткани и клетках воспалительного инфильтрата, так и в базальных отделах эпителия биопсийного материала десен (рис. 1).
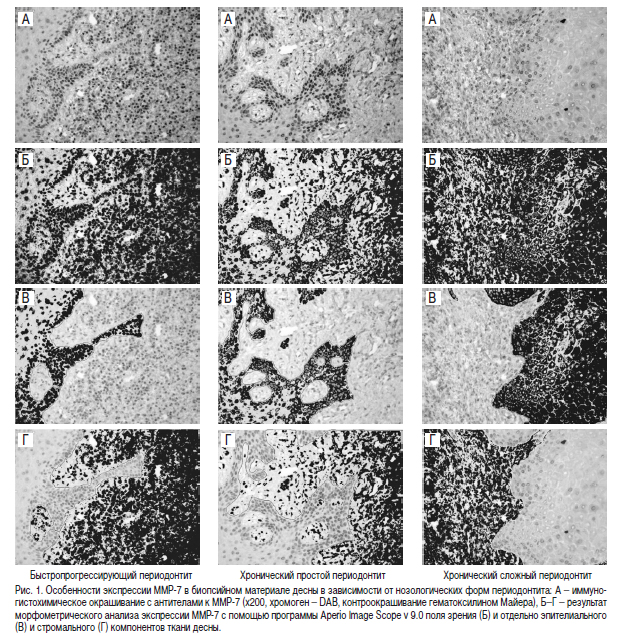
При визуальной оценке иммуногистохимических препаратов биопсийного материала десен преобладала слабая и умеренная как эпителиальная, так и стромальная экспрессия ММР-7, и отмечалась тенденция к более выраженной экспрессии ММР-7 в группе пациентов с хроническим течением периодонтита (см. рис. 1). Однако программный анализ экспрессии ММР-7 в ткани десны в зависимости от характера течения и формы периодонтита не выявил статистически значимых различий между группами (рис. 2) за исключением более интенсивного иммуногистохимического окрашивания фибробластов стромы и клеток воспалительного инфильтрата в группе пациентов с хроническим сложным периодонтитом по сравнению с быстропрогрессирующим.
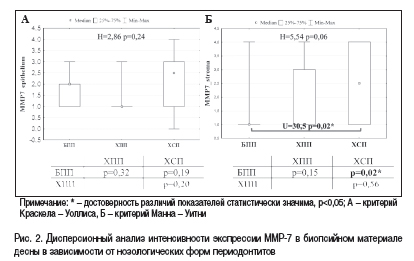
При объединении пациентов с признаками хронического (простого и сложного) периодонтита в одну группу с целью определения значения экспрессии ММР-7 в диагностике и прогнозировании характера течения периодонтита на этапе его манифестации, значимых различий между показателями в группах пациентов с быстропрогрессирующим и хроническим периодонтитом также не выявлено за исключением того, что при хроническом периодонтите выраженная стромальная экспрессия ММР-7 определялась в каждом третьем случае и частота ее выявления в 6 раз превышала таковую в группе пациентов с быстропрогрессирующим периодонтитом (таблица).
Таблица. Сравнение экспрессии ММР-7 в стромальном компоненте ткани десны в зависимости от характера течения периодонтита
|
Интенсивность экспрессии ММР-7
|
Быстропрогрессирующий периодонтит
|
Хронический простой и сложный периодонтит
|
Количество случаев, всего
|
|
Слабая и умеренная
|
11 (40,7%)
|
9 (33,4%)
|
20 (74,1%)
|
|
Точный критерий Фишера (двусторонний), p=0,75
|
|
Выраженная
|
1 (3,7%)
|
6 (22,2%)
|
7 (25,9%)
|
|
Точный критерий Фишера (двусторонний), p=0,03*
|
|
Количество случаев, всего
|
12 (44,4%)
|
15 (55,6%)
|
27 (100%)
|
|
Точный критерий Фишера (двусторонний), p=0,09
|
Полученные нами результаты согласуются с литературными данными, согласно которым экспрессия ММР-7 при хроническом и быстропрогрессирующем периодонтите сравнима и сопоставима с таковой при гингивите и здоровом периодонте [5]. Некоторые авторы полагают, что низкая экспрессия ММР-7 при патологии периодонта может быть связана с тем, что ММР-7 принимает участие в ранней защите тканей периодонта и не играет важной роли в развитии и прогрессировании периодонтита [5], так как основной функцией является иммунная защита слизистой оболочки полости рта и тканей периодонта [2].
Заключение
Согласно полученным нами результатам, экспрессия MMP-7 не является значимой в качестве молекулярно-биологического маркера при прогнозировании течения периодонтита на этапе его манифестации и не играет ключевой роли в патогенезе данного заболевания. Использование же ММР-7 для дифференциальной диагностики различных форм периодонтита на ранней стадии заболевания ограничено группами быстропрогрессирующего и хронического сложного периодонтита, для которых выявлены статистически значимо более высокие показатели интенсивности стромальной экспрессии ММР-7 у пациентов с хроническим течением заболевания.
ЛИТЕРАТУРА / REFERENCES
1. Advances in surveillance of periodontitis: the Centers for Disease Control and Prevention periodontal disease surveillance project / P.I. Eke, et al. Journal of Periodontology, 2012, vol.83, pp.1337–1342. doi:10.1902/jop.2012.110676
2. Bacterial exposure induces and activates matrilysin in mucosal epithelial cells / Y.S. Lopez-Boado, et al. J Cell Biol, 2000, vol.148, no.6, pp.1305–1315.
3. Contribution of the C-terminal domain of metalloproteinases to binding by tissue inhibitor of metalloproteinases. C-terminal truncated stromelysin and matrilysin exhibit equally compromised binding affinities as compared to full-length stromelysin / V.M. Baragi, et al. J Biol Chem, 1994, vol.269, pp.12692–12697.
4. Genes and Mapped Phenotypes. National Center for Biotechnology Information.
5. Gingival crevicular fluid matrix metalloproteinase (MMP)-7, extracellular MMP inducer, and tissue inhibitor of MMP-1 levels in periodontal disease / G. Emingil, et al. J Periodontol, 2006, vol.77, no.12, pp.2040–2050.
6. Global burden of severe periodontitis in 1990–2010: a systematic review and metaregression / N.J. Kassebaum, et al. Journal of Dental Research, 2014, vol.93, pp.1045–1053. doi:10.1177/0022034514552491
7. Host response mechanisms in periodontal diseases / N. Silva, et al. J Appl Oral Sci, 2015, vol.23, pp.329–355. doi:10.1590/1678-775720140259
8. Host-pathogen interactions in progressive chronic periodontitis / M. Hernandez, et al. Journal of Dental Research, 2011, vol.90, pp.1164–1170. doi:10.1177/0022034511401405
9. Human matrix metalloproteinases: an ubiquitarian class of enzymes involved in several pathological processes / D. Sbardella, et al. Molecular Aspects of Medicine, 2012, vol.33, pp.119–208. doi:10.1016/j.mam.2011.10.015
10. Khokha R., Murthy A., Weiss A. Metalloproteinases and their natural inhibitors in inflammation and immunity. Nature Reviews: Immunology, 2013, vol.13, pp.649–665. doi:10.1038/nri3499.
11. Mapping of the metalloproteinase gene matrilysin (MMP-7) to human chromosome 11q21->q22” / J.D. Knox, et al. Cytogenet Cell Genet, 1997, vol.72, pp.179–182.
12. Matrilysin (MMP-7) is a novel broadly expressed tumor antigen recognized by antigen-specific T cells / Y. Yokoyama, et al. Clin Cancer Res, 2008, vol.14, no.17, pp.5503–5511.
13. Matrix metalloproteinase-7, -8, -9, -13 in gingival tissue of patients with type I diabetes and periodontitis / S. Petra, O. Bogdan, M.S. Sorina, et al. Rom J Morphol Embryol, 2014, vol.55, pp.1137–1141.
14. Matrix metalloproteinase levels in children with aggressive periodontitis / A. Barnett, et al. Journal of periodontology, 2008, vol.79, no.5, pp.819–826.
15. Matrix metalloproteinases in cancer: from new functions to improved inhibition strategies / A.R. Folgueras, et al. International Journal of Developmental Biology, 2004, vol.48, pp.411–424. doi:10.1387/ijdb.041811af
16. Matrix metalloproteinases: contribution to pathogenesis, diagnosis and treatment of periodontal inflammation / T. Sorsa, et al. Annals of Medicine, 2006, vol.38, pp.306–321. doi:10.1080/07853890600800103
17. Matrix metalloproteinases: do they play a role in mucosal pathology of the oral cavity? / A.R. Al-Azri, et al. Oral Diseases, 2013, vol.19, pp.347–359. doi:10.1111/odi.12023
18. Mucin-4 and matrix metalloproteinase-7 as novel salivary biomarkers for periodontitis / А. Lundmark, et al. J Clin Periodontol, 2017, vol.44, no.3, pp.247–254.
19. Nagase H., Visse R., Murphy G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovasc Res, 2006, vol.69, pp.562–573.
20. Parks W.C., Mecham R.P. Matrix Metalloproteases. San Diego, Calif: Academic Press, 1998, 263 p.
21. Petersen P.E., Ogawa H. Strengthening the prevention of periodontal disease: the WHO approach. Journal of Periodontology, 2005, vol.76, pp.2187–2193. doi:10.1902/jop.2005.76.12.2187
22. The discovery of MMP7 inhibitors exploiting a novel selectivity trigger / K. Edman, et al. Chem Med Chem, 2011, vol.6, no.5, pp.769–773.
23. Uitto V.J., Overall C.M., McCulloch C. Proteolytic host cell enzymes in gingival crevice fluid. Periodontol 2000, 2003, vol.31, pp.77–104.
24. Wilson C.L., Matrisian L.M. Matrilysin: an epithelial matrix metalloproteinase with potentially novel function Int J Biochem Cell Biol, 1996, vol.28, no.2, pp.123–136.
25. Woessner J.F., Taplin C.J. Purification and properties of a small latent matrix metalloproteinase of the rat uterus. JBiolChem, 1988, vol.263, no.32, pp.16918–16925.
Конфликт интересов
Согласно заявлению авторов, конфликт интересов отсутствует.
Этические аспекты
Пациенты подписали письменное согласие. Документы рассмотрены и одобрены комитетом по этике.
Современная стоматология. – 2019. – №1. – С. 60-64.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.