Внимание! Статья адресована врачам-специалистам
Dotsenko E.А.1, Solodovnikova S.А.2, Bobkov V.Ya.1, Аlexeev N.А.3, Semak I.V.4
1Belarusian State Medical University, Minsk
25thCity Clinical Hospital, Minsk, Belarus
3Pharmaceutical company Minskintercaps, Minsk, Belarus
4Belarusian State University, Minsk
Bioequivalence and pharmacokinetics of two formulations
of aceclofenac capsules in healthy volunteers
Резюме. Сравнительное изучение биоэквивалентности лекарственного средства «Ацеклофенак-МИК» производства ПРУП «Минскинтеркапс», Республика Беларусь, в сравнении с лекарственным средством «Аэртал» производства Gedeon Richter Plc., Венгрия, показало сопоставимую биодоступность по полноте и скорости всасывания, что свидетельствует об их полной взаимозаменяемости. Лекарственное средство «Ацеклофенак-МИК» взаимозаменяемо с лекарственным средством «Аэртал», что обеспечивает белорусским пациентам финансово доступное лечение отечественным лекарственным препаратом.
Ключевые слова: биоэквивалентные испытания, ацеклофенак.
Медицинские новости. – 2017. – №1. – С. 53–57.
Summary. The results of bioequivalence studying of spironolactone two formulations, namely Aceclofenac-MIC (Pharmaceutical company Minskintercaps, Republic of Belarus) and Aertal (Gedeon Richter Plc., Hungary) in healthy volunteers demonstrated bioequivalence of the two products, that indicates on their complete substitutability. Medicinal product Aceclofenac-MIC is exchangeable with мedicinal product Aertal, which provides belarusian patients with treatment by domestic medicinal product with reasonable price.
Keywords: bioequivalence study, aceclofenac.
Meditsinskie novosti. – 2017. – N1. – P. 53–57.
Понятие «нестероидные противовоспалительные препараты» (НПВС) включает в себя группу лекарственных средств, основными эффектами которых являются противовоспалительный, анальгетический и жаропонижающий.
Важнейшим элементом любого воспалительного процесса являются эйкозаноиды – простагландины, лейкотриены, тромбоксан. Их биосинтез резко усиливается в самом начале воспалительного процесса, а в дальнейшем, по мере развития последнего, их синтез поддерживается иммунными механизмами воспаления [10].
Источником эйкозаноидов является арахидоновая кислота, которая высвобождается из фосфолипидов клеточных мембран под фоздействием фосфолипазы А2. В дальнейшем метаболизм арахидоновой кислоты протекает по трем основным путям.
1. Циклооксигеназный путь, обозначенный так по ключевому ферменту – циклооксигеназе (ЦОГ): в результате образуются простагландины, тромбоксан и простациклин.
2. Р450-монооксигеназный путь, по которому арахидоновая кислота окисляется до эйкозотетраеновых кислот.
3. Липооксигеназный путь, в результате которого образуются лейкотриены.
Согласно современным представлениям именно простагландины, образующиеся в результате воздействия ЦОГ и последующих ферментов, являются ключевыми медиаторами воспаления, которые обусловливают снижение болевого порога ноцирецепторов, повышенную чувствительность гипоталамуса к действию пирогенов, повышение проницаемости сосудистой стенки и т.д. [1].
Механизм действия НПВС связан с ингибированием ЦОГ и снижением вследствие этого уровня простагландинов. Следует помнить, что имеется по меньшей мере 2 изоформы ЦОГ: ЦОГ-1 – изофермент, присутствующий во всех тканях организма и регулирующий синтез простагландинов в физиологических условиях; ЦОГ-2 – индуцибельный изофермент, который появляется в условиях протекания воспалительной реакции.
Классификация НПВС учитывает как селективность ингибирования ЦОГ, так и выраженность эффекта – аналгетический, жаропонижающий, противовоспалительный.
К НПВС с выраженной противовоспалительной активностью относятся: салицилаты (ацетилсалициловая кислота (аспирин), дифлунизал, лизинмоноацетилсалицилат); пиразолидины (фенилбутазон); производные индолуксусной кислоты (индометацин, сулиндак); производные фенилуксусной кислоты (диклофенак, ацеклофенак); оксикамы (пироксикам, теноксикам, лорноксикам, мелоксикам); производные пропионовой кислоты (ибупрофен, напроксен, флурбипрофен, кетопрофен, тиапрофеновая кислота); алканоны (набуметон); производные сульфонамида (нимесулид, целекоксиб, рофекоксиб).
К НПВС со слабой противовоспалительной активностью относятся: производные антраниловой кислоты (мефенамовая кислота, этофенамат); пиразолоны (метамизол, аминофеназон, пропифеназон); производные парааминофенола (фенацетин, парацетамол); производные гетероарилуксусной кислоты (кеторолак).
С точки зрения клинициста, важным при выборе препарата для конкретного пациента является оценка риска развития побочных эффектов. По современным представлениям такой риск оценивается с учетом селективности НПВС в отношении ингибирования ЦОГ-2. «Линейка» НПВС простирается от неселективных по отношению к ЦОГ-2 (ингибирующих преимущественно ЦОГ-1) до высокоселективных к ЦОГ-2 (ингибирующих преимущественно ЦОГ-2). В первом случае блокада ЦОГ-1 наряду с противовоспалительными эффектами приводит к нарушению физиологических функций, в частности, снижению протективного эффекта в отношении желудочно-кишечного тракта (ЖКТ) и развитию НПВС-гастропатий и НПВС-энтеропатий. На другом конце «линейки» – селективные ингибиторы ЦОГ-2; селективная блокада ЦОГ-2 может приводить к нарушению соотношения тромбоксана А2 и простациклина, что обусловливает нарушения в системе свертывания крови и повышенное тромбообразование, следствием чего является повышенный риск сердечно-сосудистых катастроф (инфаркта миокарда и ишемического инсульта) [21].
К неселективным в отношении ЦОГ-2 относят аспирин, индометацин, кетопрофен, пироксикам, сулиндак. Выраженной селективностью в отношении ЦОГ-2 обладают коксибы: целекоксиб, рофекоксиб.
Отсюда вытекает глобальная стратегия назначения НПВС: у пациентов старшего возраста, с сердечно-сосудистым риском без существенных факторов риска НПВС-гастропатии, предпочтительнее назначение неселективных НПВС под прикрытием гастропротекторов, в то время как у лиц молодого возраста, без патологии сердечно-сосудистой системы (ССС), у лиц с выраженным риском гастропатии, нуждающихся в кратковременном лечении, предпочтительнее коксибы.
Между неселективными и селективными ингибиторами ЦОГ-2 расположены препараты, обладающие умеренной селективностью по отношению к ЦОГ-2. Можно выделить различные группы препаратов: с умеренной селективностью в отношении ЦОГ-1: диклофенак, ибупрофен, напроксен и др.; примерно равноценным ингибированием ЦОГ-1 и ЦОГ-2: лорноксикам; с умеренной селективностью в отношении ЦОГ-2: мелоксикам, нимесулид, набуметон. Их применение сопровождается меньшим числом осложнений со стороны ЖКТ и при этом не приводит к значительному нарастанию риска осложнений со стороны ССС.
Полагают, что оптимальным сочетанием ингибирующих концентраций ЦОГ-1/ЦОГ-2 обладает ацеклофенак, что делает его наиболее удачным НПВС, представителем «золотой середины» НПВС [5].
Ацеклофенак обладает высокой биодоступностью – после перорального приема он практически полностью всасывается, а пиковая концентрация в плазме наступает уже через 1–3 часа. Препарат метаболизируется в печени, причем интересно, что одним из дополнительных активных метаболитов ацеклофенака является диклофенак. Период полувыведения препарата составляет 4 часа, причем 70–80% экскретируется с мочой, а примерно 20% попадает в кал. Важным обстоятельством является то, что в синовиальной жидкости создается концентрация препарата, составляющая до 60% соответствующей концентрации в плазме. Кроме основного фармакологического эффекта ацеклофенак оказывает влияние на синтез цитокинов – интерлейкин-1 и фактор некроза опухоли-?. Ацеклофенак подавляет процесс интерлейкин-1-ассоциированной активации металлопротеиназ, следствием чего является положительное влияние ацеклофенака на синтез протеогликанов суставного хряща.
Ацеклофенак применяют для устранения болевого синдрома и снижения интенсивности воспалительного процесса у пациентов с воспалительной патологией опорно-двигательного аппарата (ревматоидный артрит, ювенильный и псориатический артрит, подагрический артрит, анкилозирующий спондилоартрит, остеоартроз), заболеваниях опорно-двигательного аппарата, сопровождающихся болью (например, плече-лопаточный периартрит), а также для устранения боли различного происхождения (поясничная, зубная боль и первичная дисменорея).
Препарат предназначен для перорального применения, капсулу проглатывают целиком, не разжевывая, запивая небольшим количеством питьевой воды. Взрослым обычно назначают по 1 капсуле 2 раза в сутки.
К наиболее частым нежелательным эффектам относят следующие. Со стороны системы пищеварения: тошнота, гастралгия, рвота, метеоризм, диспепсия, увеличение активности печеночных трансаминаз, эрозивно-язвенные поражения и перфорация желудочно-кишечного тракта, желудочно-кишечное кровотечение, гематемезис, молниеносный гепатит, мелена, запоры; нервной системы: головная боль, возбуждение, головокружение, нарушения восприятия, снижение памяти, парестезии, дезориентация, шум в ушах, нарушение слуха, зрения, вкусовых ощущений, нарушения сна, судороги, раздражительность, депрессия, тремор, тревожность, асептический менингит; мочевыделительной системы: периферические отеки, острая почечная недостаточность, протеинурия, гематурия, нефротический синдром, интерстициальный нефрит; системы кроветворения: тромбоцитопения, агранулоцитоз, лейкопения, апластическая анемия, гемолитическая анемия; ССС: повышение артериального давления, тахикардия, хроническая сердечная недостаточность. Кроме того, могут иметь место аллергические реакции: кожная сыпь, экзема, крапивница, эритродермия, бронхиальная астма, системные анафилактоидные реакции, васкулит, мультиформная экссудативная эритема (включая синдром Стивенса – Джонсона), пневмонит, токсический эпидермальный некролиз.
Ацеклофенак увеличивает плазменное содержание дигоксина, фенитоина, препаратов лития. На фоне совместного использования калийсберегающих диуретиков повышается риск развития гиперкалиемии, на фоне непрямых антикоагулянтов – кровотечений. Ацеклофенак снижает эффективность гипотензивных и диуретических препаратов, повышает риск развития побочных реакций глюкокортикостероидов и НПВС со стороны ЖКТ, нефротоксичность циклоспорина, токсичность метотрексата. При совместном использовании ацеклофенака с пероральными гипогликемическими препаратами возможны как гипер-, так и гипогликемия [4].
Цель настоящей работы – сравнительная оценка биодоступности (биоэквивалентности) и фармакокинетических профилей отечественного лекарственного средства Ацеклофенак-МИК (капсулы 100 мг, производство ПРУП «Минскинтеркапс», Республика Беларусь), в сравнении с лекарственным средством Аэртал, (таблетки, 100 мг, производство Gedeon Richter Plc., Венгрия), а также мониторинг безопасности в условиях их однократного перорального приема здоровыми добровольцами после приема пищи. Исследование выполнено по протоколу «ACEC-MIC-2015», версия 1, от 27.03.2015, утвержденному Министерством здравоохранения Республики Беларусь. Биоэквивалентные исследования проведены в соответствии с требованиями [9, 11, 16].
Материалы и методы
Лекарственные средства. В качестве тестируемого лекарственного средства (Т) использован Ацеклофенак-МИК, (капсулы 100 мг, производство ПРУП «Минскинтеркапс», Республика Беларусь, в качестве референтного (R) – Аэртал, таблетки 100 мг, производство Gedeon Richter Plc., Венгрия).
Этические аспекты. Клиническое испытание получило письменное одобрение комитетом по этике 5-й городской клинической больницы Минска. В этап скрининга включены пациенты, подписавшие письменное информированное согласие на участие в испытании. Участие в испытаниях было добровольным, добровольцы могли покинуть испытания: по собственному желанию без объяснения причин; по требованию врача-исследователя при нарушении добровольцем требований протокола; при появлении у добровольца лекарственной непереносимости.
Дизайн. Открытое, рандомизированное, перекрестное, в 2 периода и 2 последовательности, в условиях однократного приема лекарственных средств натощак у взрослых здоровых добровольцев. 30 здоровых добровольцев (24 – основной группы и 6 добровольцев-дублеров) были рандомизированы на 2 равные группы (по 15 человек). В 1-м периоде добровольцы 1-й группы принимали тестируемое лекарственное средство, 2-й – референтное. Во 2-м периоде добровольцы 1-й группы принимали референтное лекарственное средство, 2-й группы – тестируемое.
Отмывочный период между 1-м и 2-м периодами испытания составил 7 дней. Добровольцы принимали лекарственные средства в дозе 100 мг: 1 капсула тестируемого и 1 таблетка референтного препаратов. Запрещалось употреблять жидкость за 0,5 часа до и в течение 2 часов после приема лекарственного средства. В остальное время доброволец мог пить жидкость в любое время в объеме равном до 2000 мл в сутки. Последний прием пищи добровольцами не регламентировался. Во время пребывания в клиническом центре добровольцы обеспечивались 3-разовым питанием (в рамках стола Б), исключая кофеин-содержащие напитки и продукты (кофе, чай, какао, шоколад), фруктовые соки. Завтрак был организован через 4 часа, обед – спустя 7 часов, ужин – спустя 11 часов после приема лекарственного средства.
Критерии включения. В исследовании приняло участие 30 здоровых добровольцев, отобранных в соответствии со следующими критериями включения: возраст от 18 до 55 лет; верифицированный диагноз: «Здоров» по данным клинических, лабораторных и инструментальных методов обследования; масса тела ±30% от нормальных значений индекса массы тела (ИМТ); для женщин – отрицательный тест на беременность и согласие придерживаться адекватных методов контрацепции; информированное согласие подчиняться требованиям протокола по режиму питания и приему лекарственных средств. Один доброволец был исключен из исследования в связи с нарушением правил пребывания в клиническом центре; таким образом, биоэквивалентное исследование закончило 29 добровольцев.
Критерии невключения. Беременные, кормящие грудью женщины или женщины детородного возраста, не использующие адекватные средства контрацепции; отягощенный аллергологический анамнез; хронические заболевания сердечно-сосудистой, бронхолегочной, нейроэндокринной систем, а также заболевания ЖКТ, печени, почек, системы крови; хирургические вмешательства на ЖКТ в анамнезе; острые инфекционные заболевания менее чем за 4 недели до планируемого начала испытания, а также обнаружение инфекционных маркеров в крови; применение любых лекарственных средств или употребление алкоголя менее чем за 2 недели до начала исследования; прием лекарственных средств, оказывающих выраженное влияние на гемодинамику, активность печеночных ферментов и др.; донорство; выкуривание более 5 сигарет в день; вегетарианство; злокачественные новообразования в настоящее время или в анамнезе; участие в I фазе клинических испытаний лекарственных средств менее чем за 3 месяца до начала испытания.
Обследование добровольцев и безопасность. На этапе скрининга проводился сбор демографических данных, анамнеза, физикальный осмотр с регистрацией основных показателей жизнедеятельности (артериальное давление, частота сердечных сокращений, температура тела), ЭКГ, клинический лабораторный скрининг: общий анализ крови (ОАК), биохимический анализ крови (БАК), общий анализ мочи (ОАМ), серодиагностика сифилиса, ВИЧ-инфекции, HbsAg, anti-HCV, тест на беременность (для женщин).
Оценка безопасности применения лекарственных средств (развитие ожидаемых и неожиданных побочных реакций) проводилась при каждом физикальном осмотре пациентов с измерением частоты пульса, артериального давления (каждые 4 часа при пребывании добровольцев в клиническом центре и при окончании каждого периода), а также путем проведения ОАК, БАК, ОАМ через 24 часа при очередном отборе крови в амбулаторном режиме.
Точки отбора образцов крови. Забор венозной крови проводился до приема лекарственного средства, а также через 0,50; 0,75; 1,0; 1,25; 1,50; 2,0; 2,5; 3,0; 4,0; 6,0; 8,0; 10; 12; 24 часа после приема лекарственного средства.
Отбор образцов крови проводили путем пункции локтевой вены с установкой кубитального катетера. Отбирали 10 мл крови, которую помещали в предварительно промаркированную пробирку. Не позднее чем через 15 минут после получения крови пробирки центрифугировали в течение 10 минут при 3000 об./мин. Сыворотку после центрифугирования помещали в промаркированные пробирки и тотчас же консервировалась в криокамере при температуре не выше минус 30°С, где хранилась до начала проведения аналитического этапа.
Биоаналитическая процедура. Концентрация ацеклофенака определялась с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием по методике, разработанной и валидированной в Центре коллективного пользования оборудования биологического факультета Белорусского государственного университета.
Фармакокинетические параметры [3, 6, 8, 13, 25, 26].Для оценки временных профилей концентрации ацеклофенака использовали следующие параметры: Tmax – время достижения максимальной концентрации; Cmax – максимальная концентрация определяемого вещества в сыворотке крови; АUСt – площадь под фармакокинетической кривой до момента окончания исследования; АUC? – площадь под фармакокинетической кривой (при экстраполировании кривой в «бесконечность»).
Рассчитывали параметры сравнительной биодоступности f, f’, f”, а также отношения Cmax/AUCt и Cmax/AUC?, характеризующие скорость всасывания.
Статистический анализ [2, 12]. Ауксологические показатели добровольцев рассчитывались как среднее значение ± стандартное отклонение (Хср±SD) [2]. Все фармакокинетические параметры ацеклофенака рассчитывались методами описательной статистики. Дисперсионный анализ (ANOVA), двойные односторонние тесты оценки биоэквивалентности, 90% доверительный интервал для отношений среднего квадратического отклонения Т/R (тестируемое лекарственное средство/референтное лекарственное средство), оценка мощности и отношений проведены в отношении нетрансформированных и логарифмически трансформированных фармакокинетических параметров Cmax, AUC0-t, AUC0-t для каждого из определяемых веществ.
Двойной односторонний тест оценки биоэквивалентности и 90% доверительный интервал для отношений среднего квадратического отклонения Т/R также рассчитывался для нетрансформированных показателей Сt и kel и t1/2 для каждого из определяемых веществ.
Критерии эквивалентности. Гипотеза о биоэквивалентности испытуемого препарата и препарата сравнения принималась, если выполнялись условия:
1) 90% доверительные интервалы (при величине ошибки a=0,05 или р=0,95 с двусторонней оценкой доверительного интервала и мощности метода 1-b=0,8) для f, f’, f” находились в пределе 0,8–1,25 (что при логарифмической трансформации данных соответствует симметричному интервалу -0,223?0,223);
2) различия Cmax/AUCt и/или Cmax/AUC? недостоверны;
3) при однофакторном дисперсионном анализе показателей Сmax, AUCt и AUC? не выявлялись статистически достоверные различия как между препаратами, так и периодами их приема.
Результаты и обсуждение
Демографические показатели 30 добровольцев, участников БИ представлены в табл. 1. Средний возраст составил 37,5±12,60 года, рост – 172,5±10,69 см, масса тела – 76,4±11,60 кг, ИМТ – 25,6±3,01 кг/м2. Выделенные по результатам рандомизации группы добровольцев не отличались по указанным параметрам. Среди добровольцев было 18 женщин и 12 мужчин. Один из добровольцев (группа 1) был исключен из исследования в связи с нарушением режима пребывания в клиническом центре, таким образом, исследование завершили 29 человек.
Таблица 1. Демографические показатели Хср±SD
|
Показатель
|
Группа 1
|
Группа 2
|
Вся группа
|
|
Возраст, лет
|
37,5±12,60
|
29,7±8,27
|
33,6±11,34
|
|
Рост, см
|
172,5±10,69
|
171,1±8,37
|
171,8±9,63
|
|
Масса тела, кг
|
76,4±11,60
|
68,9±13,58
|
72,7±13,17
|
|
ИМТ, кг/м2
|
25,6±3,01
|
23,4±3,59
|
24,5±3,49
|
В процессе испытаний побочных реакций не отмечено, тестирумое и референтное лекарственные средства переносились удовлетворительно. Изменений лабораторных показателей (ОАК, БАК, ОАМ) через 24 часа после приема ацеклофенака не выявлено.
Сравнительная динамика концентраций ацеклофенака представлена на рисунке.
Фармакокинетические параметры тестируемого и референтного лекарственных средств для ацеклофенака представлены в табл. 2.
Таблица 2. Фармакокинетические параметры тестируемого (Ацеклофенак-МИК) и референтного (Аэртал) лекарственных средств (однократный прием 100 мг ацеклофенака натощак)
|
Параметр
|
Ацеклофенак-МИК
|
Аэртал
|
Фактор
эквивалентности, %
|
|
Сmax, мкг/мл
|
9,90±3,19
|
9,97±2,89
|
94,18–108,96%
|
|
tmax, час
|
1,48±0,70
|
1,52±0,81
|
–
|
|
AUC(0-24), мкг?час/мл
|
23,06±7,72
|
22,06±7,28
|
99,05–117,43%
|
|
AUC(0-?), мкг?час/мл
|
23,22±7,77
|
22,19±7,32
|
99,11–117,86%
|
|
t½ (моноэксп.?-фаза), час
|
2,53±0,42
|
2,45±0,47
|
–
|
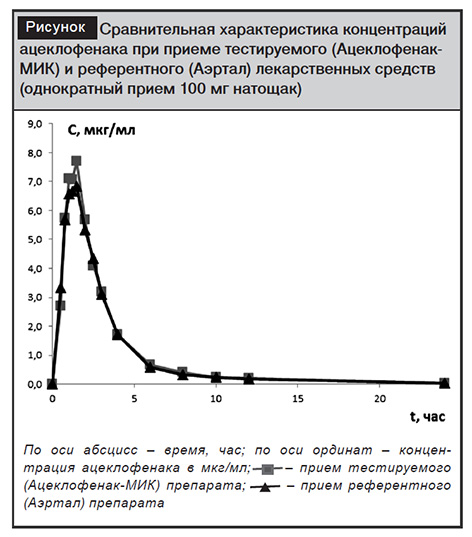
Сmax ацеклофенака составила 9,90±3,19 и 9,97±2,89 мкг/мл для Ацеклофенака-МИК и Аэртала соответственно. Результаты сходны как для тестируемого, так и для референтного препаратов. Похожие данные получены и другими авторами (табл. 3). Независимо от этнической принадлежности, половой структуры Сmax была приблизительно одинаковой; лишь в работе Asia Naz и соавт. [15], в которой авторы у 24 здоровых добровольцев пакистанского происхождения при приеме 100 мг ацеклофенака значения максимальной концентрации были несколько выше и достигали 13,39 мкг/мл.
Таблица 3. Сравнительная характеристика фармакокинетических параметров ацеклофенака
|
Источник
|
Cmax, мкг/мл
|
AUC(0-t), мкг*час/мл
|
AUC(0-∞), мкг*час/мл
|
Tmax, ч
|
T1\2, ч
|
|
Rhim S.Y. и соавт. [23]
|
9,79–10,57
|
19,93–19,95
|
20,48–20,75
|
нд*
|
нд
|
|
Naji Najib и соавт. [20]
|
8,64–9,36
|
21,88–22,65
|
23,17–24,02
|
1,91–1,99
|
3,30–3,36
|
|
Gowdaa K.V. и соавт. [19]
|
9,019–9,455
|
27,523–28,459
|
28,642–29,627
|
1,708–1,750
|
2,826–3,056
|
|
Ghosh S., Barik B.B. [18]
|
11,043–12,301
|
45,996–50,253 (t=24 часа)
|
нд
|
1,29–2,58
|
4,50–2,20
|
|
Asia Naz и соавт. [15]
|
13,39
|
28,99
|
29,82
|
1,5
|
3,05
|
|
Собственные данные (см. табл. 2)
|
9,90–9,97
|
23,06–22,06
|
23,22–22,19
|
1,48–1,52
|
2,45–2,53
|
Время достижения максимальной концентрации (Тmax, час) составило 1,48±0,70 и 1,52±0,81 часа для тестируемого и референтного препаратов соответственно, а время полувыведения – 2,53±0,42 и 2,45±0,47 часа для соответствующих препаратов. Полученные нами данные весьма близки к известным из литературы [15, 18–20, 23].
Площадь под кривой AUC∞ для ацеклофенака составила 23,22±7,77 и 22,19±7,32 мг*час/мл для тестируемого и референтного препаратов соответственно. Похожие данные приведены и в других исследованиях [20, 23]: AUC(0-∞) для ацеклофенака при приеме ацеклофенака в дозировке 100 мг составила 20–23 мкг*час/мл. В работах [15, 19, 22] площадь под кривой незначительно выше. Интересно, что при приеме 200 мг ацеклофенака (в 2 раза больше, чем в нашем исследовании) 24 здоровыми добровольцами в исследовании AUC(0-∞) была приблизительно в 2 раза больше – 45–50 мкг*час/мл [18].
Анализ мощности исследования, проведенный в соответствии с [3], показал, что мощность исследования превышала 80% на выборке в 29 человек (табл. 4). Таким образом, объем выборки в 29 человек удовлетворяет значению рассчитанного диапазона.
Таблица 4. Анализ мощности исследования
|
Параметр
|
Натощак
|
|
CV (%)
|
µT/µR
|
?
|
n
|
|
Cmax
|
16,4
|
0,99
|
=80
|
12
|
|
AUCt
|
19,2
|
1,05
|
=80
|
17
|
Выводы:
1. Лекарственные средства капсулы «Ацеклофенак-МИК» производства ПРУП «Минскинтеркапс» (Республика Беларусь) и таблетки «Аэртал» Gedeon Richter Plc.(Венгрия) являются биоэквивалентными, поскольку для действующего вещества – ацеклофенак – выполняются критерии сопоставимости оценки сравнительной биодоступности – доверительные интервалы для величин f, f’, f” не превышают диапазон 80,0–125,0% по максимальной концентрации данных соединений в сыворотке крови, площадям под фармакокинетическими кривыми в условии применения лекарственного средства до еды.
2. Мощность исследования по активному фармакологическому ингредиенту – ацеклофенаку – превысила 80% для выборки объемом 29 добровольца.
3. Лекарственные средства капсулы «Ацеклофенак-МИК» производства ПРУП «Минскинтеркапс» (Республика Беларусь) и таблетки «Аэртал» Gedeon Richter Plc.(Венгрия), обладают эквивалентными параметрами скорости абсорбции, поскольку для действующего вещества – ацеклофенак – отсутствуют статистически достоверные различия между отношениями максимальной концентрации всех изученных соединений испытуемых препаратов к площади при однократном приеме до еды.
4. Нежелательные эффекты при приеме лекарственных средств капсулы «Ацеклофенак-МИК» и таблетки «Аэртал» отсутствовали.
5. Лекарственное средство «Ацеклофенак-МИК» производства ПРУП «Минскинтеркапс» (Республика Беларусь) взаимозаменяемо с лекарственным средством «Аэртал» производства Gedeon Richter Plc. (Венгрия), что обеспечивает белорусским пациентам финансово доступное лечение отечественным лекарственным средством «Ацеклофенак-МИК».
Л И Т Е Р А Т У Р А
1. Василевский И.В. // Мед. новости. – 2014. – №7. – С.20–26.
2. Гланц С. Медико-биологическая статистика. Пер. с англ. – М., 1999.
3. Государственная фармакопея Республики Беларусь. Издание II. Т. 1. Общие методы контроля качества лекарственных средств. Регистрационные требования и правила проведения исследований биодоступности и биоэквивалентности генерических лекарственных средств / Центр экспертиз и испытаний в здравоохранении; под общ. ред. А.А. Шерякова – Молодечно, 2012. – С.1092–1129.
4. Инструкция по медицинскому применению лекарственного средства Ацеклофенак-МИК (http://www.mic.by/produkcija/section1/id492/).
5. Каратеев А.Е. // Совpeм. ревматология. – 2013. – №2. – С.88–94.
6. Каркищенко Н.Н., Хоронько В.В., Сергеева С.А., Каркищенко В.Н. // Фармакокинетика. – Ростов н/Д, 2001. – 384 с.
7. Насонова В.А. // РМЖ. – 2003. – №5. – С.235–240.
8. Пиотровский В.К. // Хим. фарм. журн. – 1985. – Т.19, №7. – С.782–790.
9. Проведение качественных исследований биоэквивалентности лекарственных средств. Методические указания / Под ред. В.Г. Кукеса, А.А. Фирсова, А.К. Стародубцева, В.П. Жердева: Утверждены МЗ РФ 10.08.04. – М., 2004. – 43 с.
10. Рождественский Д.А. // Лечебное дело. – 2016. – №3 (49). – С.16–30.
11. Руководство 42-7.1:2005 «Руководство по клиническим исследованиям. Лекарственные средства. Исследование биоэквивалентности и биодоступности». – Министерство здравоохранения Украины, Киев. – 2005.
12. Сергиенко В.И., Бондарева И.Б. Математическая статистика в клинических исследованиях. – М., 2000. – 256 с.
13. Холодов Л.Е., Яковлев В.П. Клиническая фармакокинетика. – М., 1985.
14. Чичасова Н.В. // РМЖ. – 2006. – №8. – С.600–610.
15. Asia Naz, Anwar Ejaz Beg, Khwaja Zafar Ahmed, et al. // J. Appl. Res. – 2011. – Vol.11, N1. – P.55–63.
16. CPMP/EWP/QWP/1401/98 Rev.1 Guidance on the Investigation of Bioequivalence. – London, 2010. – P.1–27.
17. Dvorchik B.H., Vesell E.S. // Clin. Pharmacol. Ther. – 1978. – Vol.23, N6. – P.617–623.
18. Ghosh S., Barik B.B. // Tropical J. Pharmac. Res. – 2010. – Vol.9, N4. – P.395–399.
19. Gowdaa K.V., Rajana D.S., Mandala U., et al. // Development Industr. Pharmacy Drug Development Industr. Pharmacy. – 2006. – Vol.32, Is.10. – P.1219–1225.
20. Naji Najib, Nasir Idkaidek, Beshtawi M., et al. // Biopharmaceutics & Drug Disposition. – 2004. – Vol.25, Is.3. – P.103–108.
21. Hina Hasnain, Huma Ali, Anum Tariq, et al. // J. Bioequival. Bioavailability. – 2016. – Vol.8, N2. – P.84–88.
22. Park E.W., Song W.H., Cha Y.J., Choi Y.W. //.J. Appl. Pharmacology. – 1998. – N6. – P.423–428
23. Rhim S.Y., Park J.H., Park Y.S., et al. // Clin. Ther. – 2008. – Vol.30, N4. – P.633–640.
24. Schulz M., Schmoldt A. // Pharmazie. – 2003. – Vol.58. – P.447–474.
25. Wagner J.G. // J. Pharmacokinet. Biopharm. – 1976. – Vol.4, N3. – P.281–285.
26. Yamaoka K., Nakagawa T., Uno T. // J. Pharmacokinet. Biopharm. – 1978. – Vol.6, N6. – P.547–558.
Медицинские новости. – 2017. – №1. – С. 53-57.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.