Внимание! Статья адресована врачам-специалистам
Trisvetova E.L., Zybalova T.S., Ponomarenko I.N.
Belarusian State Medical University, Minsk
Chronic right ventricular heart failure: causes, diagnosis, treatment
Резюме. В последние десятилетия доказан вклад дисфункции правого желудочка, возникающей при левожелудочковой сердечной недостаточности, легочной гипертензии, в заболеваемость и смертность. Симптомы правожелудочковой недостаточности на ранних стадиях малоспецифичны, наиболее информативными диагностическими методами являются эхокардиография, магнитно-резонансная томография, определение уровня натрийуретических пептидов. Рекомендации по медикаментозному лечению правожелудочковой сердечной недостаточности, помимо препаратов, применяемых при левожелудочковой сердечной недостаточности, включают коррекцию давления в легочной артерии и легочного сосудистого сопротивления.
Ключевые слова: дисфункция правого желудочка, сердечная недостаточность, этиология, механизмы развития, клинические симптомы, лечение.
Медицинские новости. – 2017. – №1. – С. 31–36.
Summary. In the past decade the contribution proved right ventricle dysfunction occurs when left ventricular heart failure, pulmonary hypertension in morbidity and mortality. Symptoms of right heart failure in the early stages malospetsifichnye most informative diagnostic methods include echocardiography, magnetic resonance imaging, to determine the level of natriuretic peptides. Recommendations for medication right ventricular heart failure, in addition to drugs for left ventricular heart failure, include correction pressure in the pulmonary artery and pulmonary vascular resistance.
Keywords: right ventricular dysfunction, heart failure, etiology, mechanisms of development, clinical symptoms, treatment.
Meditsinskie novosti. – 2017. – N1. – P. 31–36.
За последние десятилетия возрос интерес к нарушениям функции правого желудочка в связи с исследованиями, доказавшими вклад дисфункции правого желудочка в заболеваемость и смертность при сердечной недостаточности. Установлено, что доля правожелудочковой недостаточности составляет 15–20% среди всех случаев хронической сердечной недостаточности и функция правого желудочка является важным прогностическим фактором выживаемости пациентов с врожденными пороками сердца, легочной гипертензией, сердечной недостаточностью [1–4]. Симптомы правожелудочковой недостаточности на ранних стадиях малоспецифичны, со скудными клиническими проявлениями, в дальнейшем при прогрессировании процесса неумолимо приводящие к манифестирующей сердечной недостаточности и смерти. Выявление предрасполагающих состояний и заболеваний, ранних признаков правожелудочковой сердечной недостаточности способствует своевременному проведению лечебных мероприятий [5, 6].
К особенностям строения правого желудочка относят наличие трех основных анатомических областей: синус – приносящий тракт, трабекулярная верхушка и конус – выносящий тракт, представляющий гладкостенное образование. Выносящий тракт отделяется от приносящего тракта четырьмя мышечными образованиями: самой массивной стенкой сердца – межжелудочковой перегородкой; париетальной, модераторной и септальной поверхностями. Три створки клапана легочной артерии (правая, левая, передняя) находятся выше аортальных и располагаются в области верхушки выносящего тракта. Трикуспидальный клапан и клапан легочной артерии не имеют общего фиброзного кольца в отличие от митрального и аортального клапанов [4, 7].
Мышечная масса правого желудочка составляет 1/6 массы левого желудочка, что объясняется функциональными особенностями камер сердца. Правый желудочек перекачивает тот же объем крови, что и левый желудочек, вместе с тем его энергетические затраты намного ниже и составляют 25% от работы левого желудочка из-за низкого сопротивления легочных сосудов [4]. Левый и правый желудочки в эмбриогенезе закладываются из разных клеток-предшественниц. В составе правого желудочка более высокая доля тяжелых мио-зиновых цепей, обусловливающих более быстрое, но менее энергосберегающее сокращение, к тому же предполагают различное реагирование правого и левого желудочков на адренергические агенты [8, 9].
Более тонкие и растяжимые стенки правого желудочка по сравнению со стенками левого желудочка обусловливают лучшую переносимость избыточного объема, но не повышения давления в полости. При повышении давления в легочной артерии после короткого периода адаптации миокарда в виде гипертрофии развивается систолическая дисфункция с сохраненной фракцией выброса, далее систолическая дисфункция со сниженной фракцией выброса правого желудочка [10, 11].
Кровоснабжение правого желудочка осуществляется преимущественно правой коронарной артерией. От артерии отходят 1–2 ветви, кровоснабжающие равными потоками в систолу и диастолу переднюю стенку правого желудочка. Левая передняя нисходящая коронарная артерия кровоснабжает передние две трети межжелудочковой перегородки, а задняя нисходящая артерия – папиллярные мышцы правого желудочка, заднюю стенку правого желудочка и задний отдел межжелудочковой перегородки [7].
Правожелудочковая недостаточность определяется как комплексный клинический синдром, развивающийся в результате структурных или функциональных расстройств сердца, ухудшающих способность правых отделов сердца к заполнению или опорожнению [2]. К основным клиническим признакам правожелудочковой недостаточности относят задержку жидкости в организме в виде периферических отеков и/или асцита; уменьшение систолического резерва или синдром низкого сердечного выброса, проявляющийся снижением толерантности к физическим нагрузкам, усталостью, когнитивными расстройствами; предсердные или желудочковые тахиаритмии [11].
Основными патологическими механизмами, возникающими в сердечно-сосудистой системе при правожелудочковой недостаточности считают:
– ослабление работы правого желудочка из-за его недостаточного заполнения (при трикуспидальном стенозе);
– уменьшение ударного объема правого желудочка;
– рефлекторное учащение работы сердца (рефлекс Бейнбриджа);
– замедление тока крови и повышение давления в венозной системе большого круга кровообращения;
– пропотевание жидкой части крови за пределы сосудов в ткани различных органов;
– увеличение количества восстановленного гемоглобина в венозной крови;
– нарушение фильтрационной и реабсорбционной функции почек.
Распространенной причиной, вызывающей нарушение функции правого желудочка, является легочная гипертензия, развивающаяся при разных клинических состояниях и заболеваниях. Классификация легочной гипертензии представленная в Рекомендациях Европейского общества кардиологов и Европейского общества пульмонологов, предложенных в 2009 году и дополненных в 2015 году, включает 5 групп клинических состояний [12]:
– легочная артериальная гипертензия с вено-окклюзионной болезнью легких и персистирующей легочной гипертензией новорожденных;
– легочная гипертензия вследствие патологии левых камер сердца;
– легочная гипертензия вследствие патологии легких и/или гипоксии;
– хроническая тромбоэмболическая легочная гипертензия и другие виды обструкции легочной артерии;
– легочная гипертензия с неясными или множественными механизмами.
Перегрузка правого желудочка, возникающая в результате повышения давления в легочной артерии и легочного сосудистого сопротивления, приводит к развитию компенсаторной гипертрофии миокарда, затем интерстициального фиброза. Благодаря гипертрофированному миокарду в течение короткого промежутка времени сохраняется или возрастает сократительная функция правого желудочка, поддерживающая необходимый ударный объем, вместе с тем сокращается время диастолического расслабления [13]. По мере прогрессирования патологического процесса развивается дилатация правого желудочка, форма желудочка трансформируется в сферическую, обеспечивающую создание более значительного механического усилия во время систолы. Повышается потребность в кислороде и жесткость миокарда, снижается коронарная перфузия (особенно в эндокарде). В дальнейшем при развитии дилатации правого желудочка уменьшается толщина стенок, повышается их систолическое напряжение, увеличивая потребность миокарда в кровоснабжении. Снижается сократительная способность миокарда, и появляются признаки декомпенсации, характеризующиеся повышением давления наполнения, диастолической дисфункцией и снижением сердечного выброса правого желудочка [3, 13].
На фоне дилатации правого желудочка происходит растяжение правого атриовентрикулярного кольца и развивается трикуспидальная недостаточность, которая приводит к перегрузке объемом правого желудочка, снижению объема крови, изгоняемого в легочную артерию, снижению наполнения левого желудочка. Появление клинических признаков правожелудочковой сердечной недостаточности III или IV функционального класса (NYHA) свидетельствует о высоком риске смерти (>10%) в течение года пациента с легочной гипертензией [13, 14].
Считают, что наиболее частой причиной дисфункции правого желудочка является левожелудочковая сердечная недостаточность [3, 4, 15]. Механизмы развития правожелудочковой недостаточности в этом случае разнообразны и не до конца изучены, представлены следующими расстройствами сердечно-сосудистой системы:
– увеличение постнагрузки и повышение давления в левом предсердии, легочных венах, далее в легочных артериях и правом желудочке в результате снижения сократительной функции левого желудочка;
– патологические изменения при кардиомиопатиях, одновременно возникающие в левом и правом желудочках;
– нарушения кровотока (ишемия) при ишемической болезни сердца могут возникать в обоих желудочках одновременно;
– снижение перфузии правого желудочка в результате ослабления сократительной функции левого желудочка;
– появление дисфункции правого желудочка в результате смещения межжелудочковой перегородки при увеличении объема или давления в левом желудочке;
– нарушение функции левого и правого желудочков сердца при появлении выпота или констриктивного патологического процесса в полости перикарда.
Прогрессирование застойной сердечной недостаточности усугубляется за счет еще одного механизма, вызывающего поражение правого желудочка. В результате расстройства кровотока в малом круге кровообращения и вентиляции легких нарушается диффузия газов, снижается диффузионная емкость альвеолярно-капиллярной мембраны, вызывающие изменения газового состава крови (рис. 1).

Исследователи отметили у 1/3 пациентов с левожелудочковой недостаточностью и сохраненной фракцией выброса (HFpEF) появление дисфункции правого отдела сердца в виде снижения сократительной способности правого желудочка [15]. Факторами риска дисфункции правого желудочка сердца при левожелудочковой дисфункции с сохраненной фракцией выброса часто являются мужской пол, легочная гипертензия, фибрилляция предсердий, регургитация на трикуспидальном клапане, электростимуляция правого желудочка [16].
При нарушении функции правого желудочка, появляющемся у пациентов с дисфункцией левого желудочка с сохраненной фракций выброса, увеличивается частота госпитализаций и повышается риск общей и сердечно-сосудистой смертности [14]. Дисфункцию правого желудочка считают пессимистичным прогностическим признаком при многих заболеваниях левого желудочка (ишемическая кардиомио-патия, острый инфаркт миокарда левого желудочка, миокардит) [15, 16].
В развитии и прогрессировании правожелудочковой недостаточности отмечают роль многих факторов, среди которых нарушения нейрогуморальной и иммунологической регуляции [4]. Установлено повышение активности ренин-ангиотензин-альдостероновой и симпатоадреналовой системы, дисфункция эндотелия, метаболические нарушения, изменения активности ионных каналов, участвующих в процессах сокращения и расслабления кардиомиоцитов [9].
Среди нейрогормонов, участвующих в развитии правожелудочковой сердечной недостаточности, отмечают важную роль ангиотензина II, катехоламинов и натрийуретических пептидов [3]. Уровень натрийуретических пептидов, особенно BNP, коррелирует со значением легочного артериального давления и легочного сосудистого сопротивления у пациентов с легочной артериальной гипертензией [17].
Жалобы и объективные признаки правожелудочковой сердечной недостаточности неспецифичные, важное значение имеют анамнез и жалобы, появившиеся при заболевании, которое обусловило развитие дисфункции правого желудочка.
Основными симптомами сердечной недостаточности являются одышка, ортопноэ, слабость, усталость, снижение толерантности к физической нагрузке, головокружение, абдоминальный дискомфорт, боль в области сердца и/или в правом подреберье, кровохарканье, свистящее дыхание, отеки на лодыжках [4].
При объективном исследовании определяют пульсацию слева от грудины в четвертом межреберье, увеличение размеров правого желудочка (при значительной гипертрофии и/или дилатации), при аускультации сердца – усиление второго тона во втором межреберье слева, пансистолический шум в случае трикуспидальной недостаточности, шум Грехема – Стилла, аритмии. К признакам правожелудочковой недостаточности относятся пульсация шейных вен, гепатомегалия, периферические отеки, асцит.
Наиболее информативными и доступными в клинической практике исследованиями в диагностике правожелудочковой сердечной недостаточности являются эхокардиографический метод и определение уровня предсердного и мозгового натрийуретического пептида. Наряду с ними используют результаты рутинных исследований (электрокардиография, рентгенография), дополняющие представление об этиологии и выраженности правожелудочковой недостаточности [12].
Электрокардиографическое исследование позволяет выявить изменения, обусловленные поражением миокарда, перикарда или пороком сердца, признаки гипертрофии и перегрузки правого желудочка, дилатацию и гипертрофию правого предсердия. Вместе с тем отмечают низкую специфичность признаков – расширения комплекса QRS, нарушения проводимости в виде блокады правой ножки пучка Гиса и повышения вольтажа зубца P [1]. Желудочковые аритмии возникают редко, наджелудочковые аритмии встречаются часто в виде экстрасистолии, фибрилляции предсердий. Отсутствие изменений на электрокардиограмме не исключает поражения правого желудочка сердца.
При рентгенологическом исследовании органов грудной клетки выявляют изменения, характерные для заболеваний, вызвавших легочную гипертензию: поражение легочного интерстиция, сосудов малого круга кровообращения, увеличение размеров сердца и изменения его формы. В случае легочной гипертензии отмечают повышение прозрачности легочных полей на периферии вследствие обеднения легочного рисунка, выбухание ствола и левой ветви легочной артерии, формирующих II дугу по левому контуру сердца (прямая проекция), расширение корней легких, увеличение правых отделов сердца [12].
Эхокардиографический метод относится к основным неинвазиным методам оценки систолической и диастолической функции правого желудочка [1,11]. Трансторакальная и чреспищеводная эхокардио-графия позволяют оценивать состояние камер сердца, толщину стенок, структуру и функцию клапанного аппарата, состояние начальных отделов аорты и легочной артерии с измерением давления в последней. Поскольку податливость стенок правого желудочка высокая, при повышении постнагрузки – легочного сосудистого сопротивления и нагрузки, обусловленной левыми отделами сердца, появляется концентрическая гипертрофия и дилатация правого желудочка, оцениваемые по базальному (норма RVD1 – 2,0–2,8 см), срединному (норма RVD2 – 2,7–3,3 см) диаметрам и продольному размеру (норма RVD3 – 7,1–7,9 см) [2].
Рассчитывают амплитуду систолического движения латерального трикуспидального кольца – высокоспецифичный показатель систолической экскурсии плоскости трикуспидального кольца (TAPSE – tricuspid annular plane systolic excursion). О нарушении функции правого желудочка и повышении давления в малом круге кровообращения свидетельствует TAPSE <1,8 см [2]. По мнению P.R. Forfia и соавт., снижение TAPSE на 1 мм у пациентов с легочной артериальной гипертензией на 17% увеличивает риск смерти [18].
Эхокардиографический метод позволяет оценить вероятность легочной гипертензии по пиковой скорости трикуспидальной регургитации (м/сек), времени ускорения кровотока в выносящем тракте правого желудочка <105 м/сек и/или средне-систолическому прикрытию, уплощению межжелудочковой перегородки, скорости ранней диастолической легочной регургитации >2,2 м/сек, увеличению диаметра легочной артерии >25 мм [2, 19].
Степень тяжести легочной гипертензии определяют по разнице показателей систолического и среднего давления в легочной артерии, рассчитанных с использованием уравнения Бернулли при наличии трикуспидальной недостаточности. Проводят полуколичественную оценку давления в правом предсердии по диаметру и степени коллабирования нижней полой вены на вдохе. Диаметр нижней полой вены >2,1 см и спадение при вдохе <50% или при спокойном дыхании <20% свидетельствуют о высоком давлении в правом предсердии (10–20 мм рт. ст.). Об увеличении размеров правого предсердия свидетельствует возрастание его площади >18 см2 [12].
В отличие от расчетной фракции выброса левого желудочка, который имеет правильную форму, расчет фракции выброса правого желудочка вызывает трудности в связи с его сложной формой и недостатками стандартных методов оценки объемов правого желудочка. Для количественной оценки используют показатели фракции изменения площади правого желудочка (FAC – Fractional Area Change), коррелирующий с фракцией выброса правого желудочка (r=0,88) по данным магнитно-резонансной томографии [20].
Дополнительную оценку функции правого желудочка проводят методом тканевого допплеровского исследования скорости движения кольца трикуспидального клапана или индекса производительности миокарда (индекс Tei). Индекс производительности (MPI – Myocardial Performance Index) рассчитывают по соотношению общего времени изоволюмической активности к времени, затраченному на систолическое изгнание по формуле (IVRT+IVCT)/ET, где IVRT – isovolumic relaxation time; IVCT – isovolumic contraction time; ET – ejection time [21]. Допплеровское тканевое исследование позволяет изучать деформацию и скорость деформации правого желудочка (Strain/Strain-Rate) – маркеры сократительной силы, независимые от преднагрузки.
Показатели Strain/Strain-Rate более точно отражают региональную функцию правого желудочка по сравнению с TAPSE [2, 22]. Эхокардиографические изменения правого желудочка появляются при поражении >25% сосудистого русла малого круга кровообращения [22].
С помощью трехмерной эхокардиографии в режиме реального времени (RT3DE) реконструируют очертания структур и камер сердца, оценивая размеры правого желудочка и предсердия. Исследователи отмечают сопоставимость показателей объемов и фракции выброса правого желудочка, полученных при RT3DE и магнитно-резонансной томографии. Высокая корреляционная связь была отмечена для показателя глобальной продольной деформации (RV GLS) [23].
Для оценки состояния правого желудочка применяют методы визуализации: компьютерную томографию высокого разрешения, магнитно-резонансную томографию и радионуклидное исследование с ангиографией.
По результатам компьютерной томографии высокого разрешения, компьютерной томографии с усилением и ангиопульмонографией получают данные о ширине легочной артерии (норма <29 мм) и размерах правого желудочка, состоянии легочной ткани и сосудов малого круга кровообращения, врожденных пороках сердца и других причинах легочной гипертензии [11].
Магнитно-резонансная томография – наиболее точный метод оценки размеров, структуры и функции правого желудочка. По результатам метода измеряют кровоток, включая ударный объем, сердечный выброс, растяжимость легочной артерии, массу правого желудочка [22].
Катетеризацию правых камер сердца проводят для оценки тяжести гемодинамических изменений: измерение давления в легочной артерии, правом предсердии, правом желудочке, давления заклинивания легочной артерии, при легочной гипертензии и правожелудочковой сердечной недостаточности – и выполнения теста на вазореактивность сосудов легких [12].
Тест на вазореактивность при легочной артериальной гипертензии проводят с целью выявления пациентов, подходящих для лечения высокими дозами блокаторов кальциевых каналов. Снижение среднего давления в легочной артерии ≥10 мм рт. ст. до достижения абсолютного значения среднего давления в легочной артерии ≤40 мм рт. ст. в сочетании с повышенным или прежним сердечным выбросом после ингаляции оксида азота или внутривенного введения эпопростенолола либо аденозина (или ингаляции илопроста) расценивают как положительный тест [12].
К методам, подтверждающим наличие хронической сердечной недостаточности, относится определение в плазме крови уровня натрийуретических пептидов: предсердного (ANP), мозгового натрийуретического пептида (BNP) и пептид-предшественника pro-BNP, N-концевого фрагмента пептида предшественника – NT-proBNP [23]. Секреция гормонов повышается в случае органического поражения и объемной перегрузки миокарда предсердий (ANP), желудочков (BNP), особенно при увеличении конечного диастолического давления в левом желудочке [17]. При постепенном развитии симптомов хронической сердечной недостаточности диагностическим значением BNP является уровень более 35 пг/мл, а NT-proBNP – более 125 пг/мл [24].
К показаниям для определения натрийуретических пептидов относятся скрининговые исследования с целью выявления пациентов с высокой вероятностью наличия сердечной недостаточности; диагностика сердечной недостаточности на ранних стадиях; оценка эффективности проводимой терапии при сердечной недостаточности; оценка прогноза течения заболевания у пациентов с сердечной недостаточностью [24]. Низкие показатели BNP и NT-proBNP отмечают при ожирении [24].
Исследователи выделяют и другие биомаркеры сердечной недостаточности, отражающие, по меньшей мере, 7 патобио-логических процессов: миокардиальный стресс (ST2, адреномедуллин), повреждение кардиомиоцитов (кардиоспецифические тропонины I, T), воспаление (С-реактивный протеин, фактор некроза опухоли-?, интерлейкин-6, галектин-3), почечную дисфункцию (нейтральная желатиназа, липокаин, креатинин), оксидативный стресс (мочевая кислота), нейрогормональную активность (BNP и NT-proBNP), уровень которых повышается при возрастании риска неблагоприятного исхода, ремоделирование экстрацеллюлярного матрикса (галектин-3, металлопротеиназы) [25].
С целью предупреждения развития и прогрессирования правожелудочковой сердечной недостаточности рекомендуют своевременное лечение заболеваний, являющихся причиной дисфункции правого желудочка. Определенные успехи в лечении сердечной недостаточности отмечают в связи с применением трех классов препаратов (ингибиторы АПФ – каптоприл, эналаприл, лизиноприл и др. / блокаторы рецепторов ангиотензина II – кандесартан, лозартан, валсартан, антагонисты альдостерона – спиронолактон, эплеренон и бета-адреноблокаторы – бисопролол, небиволол, метопролол сукцинат, карведилол), кардиовертеров-дефибрилляторов и ресинхронизирующей терапии (рис. 2).
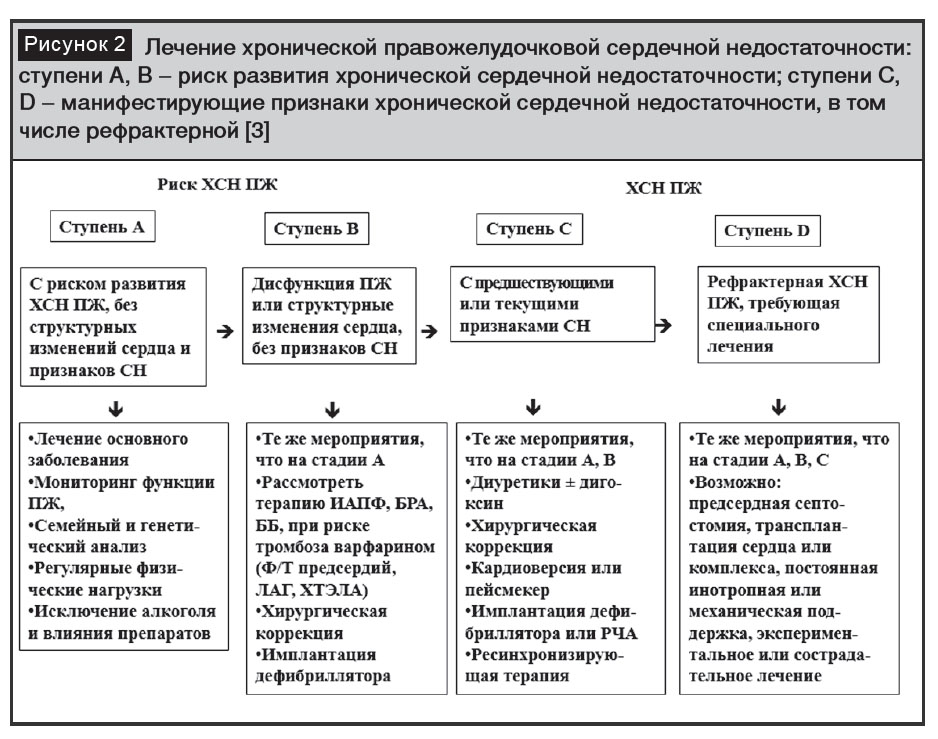
В многоцентровом рандомизированном исследовании ATLAS (Assessment of Treatment with Lisinopril and Survival trial) определены оптимальные переносимые и эффективные дозы лизиноприла у пациентов с хронической сердечной недостаточностью, обусловленной систолической дисфункцией левого желудочка. Отмечено преимущество высоких доз лизиноприла 32,5–35 мг/сутки в отношении предупреждения риска смерти у пациентов функционального класса II [26]. Назначение лизиноприла (Диротон, ОАО «Гедеон Рихтер»), как и других ингибиторов АПФ, показано при хронической сердечной недостаточности с сохраненной и сниженной фракцией выброса левого желудочка.
Блокаторы рецепторов ангиотензина II, оказывая антигипертензивное действие и снижая системное и легочное артериальное давление, влияют также на функциональное состояние легких. Исследования показали, что в случае легочной гипертензии, появившейся в результате хронической обструктивной болезни легких, лозартан (Сентор, ОАО «Гедеон Рихтер») в дозе 50–100 мг/сутки позволяет предотвращать или вызывает регресс признаков воспалительных изменений в легких, улучшая тем самым функцию респираторной системы [27].
В исследовании HEAAL доказано дозозависимое действие лозартана при сердечной недостаточности. Применение 150 мг/сутки против 50 мг/сутки лозартана у пациентов с артериальной гипертензией и ишемической болезнью сердца приводило к снижению смертности и частоты госпитализаций пациентов (на 11%) с сердечной недостаточностью и сниженной фракцией выброса с непереносимостью ингибиторов АПФ [28, 29].
Успехи в лечении хронической правожелудочковой недостаточности гораздо скромнее, терапевтические методы направлены на оптимизацию пред-, постнагрузки и сократимости миокарда с учетом этиологии заболевания.
В случае заболеваний с легочной гипертензией и положительным тестом на вазореактивность медикаментозное лечение начинают с вазодилатации, применяя блокаторы кальциевых каналов (нифедипин-ретард, дилтиазем, амлодипин, исрадипин-ретард, фелодипин-ретард) в средних терапевтических дозах, постепенно повышая их до рекомендованных максимальных [12].
Амлодипин (Нормодипин, ОАО «Гедеон Рихтер») относится к препаратам первого ряда у пациентов с легочной гипертензией и правожелудочковой сердечной недостаточностью. Клинико-гемодинамические эффекты (снижение давления в легочной артерии, уменьшение легочного сосудистого сопротивления, стабилизация заболевания от 3 до 30 месяцев) при длительном применении амлодипина наблюдают в 50% случаев. Пятилетняя выживаемость у пациентов с легочной гипертензией при применении блокаторов кальциевых каналов составляет 94%, в случае не использования препаратов этого класса – 55% [27]. У пациентов с сердечным индексом более 2,1 л/мин/м2, и/или сатурацией О2 венозной крови более 63%, и/или давлением в правом предсердии менее 10 мм рт. ст. и с отрицательной острой пробой вазодилататоры не показаны [12].
Показания к назначению оральных антикоагулянтов (варфарин) включают высокий риск развития тромботических осложнений, обусловленных венозной тромбоэмболией, гиподинамией, сердечной недостаточностью, повышенным риском катетер-ассоциированного тромбоза в случае длительного внутривенного введения аналогов простациклина [12]. Доступными, не требующими тщательного лабораторного контроля, являются дезагреганты (аспирин, покрытый кишечнорастворимой оболочкой), которые применяют при легочной гипертензии.
Диуретики и антагонисты альдостерона назначают при декомпенсированной правожелудочковой сердечной недостаточности, согласно рекомендациям по лечению сердечной недостаточности [23].
Дигоксин увеличивает сердечный выброс при болюсном введении, его эффективность при длительном назначении неизвестна. Несомненно, для снижения частоты сердечных сокращений, при суправентрикулярных тахиаритмиях дигоксин оказывается полезным [12].
Специфическое лечение проводится в виде моно- или комбинированной терапии с применением аналогов простациклина, агонистов рецепторов простациклина, ингибиторов фосфодиэстеразы-5, антагонистов рецепторов эндотелина.
Благоприятный эффект аналогов простациклина обусловлен ингибицией агрегации тромбоцитов, цитопротекторным и антипролиферативным действием. Препараты группы аналогов простациклина улучшают переносимость физической нагрузки, улучшают течение заболевания, повышают толерантность к физической нагрузке, влияют на гемодинамику [12, 25]. При наличии правожелудочковой недостаточности (III–IV функциональный класс по NYHA (New York Heart Association)) в лечении легочной гипертензии применяют длительную внутривенную инфузию простациклина или его аналогов [30].
Ингибитор фосфодиэстеразы-5 (силденафил) проявляет вазодилатирующее и антипролиферативное действие, при применении улучшает клиническое состояние, повышает толерантность к физической нагрузке при диастолической сердечной недостаточности [12].
Антагонисты рецепторов эндотелина применяют, основываясь на экспрессии эндотелина-1 в легких, вызывающего вазоконстрикторный и митогенный эффекты, и его роли в патогенезе легочной гипертензии. Препараты улучшают функциональное состояние пациентов, оказывают положительное влияние на скорость прогрессирования заболевания, гемодинамику при легочной артериальной гипертензии (идиопатической, ассоциированной с системными заболеваниями соединительной ткани) [31].
Таким образом, правожелудочковая сердечная недостаточность обусловлена многими состояниями и заболеваниями, включающими болезни миокарда, приобретенные (ишемическая болезнь сердца) и генетические (кардиомиопатии), легочную артериальную гипертензию и легочную гипертензию, характерную для многих легочных и сердечных заболеваний, поражение перикарда. Клинические и объективные признаки правожелудочковой сердечной недостаточности появляются в поздние сроки и нередко скрываются симптомами левожелудочковой сердечной недостаточности. Для своевременной диагностики и выбора медикаментозного лечения необходим комплексный подход, направленный на выявление возможных причин правожелудочковой недостаточности и признаков структурных и функциональных изменений правого желудочка, полученных при инструментальных и лабораторных исследованиях.
Л И Т Е Р А Т У Р А
1. Ho S.Y., Nihoyannopoulos P. // Heart. – 2006. – Vol.92 (Suppl.1). – P.i2–i13.
2. Rudski L.G., Lai W.W., Afilalo J., et al. // J. Am. Soc. Echocardiogr. – 2010. – N23. – P.685–713.
3. Voelkel N.F., Quaife R.A., Leinwand L.A., et al. // Circulation. – 2006. – Vol.114. – P.1883–1891.
4. Haddad F., Hunt S.A., Rosenthal D.N., Murphy D.J. // Circulation. – 2008. – Vol.117. – P.1436–1448.
5. SkhiriM., Sharon A. HuntS.A., et al. // Rev. Esp. Cardiol. – 2010. – Vol.63, N4. – P.451–471.
6. Бокерия Л.А., Беришвили И.И. Хирургическая анатомия сердца. В 3-х томах. – М., 2006.
7. Михайлов С.С. Клиническая анатомия сердца. – М.,1987. – 288 c.
8. Reiser P.J., Portman M.A., Ning X.H., et al. // Am. J. Physiol. Heart Circ. Physiol. – 2001. – Vol.280. – P.H1814–1820.
9. Wang G.Y., McCloskey D.T., Turcato S., et al. // Am. J. Physiol. Heart Circ. Physiol. – 2006. – Vol.291. – P.H2013–2017.
10. Louie E.K., Lin S.S., Reynertson S.I., et al. // Circulation. – 1995. – Vol.92. – P.819–824.
11. Sadeghpour A., Alizadehasl1 A. // Arch. Cardiovasc. Imaging. – 2015. – Vol.3 (4). – P.e35717.
12. Galiè N., Humbert M., Vachiery J-L., et al. // Eur. Heart J. – 2016. – N37. – P.67–119.
13. Sheehan F., Redington A.N. // Heart Vessels. – 2008. – Vol.94. – P.1510–1515.
14. Zakeri R., Mohammed S.F. // Curr Heart Fail Rep. – 2015. – Vol.12, N5. – P.295–301.
15. Melenovsky V., Hwang S-J, Lin G., et al. // Eur. Heart J. – 2014. – N35. – P.3452–3462.
16. Iglesias-Garriz I., Olalla-Gomez C., Garrote C., et al. // Rev. Cardiovasc. Med. – 2012. – N13. – P.e62–69.
17. Pruszczyk P. // J. Cardiac. Fail. – 2005. – N11. – S65–S69.
18. Forfia P.R., Fisher M.R., Mathai S.C., et al. // Am. J. Respir. Critical Care Med. – 2006. – Vol.174, N9. – P.1034–1041.
19. Kjærgaard J. // Dan. Med. J. – 2012. – Vol.59, N3. – B4409.
20. Maceira A.M., Prasad S.K., Khan M., et al. // Eur. Heart J. – 2006. – N27. – P.2879–2888.
21. Giusca S., Dambrauskaite V., Scheurwegs C., et al. // Heart. – 2010. – Vol.96, N4. – P.281–288.
22. Anavekar N.S., Gerson D., Skali H., et al. // Echocardiography. – 2007. – N24. – P.452–456.
23. Ponikowski P., Voors A.A., Anker S.D., et al. // Eur. Heart J. – 2016. – N37. – P.2129–2200.
24. Madamanchi C., Alhosaini H., Sumida A., et al. // Int. J. Cardiol. – 2014. – Vol.176. – P.611–617.
25. Braunvald E. // JACC. – 2013. – N1. – P.1–20.
26. Packer M., Poole-Wilson P., Armstrong P. et al. // Circulation. – 1999. – Vol.100, N23. – P.2312–2318.
27. Fisnman A.P. // New Eng. J. Med. – 1998. – Vol.338, N5. – P.273–277.
28. Sharma D., Buysw M., Pitt B., et al. // J. Am. Coll. Cardiol. – 2000. – N35. – P.187–192.
29. Konstam M.A., Neaton J.D., Dickstein К., et al. // Lancet. – 2009. – Vol.374 (9704). – P.1840–1848.
30. McLaughlin V.V., Shillington A., Rich S. // Circulation. – 2002. – N6. – P.1477–1482.
31. Guazzi M., Samaja M., Arena R., et al. // J. Am. Coll. Cardiol. – 2007. – Vol.50. – P.2136–2144.
Медицинские новости. – 2017. – №1. – С. 31-36.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.