|
-
Главная
-
Журнал «Медицинские новости»
-
Архив
-
№10, 2016
-
Независимые предикторы развития неблагоприятных сердечно-сосудистых событий у больных хронической сердечной недостаточностью ишемического генеза с сохраненной фракцией выброса левого желудочка и почечной дисфункцией

Сыволап В.Д., Лашкул Д.А.
Независимые предикторы развития неблагоприятных сердечно-сосудистых событий у больных хронической сердечной недостаточностью ишемического генеза с сохраненной фракцией выброса левого желудочка и почечной дисфункцией
Запорожский государственный медицинский университет, Украина
Внимание! Статья адресована врачам-специалистам
Syvolap V.D., Lashkul D.A.
Zaporizhzhya State Medical University, Ukraine
Independent predictors of adverse cardiovascular events
in patients with ischemic chronic heart failure with preserved ejection fraction
and renal dysfunction
Резюме. С целью выявления независимых прогностических факторов развития неблагоприятных сердечно-сосудистых событий (ССС) проведено обследование и наблюдение в течение трех лет за 243 пациентами (80,3% мужчин, средний возраст 58,7±9,3 года) с хронической сердечной недостаточностью ишемического генеза с сохраненной фракцией выброса левого желудочка и почечной дисфункцией. Анализ результатов наблюдения показал, что ССС в течение периода наблюдения возникли у 54 (22,2 %) пациентов, среди которых внезапная сердечная смерть – у 7 (2,8 %), повторный фатальный инфаркт миокарда – у 5 (2,1 %), возникла необходимость в госпитализации в связи с декомпенсацией сердечной недостаточности у 32 (13,2 %), нефатальный повторный инфаркт миокарда – у 5 (2,1 %), нефатальный инсульт – у 5 (2,1 %). Методом регрессионного анализа пропорциональных рисков Кокса определены независимые предикторы развития неблагоприятных ССС у больных с хронической сердечной недостаточностью ишемического генеза с сохраненной фракцией выброса левого желудочка и почечной дисфункцией в течение трех лет наблюдения: индекс объема левого предсердия >12,96 см3/м2 и скорость клубочковой фильтрации ≤71,25 мл/мин/1,73м2.
Ключевые слова: сердечная недостаточность, прогноз, почки.
Медицинские новости. – 2016. – №10. – С. 82–86.
Summary. In order to identify independent predictors of major adverse cardiovascular events (MACE) examined and monitored for three years for 243 patients (80.3% men, mean age 58.7±9.3 years) with ischemic chronic heart failure with preserved ejection fraction and renal dysfunction. Analysis of results showed that the MACE occurred in 54 (22.2%) patients, including - sudden cardiac death in 7 (2.8%), re-fatal myocardial infarction in 5 (2.1%), hospitalization due to decompensated heart failure in 32 (13.2%), non-fatal reinfarction in 5 (2.1%), nonfatal stroke in 5 (2.1%). Independent predictors of MACE using stepwise multivariate regression analysis of Cox proportional hazards in patients with ischemic chronic heart failure with preserved ejection fraction and renal dysfunction during the three years of follow up are the left atrium volume index >12.96 cm3/m2 and a glomerular filtration rate ≤71.25 ml/min/1,73m2.
Keywords: heart failure, prognosis, kidney.
Meditsinskie novosti. – 2016. – N10. – P. 82–86.
Запорожский государственный медицинский университет, УкраинаНесмотря на достижения последних десятилетий, хроническая сердечная недостаточность (ХСН) остается одним из распространенных и неуклонно прогрессирующих заболеваний, сопровождающихся высокой смертностью. Долгое время тяжесть ХСН ассоциировалась с нарушением систолической функции желудочков, оцениваемой по величине фракции выброса левого желудочка (ФВ ЛЖ). В настоящее время большое внимание уделяется оценке диастолической функции ЛЖ [6]. В национальном срезовом исследовании UNIVERS среди всех больных ХСН 66,6% пациентов имели ФВ ЛЖ >45% [1]. Для описания таких пациентов используется термин ХСН с сохраненной ФВ ЛЖ (ХСН-СФВ). Обсервационные и проспективные исследования, проведенные в течение последних 15 лет, свидетельствуют о том, что прогноз больных ХСН-СФВ может быть столь же плохим, как и при ХСН со сниженной ФВ [11].
В последние годы большое внимание уделяется концепции кардио-ренального синдрома. Распространенность дисфункции почек у пациентов с ХСН, по данным различных исследований, варьирует от 25 до 60%. Дисфункция почек катастрофически ухудшает прогноз у лиц с ХСН и низкой ФВ ЛЖ [12]. Представляет интерес вопрос влияния состояния почечной функции на течение и прогноз больных ХСН-СФВ. В связи с этим актуальным для клиницистов является изучение особенностей течения ХСН-СФВ с почечной дисфункцией, поиск клинических, биохимических и гемодинамических прогностических факторов.
Цель исследования – выявить прогностические факторы развития неблагоприя-тных сердечно-сосудистых событий (ССС) у больных с ХСН ишемического генеза с сохраненной ФВ ЛЖ и почечной дисфункцией по результатам трехлетнего наблюдения.
Материалы и методы
Исследование проведено на базе отделения аритмий и сердечной недостаточности Коммунального учреждения «Областной медицинский центр сердечно-сосудистых заболеваний» Запорожского областного совета. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципов Хельсинской Декларации. Протокол исследования был одобрен этическим комитетом Запорожского государственного медицинского университета (протокол №6 от 20.09.2012). До включения в исследование у всех участников было получено письменное информированное согласие. В исследование включены 243 больных (200 (80,3%) мужчин) ХСН ишемического генеза, средний возраст 58,7±9,3 года. Общая характеристика пациентов с ХСН ишемического генеза с сохраненной ФВ ЛЖ представлена в табл. 1. ХСН диагностировали и оценивали согласно Рекомендаций по диагностике и лечению ХСН (2012) Ассоциации кардиологов Украины и Украинской Ассоциации специалистов по сердечной недостаточности, ХСН с сохраненной ФВ определяли при ФВ ЛЖ >45% [2]. Этиология ХСН: у 221 (90,9 %) больного было сочетание ишемической болезни сердца (ИБС) и гипертонической болезни, у 22 (9,1 %) – ИБС. ХСН IIфункционального класса (ФК) диагностирована у 112 (46,1 %) больных, III ФК – у 126 (51,8%), IVФК – у 5 (2,1 %) пациентов. Инфаркт миокарда (ИМ) в анамнезе был у 165 (67,9%) больных. Скорость клубочковой фильтрации (СКФ) рассчитали по формуле MDRD (Modification of Diet in Renal Disease).
Таблица 1. Общая характеристика больных ХСН ишемического генеза с сохраненной ФВ ЛЖ
|
Показатель, единица измерения
|
Общая когорта (n=243)
|
Пациенты с ССС (n=54)
|
Пациенты без ССС (n=189)
|
р3-4
|
|
1
|
2
|
3
|
4
|
5
|
|
Возраст, лет
|
58,7±9,3
|
63,3±9,8
|
57,4±8,7
|
<0,0001
|
|
Мужчины, n (%)
|
200 (82,3)
|
46 (85,2)
|
154 (81,5)
|
0,52
|
|
АГ, n (%)
|
221 (90,9)
|
52 (96,3)
|
169 (89,4)
|
0,12
|
|
ИМ в анамнезе,
n (%)
|
165 (67,9)
|
43 (79,6)
|
122 (64,5)
|
0,02
|
|
ФП, n (%)
|
32 (13,2)
|
18 (33,3)
|
14 (7,4)
|
<0,0001
|
|
Курение, n (%)
|
72 (29,6)
|
17 (31,5)
|
55 (29,1)
|
0,73
|
|
ЛПНП >1,8 ммоль/л, n (%)
|
194 (79,8)
|
44 (81,5)
|
150 (79,4)
|
0,56
|
|
СД, n (%)
|
40 (16,5)
|
11 (20,4)
|
29 (15,3)
|
0,37
|
|
ФК ХСН ІІІ–IV, n (%)
|
131 (53,9)
|
36 (66,7)
|
95 (50,3)
|
0,03
|
|
Шкала Борга, баллы
|
4,3±1,3
|
5,1±1,2
|
4,1±1,2
|
<0,0001
|
|
САД, мм рт.ст.
|
137,7±19,5
|
133,1±15,9
|
139,0±20,3
|
0,06
|
|
ДАД, мм рт.ст.
|
84,9±11,1
|
81,8±10,6
|
85,7±11,1
|
0,03
|
|
ЧСС, уд./мин
|
73,9±12,8
|
78,2±17,6
|
72,7±10,8
|
0,03
|
|
ІМТ, кг/м2
|
30,3±5,4
|
31,4±5,4
|
30,0±5,3
|
0,14
|
|
СКФ, мл/мин/1,73м2
|
78,1±18,1
|
71,2±18,5
|
80,0±17,5
|
0,0001
|
|
Креатинин, ммоль/л
|
91,4±17,3
|
98,7±18,4
|
89,2±16,5
|
<0,0001
|
|
NT-proBNP, пг/мл
|
153 [42–431]
|
451 [235–908]
|
42 [26–153]
|
0,0002
|
|
Цистатин С, нг/мл
|
1087 [925–1424]
|
1285 [1045–1837]
|
955 [895–1276]
|
0,002
|
|
Макроальбуминурия, n (%)
|
52 (21,4)
|
17 (31,5)
|
35 (18,5)
|
0,04
|
|
ОЛП, см3
|
45,0±16,4
|
53,7±24,5
|
41,9±10,9
|
0,04
|
|
ИОЛП, см3/м2
|
11,5±3,8
|
13,8±5,7
|
10,6±2,5
|
0,01
|
|
КДР, см
|
5,23±0,55
|
5,44±0,61
|
5,17±0,52
|
0,0006
|
|
КДО, мл
|
118,1±32,8
|
132,8±45,3
|
113,5±26,4
|
0,005
|
|
ТЗСЛЖ, см
|
1,20±0,18
|
1,27±0,16
|
1,18±0,18
|
0,0004
|
|
ФВ, %
|
59,2±8,4
|
56,6±8,1
|
60,0±8,4
|
0,01
|
|
ИММЛЖ, г/м2
|
136,7±29,7
|
153,5±31,6
|
131,4±27,1
|
<0,0001
|
|
ДЛАсист., мм рт.ст.
|
27,1±8,8
|
30,7±10,8
|
25,6±7,4
|
0,01
|
|
МР, степень
|
1,12±0,7
|
1,42±0,9
|
1,03±0,6
|
0,002
|
|
Лечение, n (%)
|
|
ИАПФ/БРА
|
214/25 (98,3)
|
51/2 (98,1)
|
163/23 (98,4)
|
0,89
|
|
Бета-блокаторы
|
222 (91,3)
|
49 (90,7)
|
173 (91,5)
|
0,85
|
|
Диуретики
|
130 (53,5)
|
31 (57,4)
|
99 (52,4)
|
0,51
|
|
АМР
|
40 (16,5)
|
13 (24,1)
|
27 (14,3)
|
0,08
|
|
Антиагреганты
|
229 (94,2)
|
49 (90,7)
|
180 (95,2)
|
0,21
|
|
Статины
|
233 (95,9)
|
51 (94,4)
|
182 (96,3)
|
0,54
|
|
Дигоксин
|
8 (3,3)
|
3 (5,6)
|
5 (2,64)
|
0,29
|
|
Антагонисты
кальция
|
64 (26,3)
|
14 (25,9)
|
50 (26,4)
|
0,93
|
|
Триметазидин
|
75 (30,9)
|
16 (29,6)
|
59 (31,2)
|
0,82
|
Допплерэхокардиографическое исследование проводили на аппарате «VIVID 3 Expert», (General Electric, США) по стандартной методике. Определяли переднезадний размер левого предсердия (ЛП), индекс объема левого предсердия (ИОЛП), переднезадний размер левого желудочка (ЛЖ) в систолу (КСР) и диастолу (КДР), толщину межжелудочковой перегородки (ТМЖП) и задней стенки (ТЗС) ЛЖ в диастолу, рассчитывали ФВ ЛЖ, массу миокарда (ММ) ЛЖ, индекс ММ (ИММ) ЛЖ – как соотношение ММ ЛЖ к площади поверхности тела. В импульсном допплеровском режиме изучались показатели трансмитрального потока: максимальная скорость быстрого раннего диастолического наполнения (Е) и максимальная скорость (А) наполнения ЛЖ во время систолы ЛП (см/с), их отношение (Е/А). Соотношение максимальной скорости раннего диастолического наполнения к максимальной скорости ранней диастолической волны движения фиброзного кольца митрального клапана (E/Eann), по данным тканевой допплерографии.
Образцы крови для последующего определения уровней N-концевого фрагмента натрийуретического пептида (NT-proBNP), цистатина С (ЦисС) отбирали непосредственно после верификации диагноза, центрифугировали, а затем замораживали и хранили при -70°С, пока не были выполнены анализы. Содержание измеряли с помощью техники ELISA (иммуноферментный анализ) с использованием наборов фирмы «Biomedica Slovakia sro» (Братислава, Словакия), «BioVendor» (Брно, Чехия) в Учебном медико-лабораторном центре Запорожского государственного медицинского университета (начальник – профессор А.В. Абрамов). Калибровка выполнена в соответствии с заводскими рекомендациями и нормализована по стандартной кривой.
В качестве твердых клинических конечных точек учитывались все фатальные и нефатальные атеротромботические события, включая повторный ИМ и внезапную сердечную смерть, все случаи СН и госпитализации в связи с этой причиной, зарегистрированные в течение 3 лет после подписания информированного согласия.
Статистическая обработка проводилась с помощью пакета статистических программ «Statistica 6.0» (пакет StatSoft Inc, США, № лицензии AXXR712D833214FAN5). Все данные представлены в виде среднего значения (М), стандартного отклонения (±SD), медианы (Ме), межквартильного интервала (НКИ). Гипотезу о нормальности распределения исследуемых показателей проверяли с использованием критерия Шапиро – Уилки. Для сравнения статистических характеристик в различных группах использовали множественное сравнение по однофакторному дисперсионному анализу Крускала – Уоллиса (Kruskal – Wallis ANOVA), с попарным сопоставлением по критерию Манна – Уитни (Mann – Whitney U Test). Для анализа таблиц сопряженности 2?2 при сравнении категоризированных переменных применяли двусторонний точный критерий Фишера или Chi2 тест. Проведение ROC-анализа позволило выявить маркеры, которые имеют достоверное прогностическое значение в отношении конечной точки, установить оптимальную точку распределения (cut-off point) на ROC-кривой, площадь под кривой (AUC), чувствительность и специфичность. Прогностическую значимость показателей относительно возникновения конечной точки оценивали по относительному риску (ОР) с 95% доверительным интервалом (ДИ). Для определения независимых предикторов использовали пошаговый многофакторный регрессионный анализ пропорциональных рисков Кокса. Для оценки функции выживания использовали метод множественных оценок Каплана – Мейера. Для сравнения выживаемости в группах использовался Log-rank-тест. Различия считали достоверными при значениях p<0,05.
Результаты исследования
Анализ результатов наблюдения показал, что неблагоприятные ССС в течение периода наблюдения возникли у 54 (22,2 %) пациентов, среди которых внезапная сердечная смерть – у 7 (2,8 %), повторный фатальный ИМ – у 5 (2,1 %), возникла необходимость в госпитализации в связи с декомпенсацией сердечной недостаточности у 32 (13,2 %), нефатальный повторний ИМ – у 5 (2,1 %), нефатальный инсульт – у 5 (2,1 %).
Группа пациентов, достигшая кумулятивной конечной точки, была достоверно старше по возрасту, чаще имели перенесенный ИМ и ФП в анамнезе, больше пациентов с ФК по NYHA III–IV, более высокий балл по шкале Борга. Объективно отмечается более низкое среднее диастолическое артериальное давление (ДАД) и высокая частота сердечных сокращений (ЧСС). Данные лабораторных исследований свидетельствуют о более высоком уровне креатинина, NTproBNP, цистатина С, чаще присутствует макроальбуминурия и ниже – расчетная СКФ. Анализ структурно-функциональных показателей выявил в группе ССС достоверно более высокие линейные и объемные показатели левого предсердия и левого желудочка, ИММЛЖ, ДЛАсист., степени МР и ниже ФВ. По базисной терапии группы не отличались.
Во время ROC-анализа (табл. 2) установлено, что риск развития ССС достоверно возрастает при превышении оптимальной точки распределения для возраста, ДАД, ЧСС, шкалы Борга, креатинина, СКФ, NTproBNP, цистатина С, ИОЛП, КДР, ТЗСЛЖ, КДО, ФВ, ИММЛЖ, МР, ДЛА.
Таблица 2. Результаты ROC-анализа у пациентов с ХСН ишемического генеза с сохраненной ФВ ЛЖ
|
Показатель, единица измерения
|
Точка распределения (cut-off)
|
Площадь под кривой (AUC)
|
95% ДИ
|
Чувствительность, %
|
Специфичность, %
|
р
|
|
СКФ, мл/мин/1,73м2
|
≤71,25
|
0,670
|
0,607–0,729
|
66,67
|
70,90
|
0,0001
|
|
ИОЛП, см3/м2
|
>12,96
|
0,699
|
0,564–0,763
|
52,0
|
84,06
|
0,01
|
|
Возраст, лет
|
>61
|
0,677
|
0,615–0,736
|
61,11
|
67,72
|
0,0001
|
|
Шкала Борга, баллы
|
>4
|
0,733
|
0,672–0,787
|
68,52
|
70,21
|
<0,0001
|
|
ДАД, мм рт.ст.
|
<85
|
0,593
|
0,529–0,656
|
68,52
|
51,6
|
0,02
|
|
ЧСС, уд./мин
|
>82
|
0,593
|
0,528–0,655
|
37,04
|
84,04
|
0,06
|
|
МР, степень
|
>1
|
0,617
|
0,553–0,679
|
38,89
|
82,89
|
0,004
|
|
NTproBNP, пг/мл
|
>79,33
|
0,902
|
0,734–0,981
|
92,86
|
73,33
|
<0,0001
|
|
Креатинин, ммоль/л
|
>95
|
0,683
|
0,620–0,741
|
57,41
|
77,78
|
0,0001
|
|
Цистатин С,
нг/мл
|
>979
|
0,766
|
0,614–0,880
|
94,44
|
57,69
|
0,0002
|
|
КДР, см
|
>5,43
|
0,653
|
0,589–0,712
|
59,26
|
71,12
|
0,0005
|
|
ТЗСЛЖ, см
|
>1,24
|
0,657
|
0,593–0,717
|
70,37
|
61,5
|
0,0002
|
|
КДО, мл
|
>153
|
0,625
|
0,558–0,688
|
33,96
|
94,19
|
0,009
|
|
ФВ, %
|
≤52,55
|
0,615
|
0,550–0,676
|
40,74
|
79,14
|
0,008
|
|
ИММЛЖ, г/м2
|
>140
|
0,703
|
0,638–0,762
|
66,04
|
67,26
|
<0,0001
|
|
ДЛАсист., мм рт.ст.
|
>30,2
|
0,647
|
0,547–0,739
|
50,0
|
84,72
|
0,02
|
Для определения зависимых и независимых прогностических факторов развития ССС был проведен унивариантный и мультивариантный регрессионный анализ пропорциональных рисков Кокса. В унивариантный анализ включали показатели, которые отобрали при помощи ROC-анализа (см. табл. 2).
В результате унивариантного анализа установлены зависимые факторы риска (табл. 3), имеющих достоверное (р<0,05) прогностическое значение для развития ССС в трехлетний период наблюдения: СКФ (ОР 3,99, 95% ДИ 2,27–7,01, р<0,0001), ИОЛП (ОР 4,54, 95% ДИ 2,07–9,95, р=0,0001), возраст (ОР 2,82, 95% ДИ 1,63–4,87, р=0,0002), фибрилляция предсердий (ОР 3,98, 95% ДИ 2,26–6,99, р<0,0001), ИМ (ОР 1,94, 95% ДИ 1,01–3,76, р=0,04), ЧСС (ОР 2,56, 95% ДИ 1,48–4,44, р=0,0008), ДАД (ОР 2,04, 95% ДИ 1,15–3,62, р=0,01), шкала Борга (ОР 4,04, 95% ДИ 2,28–7,16, р<0,0001) ФВ (ОР 2,11, 95% ДИ 1,22–3,65, р=0,007), креатинин (ОР 3,74, 95% ДИ 2,15–6,40, р<0,0001), гематокрит (ОР 2,3, 95% ДИ 1,33–3,98, р=0,003), макроальбуминурия (ОР 2,6, 95% ДИ 1,43–4,73, р=0,001), NTproBNP (ОР 14,3, 95% ДИ 1,87–109,6, р=0,01), цистатин С (ОР 13,5, 95% ДИ 1,81–100,8, р=0,01), ФВ (ОР 2,11, 95% ДИ 1,23–3,67, р=0,007), КДР (ОР 2,92, 95% ДИ 1,70–5,02, р=0,0001), ИММЛЖ (ОР 3,25, 95% ДИ 1,84–5,73, р<0,0001), КДО (ОР 5,42, 95% ДИ 3,06–9,62, р<0,0001), МР (ОР 2,58, 95% ДИ 1,5–4,46, р=0,0006), ДЛА (ОР 3,64, 95% ДИ 1,78–7,46, р=0,0004).
Таблица 3. Прогностическое значение анамнестических, клинических, гемодинамических и биологических факторов у пациентов с ХСН ишемического генеза с сохраненной ФВ ЛЖ. Результаты унивариантного и мультивариантного анализа
|
Предиктор
|
Унивариантный анализ
|
Мультивариантный анализ
|
|
ОР
|
95% ДИ
|
р
|
ОР
|
95% ДИ
|
р
|
|
ИОЛП, см3/м2
|
4,54
|
2,07–9,95
|
0,0001
|
9,69
|
2,50–37,5
|
0,001
|
|
СКФ, мл/мин/1,73м2
|
3,99
|
2,27–7,01
|
<0,0001
|
6,91
|
1,73–27,5
|
0,006
|
|
Возраст, лет
|
2,82
|
1,63–4,87
|
0,0002
|
–
|
–
|
–
|
|
Фибрилляция предсердий
|
3,98
|
2,26–6,99
|
<0,0001
|
–
|
–
|
–
|
|
Инфаркт миокарда
|
1,94
|
1,01–3,76
|
0,04
|
–
|
–
|
–
|
|
ЧСС, уд./мин
|
2,56
|
1,48–4,44
|
0,0008
|
–
|
–
|
–
|
|
ДАД, мм рт.с.т
|
2,04
|
1,15–3,62
|
0,01
|
–
|
–
|
–
|
|
Шкала Борга, баллы
|
4,04
|
2,28–7,16
|
<0,0001
|
–
|
–
|
–
|
|
Креатинин, ммоль/л
|
3,74
|
2,15–6,40
|
<0,0001
|
–
|
–
|
–
|
|
Гематокрит, %
|
2,3
|
1,33–3,98
|
0,003
|
–
|
–
|
–
|
|
Макроальбуминурия
|
2,6
|
1,43–4,73
|
0,001
|
–
|
–
|
–
|
|
NTproBNP, пг/мл
|
14,3
|
1,87–109,6
|
0,01
|
–
|
–
|
–
|
|
Цистатин С, нг/мл
|
13,5
|
1,81–100,8
|
0,01
|
–
|
–
|
–
|
|
ФВ, %
|
2,11
|
1,23–3,67
|
0,007
|
–
|
–
|
–
|
|
КДР, см
|
2,92
|
1,70–5,02
|
0,0001
|
–
|
–
|
–
|
|
ИММЛЖ, г/м2
|
3,25
|
1,84–5,73
|
<0,0001
|
–
|
–
|
–
|
|
КДО, мл
|
5,42
|
3,06–9,62
|
<0,0001
|
–
|
–
|
–
|
|
МР, степень
|
2,58
|
1,5–4,46
|
0,0006
|
–
|
–
|
–
|
|
ДЛАсист., мм рт.ст
|
3,64
|
1,78–7,46
|
0,0004
|
–
|
–
|
–
|
С целью определения независимых предикторов развития ССС с помощью пошагового мультивариантного регрес-сионного анализа пропорциональных рисков Кокса установлено, что при превышении оптимальной точки распределения для ИОЛП >12,96 см3/м2 риск развития кумулятивной конечной точки у больных ХСН-СФВ ишемического генеза достоверно увеличивается в 9,69 раза (95% ДИ 2,50–37,5; р=0,001), а при наличии более низких, чем оптимальная точка распределения, значений СКФ ≤71,25 мл/мин/1,73м2 – риск увеличивается в 6,91 раз (95 % ДИ 1,73–27,5; р=0,006).
С целью оценки кумулятивного выживания в когорте пациентов с ХСН-СФВ ишемического генеза выполнен анализ методом Каплан – Майера с построением кривых, который продемонстрировал достоверное уменьшение времени до наступления события при ИОЛП >12,96 см3/м2 и СКФ ≤71,25 мл/мин/1,73м2 (рис. 1, 2).
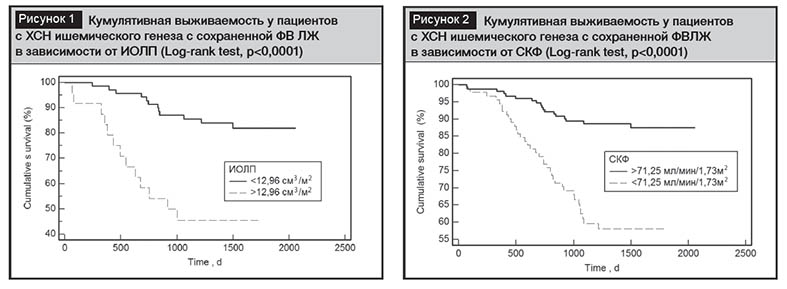
Обсуждение
В результате анализа трехлетнего наблюдения за 243 больными ХСН-СФВ ишемического генеза нами выявлены такие зависимые предикторы развития ССС, как возраст, ФП, ИМ, ЧСС, ДАД, индекс одышки по шкале Борга, СКФ, креатинин, гематокрит, макроальбуминурия, NTproBNP, цистатин С, ИОЛП, ФВ, КДР, ИММЛЖ, КДО, МР, ДЛА.
Известно, что риск сердечно-сосудистых заболеваний увеличивается при наличии хронической болезни печени (ХБП) [14]. Традиционные факторы риска, такие как гипертония, курение, диабет и дислипидемия, являются общими для обоих заболеваний [3]. Хотя оценка риска по Фрамингемской шкале является мощным инструментом для прогноза ССС [15], некоторые исследования показали [5, 7], что данная модель недооценивает исходы, обеспечивает низкую предсказательную точность в популяции пациентов с ХБП и существует необходимость в рассмотрении других факторов неблагоприятных ССС в этой группе высокого риска.
Традиционные маркеры функции почек имеют серьезные недостатки. Это побудило к исследованию новых биомаркеров с целью обнаружения почечной дисфункции на более ранних стадиях [9]. Связь между цистатином С и исходами была продемонстрирована у пациентов с острой сердечной недостаточностью в исследовании Acute Study of Clinical Effectiveness of Nesiritide in Biomarkers of renal injury and function Decompensated HF (ASCEND-HF) [10]. В нашем исследовании цистатин С при превышении точки распределения 979 нг/мл в 13,5 раза увеличивал риск возникновения ССС, что согласуется с данными других авторов [4]. Однако при включении в многофакторный анализ цистатин С утрачивал свое прогностическое значение, что можно объяснить недостаточно большой выборкой пациентов.
Наши результаты согласуются с предыдущими исследованиями, показывающими, что ХБП ассоциируется с неблагоприятным прогнозом у пациентов с ХСН-СФВ [14]. Мы дополнили предыдущие исследования данными, что при уровне СКФ ≤71,25 мл/мин/1,73м2 увеличивается риск развития комбинированной конечной точки в 3,9 раза.
ИОЛП ранее зарекомендовал себя как маркер тяжести и прогрессирования диастолической дисфункции [13]. Количественная оценка ИОЛП может быть особенно актуальной у пациентов с ХБП. Мы изучили предикторы неблагоприятных ССС при ХСН-СФВ ишемического генеза и показали, что СКФ и увеличение ИОЛП были независимыми прогностическими факторами. Хотя эти результаты и не могут быть экстраполированы на все подгруппы пациентов с ХБП, ранее мы установили обратно пропорциональное увеличение ИОЛП к СКФ [8].
В нашем исследование пациенты с ИОЛП >12,96 см3/м2 и СКФ ≤71,25 мл/мин/1,73м2 имели значительно более низкую выживаемость без событий, чем пациенты с ИОЛП <12,96 см3/м2 и СКФ >71,25 мл/мин/1,73м2 (Log-rank тест, p<0,0001). Результаты нашего исследования свидетельствуют о том, что ИОЛП и СКФ являются важными маркерами для стратификации риска и могут обеспечить дополнительное прогностическое значение для клинических факторов риска у пациентов с ХСН-СФВ ишемического генеза с почечной дисфункцией. Кроме того, это может указывать на потенциальную роль почечной дисфункции в развитии осложнений ХСН-СФВ.
Заключение
Независимыми предикторами развития неблагоприятных ССС у больных ХСН ишемического генеза с сохраненной ФВ ЛЖ и почечной дисфункцией в течение 3 лет наблюдения являются: ИОЛП >12,96 см3/м2 и СКФ ≤71,25 мл/мин/1,73м2.
Наше исследование имеет ряд ограничений – это одноцентровое исследование с относительно небольшим размером выборки и небольшим количеством событий. Необходимо проведение большого проспективного исследования для подтверждения наших выводов.
Л И Т Е Р А Т У Р А
1. Воронков Л.Г. // Сердечная недостаточность. – 2012. – №1. – С.8–14.
2. Воронков Л.Г., Амосова К.М., Багрій А.Е. та ін. // Серцева недостатність. – 2012. – №3. – C.60–96.
3. Brandimarte F., Vaduganathan M., Mureddu G.F., et al. // Heart Failure Reviews. – 2013. – Vol.18, N2. – P.167–176.
4. Carrasco-Sanchez F.J., Galisteo-Almeda L., Paez-Rubio I. // J. Card. Fail. – 2011. – N17. – P.31–38.
5. Ducloux D., Kazory A., Chalopin J.M. // Kidney Int. – 2004. – Vol.66. – P.441–447.
6. Kaplon-Cieslicka A., Tyminska A., Peller M., et al. // Am. J. Cardiol. – 2016. – Vol.118, N4. – Р.535–542.
7. Kasiske B., Israni A. // Transplantation Reviews. – 2006. – Vol.20, N1. – P.19–27.
8. Lashkul D. // Eur. J. Heart Failure Supplement. – 2014. – Vol.16 (Suppl. 1). – P.28.
9. Metra M., Cotter G., Gheorghiade M., et al. // Eur. Heart J. – 2012. – Vol.33, N17. – P.2135–2142.
10. Tang W.H., Dupont M., Hernandez A.F., et al. // JACC Heart Fail. – 2015. – N3. – P.40–49.
11. The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis // Eur Heart J. — 2011. – Vol.33, N14. – P.1750–1757
12. Tokmakova M.P., Skali H., Kenchaiah S., et al. // Circulation. – 2004. – Vol.110. – P.3667–3673
13. Tsang T.S., Barnes M.E., Gersh B.J., et al. // Am. J. Cardiol. – 2002. – Vol.90. – P.1284–1289.
14. Unger E., Dubin R., Deo R., et al. // Eur. J. Heart Fail. – 2015. – Vol.18, N1. – P.103–112.
15. Weiner D.E., Tighiouart H., Elsayed E.F., et al. // Am. Coll. Cardiol. – 2007. – 50. – P.217–224.
Медицинские новости. – 2016. – №10. – С. 82-86.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|