Tadzhihanova D.P.
Republican Specialized Scientific and Practical Medical Center of Pediatric, Uzbekistan
Differentiated therapy of Mycoplasma pneumonia
in children with mixed infection
Резюме. Этапное применение предложенных схем лечения с использованием глицирона и анаферона при микоплазменной пневмонии, ассоциированной с герпесвирусной инфекцией, имеет неоспоримые преимущества, так как оказывает положительное влияние на клиническое течение заболевания, способствует улучшению показателей иммунитета, позволяет достигнуть длительной ремиссии и уменьшить частоту повторных заболеваний бронхолегочной системы.
Ключевые слова: микоплазменная пневмония, герпесвирусная инфекция.
Медицинские новости. – 2016. – №7. – С. 71–73.
Summary. Staged application of the proposed treatment regimens using glitsiron and anaferon with mycoplasma pneumonia of associated with herpesvirus infection has advantages, as has a positive effect on the clinical course of the disease, improves immunity parameters, can achieve long-term remission and reduce the frequency of recurrent diseases of bronchopulmonary system.
Keywords: mycoplasma pneumonia, herpesvirus infection.
Meditsinskie novosti. – 2016. – N7. – P. 71–73.
Среди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, в старшей возрастной группе достигает 25–44% [1, 9].
Наиболее распространенной причиной развития внебольничных пневмоний является Streptococcus pneumoniae (30–50%) [4, 6]. Однако в последние годы все большее значение придается так называемым атипичным микроорганизмам, прежде всего Mycoplasma pneumoniae и Chlamydophila (Chlamidia) pneumoniae, на долю которых приходится от 8 до 25% случаев заболевания [2].
Mycoplasma pneumoniae в структуре внебольничных пневмоний варьирует в пределах 5–50% [3]. Наиболее часто микоплазменная пневмония (МП) диагностируется у детей старше 5 лет и лиц молодого возраста (до 25 лет) [4, 8].
Mycoplasma pneumoniae мимикрирует под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя, вызывает образование аутоантител и развитие аутоиммунных процессов [6, 9]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae.
Серьезной проблемой в процессе диагностики и терапии МП считается наличие микст-инфекций, когда на организм воздействуют два или более возбудителя вирусной, бактериальной или иной этиологии [5]. Длительная персистенция вирусов приводит к вторичному иммунодефициту, который обусловливает активацию вирусов и частые рецидивы заболевания [4].
Разработка новых методов лечения с учетом подбора наиболее эффективных комплексов антибактериальных, противовирусных препаратов в сочетании с иммуномодуляторами приобретает особую значимость. с точки зрения современных позиций целевое назначение противовирусных препаратов заключается как в купировании острых симптомов заболевания, так и в возможности контроля над рецидивами, уменьшении их частоты и тяжести, что, в конечном счете, приводит к улучшению исхода заболевания [7].
Становится бесспорной актуальность изучения МП, особенно смешанных форм, обусловленных широко распространенными патогенами, в частности, герпесвирусной инфекцией (ГВИ).
Цель исследования – оценить эффективность схемы противовирусной и иммунокорригирующей терапии детей в лечении МП, ассоциированной с ГВИ.
Материалы и методы
В основу исследования положены данные углубленного клинического обследования 120 детей в возрасте от 1 года до 3 лет, из которых 35 – с МП, 85 – с МП, ассоциированной с ГВИ.
Пневмонию диагностировали на основании жалоб, данных анамнеза, с учетом результатов клинических, рентгенологических, лабораторных, микробиологических и иммунологических исследований. В зависимости от проводимой терапии дети были разделены на 2 группы: I группа – 20 больных МП, ассоциированной с ГВИ, получавших общепринятую традиционную базисную терапию (макролиды, противокашлевые, противовирусные, антигистаминные препараты, симптоматическое лечение и физиопроцедуры); II группа – 69 больных МП, ассоциированной с ГВИ, получавших на фоне базисной терапии глицирон (по 1/2 таблетке 3 раза в день в течение 1 месяца). У пациентов II группы в 46,7% случаев не наблюдалось полного восстановления измененных параметров иммунной системы, поэтому после глицирона в течение 3 месяцев детям давали анаферон детский (по 1 таблетке 1 раз в день за 1 час до еды).
Полученные результаты обрабатывали с помощью программ Excel и Statistica 6. Статистически значимыми считали различия при Р<0,05.
Результаты и обсуждение
Сравнительный анализ результатов показал преимущество комплексного лечения, включающего глицирон на фоне традиционной терапии. У больных II группы уменьшались проявления дыхательной недостаточности, кашель становился мягче, количество мокроты сокращалось, физикальные данные также имели более выраженную положительную динамику. Ко 2–3-му дню у преобладающего большинства больных (80,0%) симптомы интоксикации не определялись. На фоне традиционной терапии на 3-й день эти признаки исчезали лишь у 10,0%, на 5-й – у 40%, на 7-й – у 55,0% пациентов. Кроме того, нормализация температуры тела происходила в 2 раза быстрее (в среднем на 2,8±0,2 дня, Р<0,001), чем у больных I группы (5,7±0,4 дня).
Положительная рентгенологическая динамика к 12-му дню лечения наблюдалась у 86,7% пациентов, получавших комплексное лечение с включением глицирона, и лишь у 30,0% больных на фоне традиционной терапии. После проведенного лечения выявили ряд показателей, свидетельствующих о положительном воздействии глицирона на изученные параметры иммунитета. Более выраженные изменения наблюдались во II группе (P<0,001). Уровень CD95+-лимфоцитов в результате комплексного лечения достоверно снизился в 1,6 раза (P<0,01), в I группе – в 1,2 раза. Анализ относительных показателей клеточного иммунитета у детей с МП, ассоциированной с ГВИ, в динамике лечения выявили несколько иную картину. У пациентов I группы наблюдалась только тенденция к повышению уровня Т-лимфоцитов и Т-хелперов по сравнению с показателями до лечения (P<0,05). В то время как сочетанное лечение с включением глицирона способствовало достоверному повышению уровня CD3+-, CD4+-лимфоцитов по сравнению с показателями до лечения (P<0,01, P<0,001).Уровень CD8+-лимфоцитов под воздействием традиционного лечения изменениям не подвергался, а у детей, получавших комплексное лечение с включением глицирона, наблюдалась тенденция к снижению супрессорной активности. Отмечалось снижение числа CD95+-клеток и повышение CD25+-лимфоцитов по сравнению с показателями в I группе (P<0,01).
Анализ данных неспецифических факторов защиты показал изменения в результате проведенных терапевтических мероприятий (рисунок).
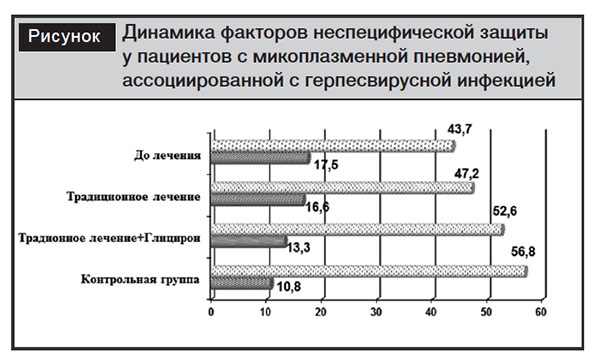
Так, относительный уровень CD16+-клеток, достоверно повышенный до лечения, снизился у детей II группы (P<0,01), в I группе наблюдалась только тенденция к снижению (P>0,05). Абсолютные значения CD16+-клеток достоверно снизились в I и II группах (0,6±0,04?109/л и 0,4±0,03?109/л соответственно) (P<0,05, P<0,01). Изучение ФАН показало, что после традиционной терапии у детей, больных МП, ассоции-рованной с ГВИ, наблюдалось некоторое повышение фагоцитоза с 43,7?0,5% (до лечения) до 47,2?1,0%. При подключении глицирона фагоцитарная активность повысилась до 52,6?1,2% (P<0,01).
Положительная динамика наблюдалась в отношении содержания В-лимфоцитов: в результате комплексного лечения с включением глицирона показатель достоверно снизился в 1,6 раза по сравнению с таковым до лечения (P<0,001). Включение глицирона способствовало достоверному повышению уровня IgG и IgА по сравнению с показателями I группы (P<0,05), концентрация IgМ была достоверно снижена по сравнению с таковой в I группе (P<0,05).
При анализе показателей цитокинового профиля во II группе наблюдалась следующая динамика: уровень I L -1? после лечения снизился в 1,6 раза (Р<0,001), IL -4 – в 1,9 раза (Р<0,001), IL -8 – в 1,4 раза (Р<0,01) по сравнению с показателями до лечения, в то время как в I группе эти показатели не имели достоверной разницы (Р>0,05). Содержание IFN-? в сыворотке крови повышалось как при традиционном лечении (Р<0,05), так и во II группе (Р<0,01), достигая показателя среднего значения нормы. В I группе уровень TNF?-??снизился в 1,2 раза по сравнению с показателем до лечения (Р<0,05), при подключении глицирона – в 1,5 раза (Р<0,01).
Проведенные нами исследования показали, что включение в традиционное лечение глицирона у детей с МП, ассоциированной с ГВИ, способствует восстановлению многих параметров клеточного и гуморального иммунитета, а также цитокинового статуса. Однако восстановления всех изученных параметров иммунного статуса до контрольных значений не наблюдалось.
С целью детального изучения полученных данных мы проанализировали результаты исследования с учетом частоты отклонения индивидуальных показателей от диапазона контрольных значений (М±1,5?), что позволило выявить группу детей, у которых клиническое состояние соответствовало состоянию иммунной системы. Изучение частоты отклонения показателей от данных контрольной группы показало, что у большей части обследованных детей восстановление не произошло.
Таким образом, включение в традиционную терапию глицирона при МП, ассоциированной с ГВИ, у детей раннего возраста оказывает положительное влияние на клиническое течение заболевания и приводит к улучшению иммунологических показателей. Только лишь у 46,7% пролеченных детей не наблюдалось полное восстановление параметров иммунной системы. Для восстановления измененных параметров иммунной системы 31 ребенку после глицирона в течение 3 месяцев давали анаферон детский.
Анализ полученных данных показал, что после традиционной терапии у детей в течение года продолжали наблюдаться повторные случаи ОРИ и их осложнения (назофарингит, тонзиллит, рецидивирующий бронхит и пневмония). При сочетанном применении глицирона и анаферона частота повторных ОРИ и их осложнения значительно снизились (47,6% случаев по сравнению с показателями в I и II группах больных).При использовании глицирона и анаферона в 2,4 раза сократилась продолжительность заболеваний по сравнению с таковой у детей, получавших традиционную терапию (1,5 раза), что свидетельствует о высокой терапевтической эффективности сочетанного применения препаратов.
При изучении динамики данных ИФА выявлено существенное снижение титра антител IgG к микробной ассоциации к Mycoplasma в 3,9 раза, Herpes simplex в 4,2 раза, Cytomigalovirus в 4,4 раза по сравнению с показателями до лечения.
Динамика иммунологических показателей у детей, получавших глицирон и анаферон в комплексной традиционной терапии МП с ГВИ, показал, что содержание CD3+-, CD4+-лимфоцитов, ФАНбыло достоверно повышено, уровень CD8+-, CD16+-, CD20+-лимфоцитовбыло достоверно снижено по сравнению с показателями в I и II группах больных. Изучение динамики уровня лимфоцитов с маркерами активации показало достоверное снижение числа CD95+- и CD25+-лимфоцитов по сравнению с показателями в I и II группах. При изучении динамики уровня цитокинов у больных МП с ГВИ, получавших глицирон и анаферон, наблюдалось снижение уровня IL -4, IL -1?, IL -8, TNF -? и повышение содержания IFN -? по сравнению с показателями в I и II группах.
Результаты исследования показали, что комплексная терапия с включением глицирона и анаферона оказалась наиболее эффективной. Оценка катамнестических наблюдений за детьми в течение года показала уменьшение частоты повторных заболеваний бронхолегочной системы, характеризующие эффективность лечения.
Заключение
Предложенные схемы лечения с использованием глицирона и анаферона в комплексе традиционной терапии Mycoplasma pneumoniae, ассоциированной с ГВИ, у детей раннего возраста имеет неоспоримые преимущества: оказывает положительное влияние на клиническое течение заболевания, способствует улучшению показателей иммунитета, что позволяет достичь длительной ремиссии с уменьшением частоты рецидивов заболевания.
Л И Т Е Р А Т У Р А
1. Козлов Р.С. // Болезни и антибиотики. – 2010. – №1. – С.19–23.
2. Меньщикова Л.В., Совалкин В.И. // Русский медицинский журнал. – 2006. – Т.14, №22. – С.603–607.
3. Самсыгина Г.А. Пневмония // Рациональная фармакотерапия детских болезней / Под ред. А.А. Баранова, Н.Н. Володина, Г.А. Самсыгиной. – М., 2007. – С.451–471.
4. Спичак Т.В., Ким С.С., Катосова Л.К. // Вопросы диагностики в педиатрии. – 2010. – Т.2, №6. – С.31–34.
5. Султанова З.О., Ахмедова Д.И. Влияние цитомегаловирусной и герпетической инфекции на развитие геморрагического синдрома у новорожденных // Республиканская научно-практическая конференция «Педиатрия Узбекистана: реформирование и стратегия развития». – Ташкент, 2007. – С. 241.
6. Таточенко В.К. Внебольничные пневмонии // Антибиотико-химиотерапия инфекций у детей. – М., 2008. – С.41–44.
7. Шамсиев Ф.М., Хайдарова М.М., Мусажанова Р.А. и др. Современный подход к лечению часто болеющих детей с острой пневмонией: Методические рекомендации. – Ташкент, 2010. – 25 с.
8. Bulletin of the World Health Organizathion. – 2008. – Vol.86, №5. – Р.408–416.
9. Marimon J.M. Vaccines for Streptococcus pneumonia // Materials of the 5th ESCMID School, Santander. – Spain, 2006.
Медицинские новости. – 2016. – №7. – С. 71-73.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.