Инсульт представляет собой важную медико-социальную проблему, поскольку является частой причиной инвалидизации больных, обусловленной в большинстве случаев двигательными нарушениями [6, 14, 52]. В частности, гемипарез обнаруживается в 80–90 % случаев острых нарушений мозгового кровообращения [6]. При этом лишь около 30 % больных могут самостоятельно передвигаться в первые недели после перенесенного инсульта [36, 40]. В России насчитывается свыше 1 млн человек, перенесших инсульт [14]. У мужчин частота инсульта примерно на 20 % выше, чем у женщин. Почти 3/4 пациентов с инсультом в анамнезе — лица в возрасте 65 лет и старше [6].
Постинсультные когнитивные расстройства
С увеличением возраста больные хуже реагируют на лечение, у них медленнее протекает восстановление повседневной активности [38]. Особого внимания заслуживает постинсультная деменция, клинические особенности которой определяются локализацией очага (очагов). В значительной степени страдают такие когнитивные сферы, как речь и ориентировка, меньше — внимание и зрительно-пространственные функции [28]. Примерно у 2/3 больных имеются дисфазические расстройства различной степени выраженности, что основательно затрудняет оценку их когнитивного состояния [21]. При этом степень когнитивного дефекта не всегда соответствует выраженности иной очаговой неврологической симптоматики [21].
Помимо когнитивных нарушений для таких пациентов характерно наличие гемипареза (70 %), нарушений ходьбы (80 %) и недержания мочи (1/3 пациентов). Следует отметить, что при инсульте вследствие поражения крупных сосудов или по кардиальной причине церебральной ишемии когнитивные нарушения нередко остаются «в тени» клинически более яркого очагового (чаще двигательного) неврологического дефекта. У пациентов с кортикальными инфарктами отмечаются афазия, апраксия, зрительно-пространственные расстройства, у больных с субкортикальными очагами – психомоторные нарушения, расстройства внимания, инертность. Кроме того, при субкортикальной деменции в неврологическом статусе часто имеют место двигательные расстройства, замедленность и пошатывание при ходьбе, согбенная поза, гипомимия, псевдобульбарные расстройства (насильственный плач, смех). Значительная часть этих нарушений при кортикальной деменции отсутствует. Нередки случаи комбинации кортикальных и субкортикальных расстройств.
Для инфарктов в стратегических зонах характерно доминирование в неврологическом статусе когнитивных и поведенческих расстройств; двигательная симптоматика, как правило, минимальная и быстро регрессирует. При локализации инсульта в области угловой извилины симптоматика (аграфия, акалькулия, пальцевая агнозия и др.) напоминает таковую при болезни Альцгеймера.
Постуральные нарушения при дисциркуляторной энцефалопатии. Постинсультные двигательные расстройства
Инсульт, как правило, развивается на фоне хронической цереброваскулярной недостаточности (по отечественной классификации — дисциркуляторной энцефалопатии (ДЭ)). Дисциркуляторная энцефалопатия, протекающая на фоне артериальной гипертензии, атеросклероза или их сочетания, является одной из основных причин нарушения двигательных и когнитивных функций [3, 4, 7, 9, 18]. Прогрессирование ДЭ сопровождается нарастанием постуральных расстройств, которые наряду с когнитивными нарушениями приводят к инвалидизации больных [2–4, 7, 18]. На начальных стадиях ДЭ отмечается компенсаторное изменение параметров ходьбы и увеличение произвольного внимания, а негрубые двигательные ошибки связаны с недостаточностью программного контроля. По мере прогрессирования заболевания возникает структурный распад (дезинтеграция) функциональной стато-локомоторной системы в результате грубых нарушений программного контроля, что проявляется расстройствами проактивного динамического контроля (праксиса позы) и нарушениями локомоции. Последняя реализуется в виде расстройства одной из базовых характеристик центрального генератора шага–ритма локомоции. Клинически это проявляется нарушениями инициации ходьбы («запуск» программы локомоции), застываниями во время ходьбы (фрагментарность исполнения программы) и патологической асимметрией шага.
Нередко указанные нарушения обозначают обобщающим термином «апраксия ходьбы», под которой понимается «…нарушение способности правильно использовать нижние конечности в акте ходьбы, которое не может быть объяснено сенсорными расстройствами или парезом» [33]. Однако при апраксии ходьбы двигательный дефект носит более диффузный характер и не ограничивается только нижними конечностями.
В рамках апраксии ходьбы выраженность отдельных симптомов весьма вариабельна и в значительной мере индивидуальна. В генезе этого синдрома (или синдромов с учетом гетерогенного характера патогенетических механизмов, лежащих в основе клинических проявлений) ведущую роль играют дисфункция лобных долей и нарушение фронтально-субкортикальных связей. Связи лобных долей с субталамическим локомоторным центром, мезэнцефальным локомоторным центром, базальными ганглиями и мозжечком (через ядра вентролатеральных отделов таламуса, ядра моста, оливы) обеспечивают целенаправленное начало движения и его изменение, а также способность приспосабливать движения к меняющимся внешним условиям (изменение двигательных программ). Кроме того, через связи с мозжечком лобные доли способны влиять на координацию и ритмичность движений.
Клинико-анатомические исследования свидетельствуют об определенной синдромальной обособленности апраксии ходьбы, в основе которой лежит двустороннее поражение дополнительной моторной коры в зоне васкуляризации передних мозговых артерий [22].
Апраксия ходьбы часто возникает у больных с субкортикальным типом сосудистой деменции, развитие которого связано с гемодинамическими расстройствами, в большинстве случаев обусловленными артериальной гипертензией, повреждениями сосудистой стенки и нарушением гематоэнцефалического барьера. У пожилых лиц к факторам риска данного типа сосудистой деменции помимо артериальной гипертензии относят метаболические нарушения — ожирение, сахарный диабет и гиперхолестеринемию, а также курение и низкий уровень образования.
Острое нарушение мозгового кровообращения еще в большей степени способствует усилению двигательного дефекта у больных ДЭ, что лежит в основе ограничения повседневной активности и дезадаптации пациентов. Внезапно возникший вследствие инсульта гемипарез приводит к нарушениям ходьбы, которые часто тяжело переносятся больными. Причины этого вполне очевидны — зависимость от помощи окружающих при попытке выполнения даже минимальных действий, связанных с ходьбой. Неустойчивость вертикального положения тела может спровоцировать падение больного, в дальнейшем появляется страх перед самостоятельной ходьбой. При этом у пациентов, перенесших инсульт, высок риск возникновения переломов при падении [6, 27], что связано с наличием остеопороза [16, 23, 42, 43] и дефицитом витамина D [44, 45]. Переломы чаще возникают в течение первого года после инсульта и у большинства больных локализованы на стороне гемипареза.
Риск падений возрастает в 3—8 раз у пациентов с парезами нижних конечностей, в 4–5 раз — с нарушениями равновесия и в 2–3 раза – с нарушениями ходьбы различного генеза. При инсультах (наиболее частой причине двигательных – пирамидных, атактических — расстройств у пожилых) в остром периоде падения отмечаются у 14 % больных, в периоде реабилитации — у 39 %, в течение 6 месяцев после выписки из стационара — у 73 % [47]. Наличие деменции увеличивает риск падений в 2 раза [51].
Вероятность падений возрастает с увеличением количества факторов риска (нарушения равновесия, гемипарез и др.): у лиц без факторов риска падения встречаются в 8 % случаев, у имеющих 4 фактора риска и более — в 78 % [49]. К сожалению, у большинства пожилых больных имеется несколько предрасполагающих к падениям факторов, в комплексе усиливающих неблагоприятное влияние каждого из них. Следует подчеркнуть, что риск падений существенно возрастает при остром развитии или обострении хронически протекающих соматических и неврологических заболеваний.
Пациенты, перенесшие инсульт, часто не могут вернуться к прежней повседневной двигательной активности, либо для восстановления им требуется значительное количество времени и помощь окружающих [39]. Все это может привести к заметному снижению качества жизни [15, 26].
Наиболее частым симптомом полушарного инсульта является гемипарез [20], однако у значительной части больных имеется сложный двигательный дефект [37]. Полиморфизм двигательных нарушений у постинсультных больных обусловлен поражением сложноорганизованных систем, ответственных за реализацию произвольных движений [17]. Перенесенный инсульт существенно нарушает систему постурального контроля [29]. При этом постуральный дефект может развиваться первично вследствие самого инфаркта либо вторично при нарушениях связей, задействованных в моторных кругах.
В настоящее время установлено, что больные с поражением париетальной коры (зрительно-пространственным дефицитом) имеют более выраженный двигательный дефект и худший прогноз для восстановления [37]. При наличии конструктивной апраксии и зрительно-пространственного дефекта восстановление идет быстрее у пациентов без поражения лобной доли [37].
К неблагоприятным в плане восстановления двигательных функций после инсульта факторам помимо его тяжести и выраженности пареза относятся пожилой возраст, наличие сопутствующих соматических заболеваний (инфаркт миокарда, сахарный диабет), когнитивные расстройства, тазовые и сенсорные нарушения, а также задержка с началом реабилитационных мероприятий [34]. Инфаркт миокарда — наиболее частая причина летального исхода у больных, перенесших инсульт или транзиторную ишемическую атаку. Однако ни тяжесть поражения головного мозга, ни пожилой возраст пациентов не являются факторами, мешающими восстановлению двигательных функций или исключающими эту возможность.
Неблагоприятным предиктором с точки зрения восстановления двигательного дефекта считается кортикальное поражение с вовлечением первичной моторной коры [19]. Данные о влиянии стороны поражения противоречивы. Р. Pantano et al. [37] отмечают, что больные с правосторонним поражением имеют худший прогноз в плане восстановления. Другие исследователи [46] предполагают, что худшее восстановление наблюдается при поражении левой гемисферы. В некоторых работах не усматривается связь между степенью восстановления и стороной поражения, хотя не исключается влияние на тяжесть двигательного дефекта поражения задних отделов теменной коры [31, 35]. Стабилографические исследования колебаний тела у больных с гемипарезом показали, что их увеличение не зависело от стороны поражения [35].
Восстановление после инсульта
Структурной составляющей восстановления после инсульта является пластичность головного мозга, приводящая к компенсации структурных и функциональных расстройств. При этом головной мозг взрослого человека сохраняет потенциал пластичности — функциональное значение тех или иных церебральных зон не является потенциально неизменяемым, а кортикальные связи могут ремоделироваться. Анатомическая основа пластичности в постинсультном периоде — реорганизация кортикальных отделов, увеличение эффективности функционирования сохранившихся структур и активное использование альтернативных нисходящих путей.
В раннем постинсультном периоде происходит реорганизация на корковом и субкортикальном уровнях (включая таламус и ствол мозга), которая заключается в изменениях баланса процессов возбуждения и торможения. Реализация этих процессов связана с глутаматергической системой, а также с другими нейротрансмиттерами: норадреналином, ацетилхолином, дофамином и серотонином. Воздействие на эти нейротрансмиттерные системы может модифицировать процессы пластичности. Выраженность развивающихся изменений в немалой степени связана с изменениями возбудимости клеточных мембран, причем как в месте повреждения, так и в прилегающих корковых и субкортикальных областях. В результате ранее находившиеся под тормозным влиянием зоны резко повышают свою активность, воздействуя на другие отделы головного мозга, а в процессах восстановления значительную роль начинают играть церебральные структуры, расположенные ипсилатерально к пораженной стороне тела.
Развивающиеся в дальнейшем структурные анатомические изменения в виде коллатерального спраутинга и формирования новых синапсов (синаптогенез) лежат в основе синаптической пластичности, реализующейся в усилении кортикальных (горизонтальных) связей. В основе восстановления утраченных двигательных функций лежит стойкая реорганизация моторной коры на стороне поражения.
Период восстановления может иметь разную продолжительность — от нескольких месяцев до нескольких лет. Проведение реабилитационных мероприятий способствует лучшему восстановлению двигательного дефекта, что обусловлено более короткими сроками, необходимыми для осуществления церебральной реорганизации. Однако в условиях отсутствия реабилитации или при ее неправильном проведении (в частности, при мероприятиях, направленных на компенсацию имеющегося двигательного дефекта и при этом снижающих участие пораженной конечности в осуществлении двигательных функций) происходит угнетение коркового представительства паретичной конечности и дальнейшее уменьшение ее использования. Следует учитывать и то, что ряд препаратов может замедлить процесс восстановления. Среди лекарственных средств, которые могут неблагоприятно повлиять на процесс восстановления, следует упомянуть некоторые антигипертензивные препараты (клонидин), нейролептики, бензодиазепиновые производные и антиконвульсанты (фенобарбитал, фенитоин) [50].
Терапевтические аспекты постинсультных постуральных и двигательных расстройств. Применение милдроната при постинсультных нарушениях
Реабилитация больных, перенесших инсульт, заключается в комбинированном и координированном применении медико-социальных мероприятий, направленных на восстановление физической, психологической и профессиональной активности. В настоящее время можно считать доказанным, что реабилитация после инсульта потенциально эффективна, причем не имеет значения ни возраст пациентов, ни наличие сопутствующих инсульту неврологических и соматических заболеваний, ни значительная выраженность постинсультного дефекта. Следует подчеркнуть, что максимально более ранняя терапия инсульта в немалой степени определяет успех проводимых в последующем реабилитационных мероприятий. Наиболее существенное восстановление возможно в первые 3 месяца от начала инсульта, после 6 месяцев, как правило, можно ожидать лишь незначительное улучшение. Однако у ряда больных процесс восстановления может продолжаться в течение более длительного периода времени [30].
Большое значение при планировании терапевтических мероприятий у пациентов с постинсультным дефектом имеет использование лекарственных препаратов, улучшающих церебральный метаболизм. Одно из таких средств — милдронат, структурный аналог γ-бутиробетаина (предшественника карнитина) [10]. Механизм действия препарата связан с улучшением метаболических процессов в клетках. При ишемии головного мозга милдронат предупреждает нарушение транспорта АТФ и активирует гликолиз, оказывает вазодилатирующее действие [5, 10, 11]. Препарат также положительно влияет на миокард: при сердечной недостаточности улучшает его сократимость, увеличивает переносимость физических нагрузок, что очень важно в связи с частым сочетанием дисциркуляторной энцефалопатии с ишемической болезнью сердца.
В проведенном нами исследовании милдронат (в дозировке 500 и 1000 мг/сут) продемонстрировал эффективность при постинсультных двигательных и когнитивных расстройствах. Оценка двигательных функций включала детальное исследование ходьбы с использованием формализованной клинической шкалы оценки двигательной активности пожилых Тинетти [48], импрегнационную методику, определение скорости ходьбы и аппаратный метод исследования устойчивости пациентов — стабилографию.
Шкала оценки двигательной активности пожилых Тинетти позволяет оценивать статическое равновесие и походку у пожилых больных при выполнении ими конкретных двигательных заданий. Степень двигательных нарушений оценивается по двум субшкалам: общей устойчивости и походки. Для оценки двигательных функций пациента просят сесть и подняться со стула, пройти по прямой линии, встать на носки и поднять руки вверх (показать, как он достает предметы с высоких полок), присесть и поднять предмет с пола. Оценивается устойчивость в толчковых пробах, выполнение поворота. В итоге выставляется общий балл, в соответствии с которым можно определить отсутствие или наличие легких, средних и значительных нарушений двигательной активности.
Импрегнационный метод применяется для определения пространственных параметров ходьбы: длины и базы шага. При этом фиксируются отпечатки стоп на бумаге шириной 1 м и длиной 10 м. Затем проводится измерение длины правого и левого шага (расстояние между одноименными точками обеих стоп в сагиттальном направлении) и базы шага (расстояние между центрами стоп во фронтальной плоскости). При статистической обработке осуществляется нормирование показателей (отношение длины шага пациента к его росту). Важным показателем оценки степени нарушения походки является скорость движения пациента. Определение скорости ходьбы производилось путем подсчета количества единичных шагов за 60 секунд при обычном для больного темпе передвижения.
В настоящее время для количественной оценки системы поддержания равновесия широко используется стабилография. Как показали проведенные в нашей клинике исследования [1, 2, 8], данная методика высокочувствительна и позволяет выявлять нарушения равновесия уже на субклинической стадии, оценивать компенсаторные возможности, а также прослеживать динамику основных показателей функционирования системы высшего уровня регуляции движений в период наблюдения за пациентами. Это важно для подбора терапии и оценки ее эффективности. Для анализа стабилограмм нами использовалась компьютерная система — программный пакет «Клинический анализ движений» МБН «Биомеханика» (программа «Стабилометрия»).
Проводилось также комплексное нейропсихологическое тестирование с использованием краткой шкалы оценки психического статуса (КШОПС, или Mini-Mental State Examination, MMSE) [24], шкалы деменции Маттиса (ШДМ, или Mattis Dementia Rating) [32], пробы Шульте и исследования когнитивного вызванного потенциала (КВП) Р300 с применением вербальной и невербальной стимуляции. Исследование КВП Р300 осуществлялось с помощью аппаратно-программного комплекса электроэнцефалографа-анализатора ЭЭГА-21/26 «Энцефалан-131-03». Пациентам предъявляли серии вербальных и невербальных зрительных стимулов, среди которых они распознавали и реагировали нажатием кнопки на целевой стимул. За Р300 принимался максимальный позитивный компонент с латентностью ≥ 300 мс.
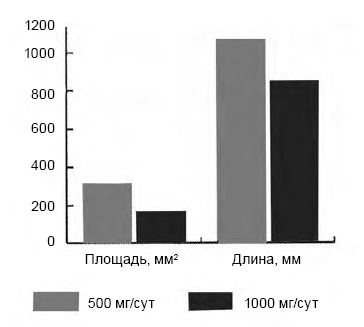
Результаты выполненного исследования свидетельствуют о положительном влиянии милдроната на двигательные и когнитивные функции больных ДЭ, перенесших ишемический инсульт. Выявлено достоверное улучшение устойчивости и походки по шкале Тинетти, у больных уменьшилась база и увеличилась частота шага уже через 1,5 месяца приема препарата (см. таблицу). Эти показатели, а также уменьшение площади статокинезиограммы продолжали достоверно улучшаться при продолжении приема препарата до 3 месяцев. Увеличение дозы милдроната с 500 до 1000 мг/сут привело к достоверному уменьшению площади и длины статокинезиограммы, что является показателем улучшения устойчивости пациентов (Р < 0,05) (рисунок).
Динамика двигательных нарушений на фоне терапии милдронатом у больных дисциркуляторной энцефалопатией с ишемическим инсультом в анамнезе
|
|
|
|
|
Шкала Тинетти, общий балл
|
|
|
|
Шкала Тинетти, субшкала устойчивости, баллы
|
|
|
|
Шкала Тинетти, субшкала походки, баллы
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Длина статокинезиограммы, мм
|
|
|
|
Площадь статокинезиограммы, мм2
|
|
|
|
Средняя амплитуда колебаний в сагиттальной плоскости, мм
|
|
|
|
Средняя амплитуда колебаний во фронтальной плоскости, мм
|
|
|
|
Частота колебаний в сагиттальной плоскости, Гц
|
|
|
|
Частота колебаний во фронтальной плоскости, Гц
|
|
|
|
*Достоверные различия (Р < 0,05) между первичным осмотром и осмотром через 45 дней терапии.** Достоверные различия (Р < 0,05) между осмотром после 45 дней и через 90 дней терапии. *** Достоверные различия (Р< 0,05) между первичным осмотром и осмотром через 90 дней терапии
При сравнении результатов нейропсихологического тестирования выявлено улучшение ориентации (оценка по КШОПС: исходно – 8,8 ± 1,1 балла; через 45 дней лечения — 9,4 ± 0,9; через 90 дней – 9,2 ± 0,9; Р < 0,05) и памяти (оценка по ШДМ: соответственно 21,2 ± 2,5; 22,0 ± 2,2 и 23,0 ± 1,9 балла; Р < 0,05). По данным пробы Шульте нейродинамические расстройства достоверно уменьшались уже через 1,5 месяца приема милдроната (соответственно 61,4 ± 47,3 и 54,8 ± 41,3 с; Р < 0,05). Все это может указывать на то, что у пациентов, перенесших ишемический инсульт, достоверное улучшение памяти происходит уже через 1,5 месяца приема милдроната, а продолжение лечения способствует закреплению полученного результата.
Результаты нейропсихологического тестирования подтверждались и данными электрофизиологического исследования. Принято считать, что латентный период Р300 отражает скорость мыслительных процессов [25, 41]. У пациентов с ДЭ, перенесших ишемический инсульт, через 1,5 месяца терапии отмечалось достоверное укорочение латентного периода Р300 в лобном отведении при невербальной стимуляции (исходно — 441,3 ± 58,3 мс, через 45 дней лечения – 422,0 ± 48,6 мс; Р < 0,05). В связи с этим следует отметить, что по результатам различных исследований у пациентов с лобно-подкорковым дефицитом когнитивной деятельности на начальных этапах патологического процесса в большей степени страдает субдоминантное полушарие [12, 13]. Эти данные вполне согласуются с результатами нашего исследования, в которое вошли пациенты с сосудистой дисфункцией, носящей характер лобно-подкоркового дефицита.
Таким образом, терапия милдронатом в течение 1,5 месяца оказывает положительное воздействие на лобно-подкорковые когнитивные расстройства.
Литература
1. Антоненко Л.М. Особенности поддержания равновесия и ходьбы у пожилых больных с болезнью Паркинсона, прогрессирующим надъядерным параличом и мультисистемной атрофией: дис. … канд. мед. наук. — М., 2004.
2. Брыжахина В.Г. Нарушения ходьбы и равновесия у больных с дисциркуляторной энцефалопатией пожилого возраста: дис. … канд. мед. наук. — М., 2002.
3. Брыжахина В.Г., Дамулин И.В. // Вестник практ. неврологии. —2003. —№ 7. — С. 17—21.
4. Брыжахина В.Г., Дамулин И.В., Яхно Н.Н. // Неврол. журнал. —2004. —Т. 9, № 2. — С. 11—16.
5. Виноградов А.В., Люсов В.А., Савчук В.И. и др. // Экспериментальная и клиническая фармакотерапия. — Рига, 1991. — С. 85–90.
6. ДамулинИ.В. // Consilium medicum. — 2002. — Т. 5, № 2. — С. 64–70.
7. Дамулин И.В., Брыжахина В.Г., Шашкова Е.В. и др. // Неврол. журнал. — 2004. — Т. 9, № 4. — С. 13 — 19.
8. Жученко Т.Д. Нарушения равновесия у больных пожилого возраста с хронической сосудистой мозговой недостаточностью (клинико-стабилографический анализ): дис. … канд. мед. наук. — М., 1995.
9. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: метод. пособие для врачей. — М., 2005.
10. Калвиньш И.Я. Милдронат – механизм действия и перспективы его применения. — Рига, 2001.
11. Карпов Р.С., Кошельская О.А., Врублевский А.В. и др. // Кардиология. — 2001. — Т. 6. — С. 69–74.
12. Коберская Н.Н. // Неврол. журнал. — 2003. — Т. 8, № 6. — С. 34—42.
13. Корсакова Н.К., Московичюте Л.И. Подкорковые структуры мозга и психические процессы. — М., 1985.
14. ПарфеновВ.А. // Consilium medicum. — 2000. —Т. 14, № 9. — C. 689–693.
15. Черникова Л.А., Устинова К.И., Иоффе М.Е. и др. // Бюлл. СО РАМН. —2004. — № 3 (113). — С. 85–91.
16. Шварц Г.Я. Витамин D и D-гормон. — М., 2005.
17. Шевченко Л.А. // Неврол. вестник. —1998. — Т. 25, вып. 3–4. — С. 14–18.
18. Яхно Н.Н., Левин О.С., Дамулин И.В. // Неврол. журнал. — 2001. — Т. 6, № 2. — С. 10–15.
19. Butefisch C.M., Netz J., Webling M. et al. // Brain. — 2003. —Vol. 126. —P.470—481.
20. Cao Y., D’Olhaberriague L., Vikngstad E.M. et al. // Stroke. — 1998. —Vol. 29. —P.112—122.
21. Censori B., Manara O., Agostinis C. et al. //. Stroke. — 1996. —Vol. 27. —P.1205—1210.
22. Della Sala S., Francescani A., Spinnler H. // J. Neurol. Neurosurg. Psychiatry. — 2002. —Vol. 72. —P.77–85.
23. Dennis M.S., Lo K.M., McDowall M. et al. // Stroke. — 2002. —Vol. 33. —P.728—734.
24. Folstein M.F., Folstein S., McHugh P.R. // J. Psychiatr. Res.—1975. —Vol. 12. —P. 189—198.
25. Goodin D.S., Squires K.S., Starr A. // Brain. — 1978. —Vol. 101. —P. 635—639.
26. Jaffe D.L., Brown D.A., Pierson-Carey C.D. et al. // J. Rehabil. Res. Dev. — 2004.—Vol. 41. — P. 83—92.
27. Jorgensen L., Jacobsen B.K., Wilsgaard T. et al. // Osteoporosis Intern. — 2000. —Vol. 11. —P. 381—387.
28. Kase C.S., Wolf P.A., Kelly-Hayes M. et al. // Stroke. — 1998. —Vol. 29. —P.805—812.
29. Kirker S.G., Simpson D.S., Jenner J.R. et al. // J. Neurol. Neurosurg. Psychiatry.—2000. — Vol. 68(4). —P.458—464.
30. Kwakkel G., Kollen B.J., Wagenaar R.C. // J. Neurol. Neurosurg. Psychiatry. — 2002. —Vol. 72. —P.473—479.
31. Laufer Y., Sivan D., Schwarzman R. et al. // Neurоl. Repair. — 2003. —Vol. 17. —P.207–213.
32. Mattis S. Dementia Rating Scale. — Odessa: Psychological Assessment Resources, 1988.
33. Mayer Y.S., Barron D.W. // Brain. — 1960. —Vol. 83. —P. 261—284.
34. Meins W., Meier-Baumgartner H.-P., Neetz D. et al. // Gerontol. Geriatr. —2001. —Vol.34. —P.395—400.
35. Nardone A., Galante M., Lucas B. et al. // J. Neurol. Neurosurg. Psychiatry. — 2001. —Vol. 70. —P.635—643.
36. Olney S.J., Richards C. // Gait & Posture. —1996. —Vol. 4. —P.136—148.
37. Pantano P., Formisano R., Ricci M. et al. // Brain. — 1996. —Vol. 119. —P. 1849—1857.
38. Paolucci S., Antonucci G., Grasso M.G. et al. // Stroke. — 2003. —Vol. 34 (12). —P. 2861—2865.
39. Perry J., Garrett M., Gronley J.K. et al. // Stroke. — 1995. —Vol. 26. —P. 982—989.
40. Pohjasvaara T., Erkinjuntti T., Vataja R. et al. //Stroke. — 1997. —Vol. 28. —P. 729—735.
41. Polich J., Ehlers C., Otis S. et al. // Electroenceph. Clin. Neurophysiol. — 1986. —Vol. 63. —P. 138—144.
42. Poole K.E.S., Reeve J., Warburton E.A. // Stroke. — 2002. —Vol. 33. —P. 1432—1436.
43. Poole K.E.S., Warburton E.A., Reeve J. // Osteoporosis Intern. —2005. —Vol. 16. —P.302—305.
44. Sato Y., Asoh T., KondoI. et al. // Stroke. — 2001.—Vol. 32. —P. 1673—1677.
45. Sato Y., Metoki N., Iwamoto J. et al. // Neurology. — 2003. —Vol. 61. —P. 338—342.
46. Sunderland A. // Stroke. — 2000. —Vol. 31. —P.430—438.
47. Syrjala P., Luukinen H., Pyhtinen J. et al. // J. Neurol. — 2003. —Vol. 250. —P.1063—1069.
48. Tinetti M.E. // J. Amer. Geriatr. Soc. — 1986. —Vol. 34. —P.119—126.
49. Tinetti M.E. // New Engl. J. Med. — 2003. —Vol. 348 (1). —P.42–49.
50. Troisi E., Paolucci S., Silvestrini M. et al. // Acta Neurol. Scand. — 2002. —Vol. 105. —P. 100—106.
51. Van Doorn C., Gruber-Baldini A.L., Zimmerman S. et al. // J. Amer. Geriatr. Soc. — 2003. —Vol. 51. —P. 1213–1218.
52. You S.H., Jang S.H., Kim Y.-H. et al. // Stroke. — 2005. —Vol. 36 (6). —P.1166—1171.
Материал предоставлен Представительством АО «Grindeks» (Латвия) в Республике Беларусь
Медицинские новости. - 2008. – №1. – С. 26-30.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.