|

Исмаилзаде Дж.М., Ибрагимов Т.Г., Байрамов Р.И.,Велиева Ш.М.
Функциональная характеристика больных с хроническим
деструктивным туберкулезом легких и гипертензией легочной
артерии
Азербайджанский медицинский университет, Баку, Противотуберкулезный диспансер №4, Баку, Азербайджан
IsmayilzadehJ.M., IbrahimovT.G., BayramovR.I., VeliyevaSh.M.
Azerbaijan Medical University, Baku
Baku City Tuberculosis Dispensary N4, Azerbaijan
The functional characteristics of patients with chronic destructive lung
tuberculosis and pulmonary arterial hypertension
Резюме. Цель исследования – изучение взаимосвязи между функциональными, гемодинамическими и рентгенологическими показателями легких, а также показателями газового состава крови у больных (n = 90) с хроническим деструктивным туберкулезом легких (ХДТЛ) для выявления у них механизма развития хронического легочного сердца. Все больные в зависимости от объема морфологических изменений были разделены на 3 группы: в I группу включены 32 больных с вовлечением в туберкулезный процесс двух долей обоих легких; во II группу – 30 больных с вовлечением целого легкого; в III группу – 28 больных с вовлечением целого легкого и одной доли другого легкого. У больных с увеличением объема необратимых специфических и неспецифических (склероз, фиброз, цирроз) поражений возрастал уровень одышки: с увеличением интенсивности изменений уменьшалось расстояние при проведении теста 6-минутной ходьбы. Выраженные изменения газового состава артериальной крови при комнатных условиях наблюдалось у пациентов с большим объемом специфических изменений в легких. Вышеуказанные изменения, в свою очередь, приводят к развитию длительной гипоксемии и эффекту Ейлера – Лилгестранда. Во время обследований, проведенных с помощью катетера Свана – Ганца, обнаружены острые нарушения гемодинамики и их зависимость от специ-фических и неспецифических изменений в легких. Так, систолическое, диастолическое и среднее давление в легочной артерии изменяется в зависимости от объема необратимых морфологических изменений в легких, это в наиболее острой форме проявлялось у больных III группы.
Ключевые слова: хронический деструктивный туберкулез легких, пульмонарная артериальная гипертензия, хроническое легочное сердце, газовый состав артериальной крови, эффект Ейлера – Лилгестранда, необратимые морфологические изменения в легких.
Медицинские новости. – 2016. – №3. – С. 78–82.
Summary. The aim of the study is to understand the connection between changes in the functional characteristics of patients (n = 90) suffering from chronic destructive lung tuberculosis (CDLT) with hemodynamic, radiological changes and changes in the composition of blood gas in order to clarify the development mechanisms of chronic cor pulmonale. All patients with CDLT depending on the volume of morphological changes were diveded into 3 groups: the I group included 32 patients, involving two lobes of the both lung; the II group the 30 patients, involving with whole of lung, the III group involving 28 patients with the whole of lung and another one lobe of the lung. With the increase in the scope of specific and non-specific irreversible morphological changes (fibrosis, cirrhosis, sclerosis) in patients, their dyspnoea index also rises and yet the walking distance of 6 min. was the shortest. Abrupt changes in the composition of arterial blood gas in the lungs have led to the development of respiratory acidosis and this was more acutely observed in patients of group III. All these indications, in turn, resulted in continuous arterial blood hypoxemia and as an indicator of the Von Euler and Lilgestrand effect. Hemodynamic changes detected during the inspections carried out using a Swan – Ganz catheter directly depend on specific and nonspecific changes in lungs. Thus, the systolic, diastolic and mean blood pressure in the pulmonary artery changes depending on the scope of irreversible morphological changes in lungs and this can be observed more acutely in patients from group III.
Keywords: chronic destructive lung tuberculosis, pulmonary arterial hypertension, chronic cor pulmonale, arterial blood gas, Von Euler and Lilgestrand effect, irreversible morphological changes in lungs.
Meditsinskie novosti. – 2016. – N3. – P. 78–82.
Хронический деструктивный туберкулез легких (ХДТЛ) является одной из клинических форм туберкулеза легких и характеризуется прогрессивным течением. Частые обострения этого заболевания приводят к прогрессированию заболевания и к развитию различных осложнений, в том числе гипертензии легочной артерии и хроническому легочному сердцу. Согласно анализу данных по ведению больных с прогрессирующей правожелудочковой недостаточностью можно констатировать тот факт, что механизмы изменения различных параметров правого желудочка еще недостаточно изучены [1–5].
Цель исследования – изучение взаимосвязи между функциональными, гемодинамическими и рентгенологическими показателями легких, а также показателями газового состава крови у больных с хроническим деструктивным туберкулезом легких для выявления механизма развития хронического легочного сердца у этих больных.
Материалы и методы
В исследование были включены 90 больных с ХДТЛ, госпитализированных в терапевтические отделения противотуберкулезного диспансера № 4 города Баку. Все больные с ХДТЛ в зависимости от объема морфологических изменений были разделены на три группы: в I группу включены 32 больных с вовлечением в туберкулезный процесс двух долей обоих легких; во II группу – 30 больных с вовлечением целого легкого; в III группу – 28 больных с вовлечением одного целого легкого и одной доли другого.
Использовали спирометрию, ЭКГ, ЭхоКГ, С-реактивный белок (СРБ), правожелудочковую катетеризацию сердца (ПКС).
Спирометрическое обследование проведено с помощью аппарата «AutospiroAS 505» (Япония). ЭКГ-обследование выполнено при помощи аппарата итальянской фирмы «Cardioline» EKQ «ar 600» в стандартных отведениях (I, II, III), усиленных отведениях от конечностей (аVR аVL и аVF) и грудных отведениях (V1–V6). ЭхоКГ производилась при помощи аппарата «Aloka 1700». Регистрация – при помощи ультразвукового 3mHgчастотного датчика.
Метод определения количества СРБ основан на образовании в плазме крови иммунных комплексов к антителам, имеющимся в специфической плазме, что сопровождается проявлением видимой реакции агглютинации с реактивом латекса.
Методика установки катетера Свана – Ганца в легочной артерии. Перед введением катетера Свана – Ганца в сосудистое русло все каналы заполняют физиологическим раствором, проверяют баллончик, манометр и монитор. Катетер проводят в верхнюю полую вену, используя технику катетеризации подключичной и внутренней яремной вены. После проведения катетера в верхнюю полую вену баллончик заполняют физиологическим раствором: за продвижением кончика катетера с баллончиком следят по кривой давления на экране монитора. Отрицательные волны низкого давления в верхней полой вене совпадают с дыхательным циклом. В правом предсердии появляются положительные волны, синхронные сердечному циклу. При продвижении катетера в правый желудочек регистрируются высокоамплитудные колебания давления, соответствующие систоле и диастоле. В легочной артерии сохраняются амплитудные колебания давления, но давление, в отличие от правожелудочковой кривой, не снижается до нуля. Катетер осторожно продвигают вперед по легочному стволу до резкого снижения амплитуды кривой давления. В этой точке измеряют давление заклинивания легочной артерии (ДЗЛА). Аспирируют физраствор из баллончика, вытягивают катетер на 5 см. Вновь медленно заполняют баллончик и повторно устанавливают катетер в точке «заклинивания», повторно измеряют ДЗЛА. До следующего измерения давления баллончик освобождают от физраствора. После стабилизации гемодинамики и восстановления перфузии тканей катетер Свана – Ганца удаляют.
Для сравнения и определения достоверности различий количественных значений в парных группах использовался непараметрический критерий Уилкоксона (Манна – Уитни), а между множественными группами критерий Краскела – Уоллиса. Корреляционные связи между изучаемыми параметрами определены по критерию Спирмена. Вычисления проводились с помощью программного пакета SPSS-20.
Результаты и обсуждение
В таблице представлены клинические, функциональные, гемодинамические и эхокардиографические данные больных, включенных в исследование. Возрастной и половой состав, а также индекс массы тела у больных в различных группах был относительно одинаковый, однако выявлена значительная разница при оценке такого важного показателя, как индекс одышки.
Таблица. Характеристика пациентов, включенных в исследование
|
Показатель
|
I группа (n=32)
|
II группа (n=30)
|
III группа (n=28)
|
Контроль (n=12)
|
pk-u
|
|
Пол (м / ж)
|
24 / 8
|
21 / 9
|
21 / 7
|
9 / 3
|
0,967
|
|
Возраст, лет
|
43,6±1,9
(24–70)
|
44,5±1,9
(29–69)
|
43,8±2,4
(24–66)
|
43,2±3,2
(25–59)
|
0,936
|
|
ИМТ, кг/м2
|
20,3±0,3
(16,9–24,2) ***
|
20,2±0,4
(16,9–24,2) ***
|
20,4±0,4
(16,9–24,2) ***
|
23,6±0,7
(20,3–26,8)
|
0,951
|
|
Одышка,
балл
|
2,00±0,16
(1–4) ***
|
3,30±0,23
(1–6) ***^^^
|
3,82±0,21
(2–6) ***^^^
|
0,50±0,15
(0–1)
|
<0,001
|
|
Функция внешнего дыхания
|
|
FEV1, %
|
58,0±1,8
(37–78) ***
|
52,0±1,6
(39–78) ***^
|
42,3±2,7
(22–68) ***^^^##
|
93,3±1,0
(89–99)
|
<0,001
|
|
FVC, %
|
61,4±2,2
(45–83) ***
|
53,4±1,8
(39–74) ***^^
|
38,1±1,6
(24–48) ***^^^###
|
99,2±1,6
(90–106)
|
<0,001
|
|
FEV1/FVC, %
|
94,9±1,1
(82–103)
|
98,9±2,8
(73–126)
|
109,1±3,3
(92–142) **^^^#
|
94,3±1,6
(85–100)
|
0,004
|
|
RV, %
|
88,1±1,0
(76–98) ***
|
82,9±0,9
(72–90) ***^^^
|
71,4±1,6
(58–86) ***^^^###
|
94,9±0,8
(90–99)
|
<0,001
|
|
TLC, %
|
78,4±1,5
(64–89) ***
|
70,2±1,5
(59–86) ***^^^
|
60,7±2,6
(42–94) ***^^^##
|
89,3±1,3
(84–96)
|
<0,001
|
|
DLсо, %
|
56,3±1,7
(39–70) ***
|
46,9±1,7
(32–61) ***^^^
|
35,8±2,1
(22–52) ***^^^###
|
88,8±1,3
(82–96)
|
<0,001
|
|
Газовый состав артериальной крови (при комнатной температуре)
|
|
PаO2, мм рт.ст.
|
59,8±2,1
(42–82) ***
|
55,4±2,0
(36–75) ***
|
50,7±2,2
(28–69) ***^^
|
94,3±1,0
(86–98)
|
0,058
|
|
PаСO2, мм рт.ст.
|
34,9±0,6
(28–40) ***
|
42,9±1,2
(32–55) ^^^
|
49,7±1,6
(29–59) ***^^^##
|
39,6±0,8
(36–45)
|
<0,001
|
|
рН
|
7,445±0,015
(7,32–7,62) *
|
7,409±0,012
(7,29–7,5)
|
7,308±0,011
(7,22–7,4) ***^^^###
|
7,393±0,009
(7,35–7,45)
|
<0,001
|
|
6-минутный тест
|
398,4±9,2
(330–500) ***
|
354,0±6,2
(250–390) ***^^^
|
249,6±11,6 (160–360) ***^^^###
|
549,2±8,5
(520–600)
|
<0,001
|
|
Биологический тест
|
|
СРБ, мг/мл
|
14,8±1,2
(3–31) ***
|
20,3±1,2
(8–32) ***^^
|
28,1±1,2
(14–40) ***^^^###
|
2,9±0,3
(1,2–4,2)
|
<0,001
|
|
LVEF (Эхо), %
|
60,1±1,4 (49–76) **
|
63,4±1,5 (49–77) ***
|
62,3±1,5 (52–76) ***
|
52,9±0,8 (49–58)
|
0,191
|
|
Катетеризация правого желудочка сердца
|
|
PAPs, мм рт.ст.
|
36,2±2,5
(25–48) **
|
45,6±1,0
(39–50) ***^^
|
54,5±3,0
(39–68) ***^^^#
|
25,0±0,9
(23–29)
|
<0,001
|
|
PAPm, мм рт.ст.
|
27,3±1,5
(21–34) ***
|
32,0±1,4
(24–38) ***^
|
47,8±1,7
(40–56) ***^^^###
|
13,7±0,7
(12–16)
|
<0,001
|
|
PAPd, мм рт.ст.
|
15,7±1,6
(9–23) *
|
20,3±1,7
(12–28) ***
|
23,9±1,6
(16–31) ***^^
|
9,8±0,7
(7–12)
|
0,007
|
|
PVR
|
3,1±0,2
(2,3–3,7) *
|
4,2±0,3
(2,9–5,2) ***^^
|
4,9±0,3
(3,2–5,9) ***^^^
|
2,4±0,1
(2–2,9)
|
0,001
|
|
PCWP, мм рт.ст.
|
6,0±0,3
(4,8–7,2) **
|
6,7±0,2
(5,8–7,6) ***
|
6,9±0,2
(5,4–7,8) ***^
|
4,7±0,2
(4–5,2)
|
0,058
|
|
Серд. индекс,
л/мин/м2
|
2,9±0,1(2,6–3,2) *
|
2,9±0,1
(2,6–3,2) *
|
2,8±0,1
(2,6–3,1) **
|
3,1±0,1
(2,8–3,4)
|
0,532
|
|
AP/AO
|
0,842±0,021
(0,75–0,96) *
|
0,986±0,02
(0,86–1,06) ***^^^
|
1,130±0,019
(0,97–1,04)***
|
0,757±0,017
(0,7–0,8)
|
<0,001
|
П р и м е ч а н и я : 1) статистически значимая разница (по Уилкоксону (Манну – Уитни)): с показателями контрольной группы: * – p<0,05; ** – p<0,01; *** – p<0,001; с показателями I группы: ^ – p1<0,05; ^^ – p1<0,01; ^^^ – p1<0,001; с показателями III группы: # – p2<0,05; ## – p2<0,01; ### – p2<0,001.
2) pk-u – статистически значимая разница (по Кракселу – Уоллису) между группами больных.
3) LVEF – left ventricular ejection fraction; PAPd – diastolik pulmonary pressure; PAPm – mean pulmonary arterial pressure; PAPs – systolik pulmonary arterial pressure; PCWP – pulmonary capillary wedge pressure; PH – pulmonary hypertension; PVR – pulmonary vascular resistance; RHC – right heart catheterization; RV – residual volume; TLC – total lung capasity; Dlco – transfer lung capacity of carbon monoxide, AP/AO – diameter ratio between the pulmonary arterial truncus and the ascending aorta.
Интенсивность одышки у больных возрастала в зависимости от объема специфического процесса в легких. Этот показатель был более ярко выражен у больных III группы (по сравнению с пациентами I и II групп), то есть у больных со специфическими пневмосклеротическими и цирротическими поражениями целого легкого и одной доли другого легкого (I–III группы больных и группа контроля: 2,00±1,6; 3,30±0,23; 3,82±0,21 и 0,50±0,15 соответственно, p<0,001). Также у больных III группы при тесте 6-минутной ходьбе расстояние было наименьшим по сравнению с пациентами I и II групп (I– III группы больных и группа контроля: 398,4±9,2; 354,0±6,2; 249,6±11,6 и 549,2±8,5 соответственно, p<0,001).
Было также обнаружено различие результатов при оценке клинических симптомов ХДТЛ у больных с пульмонарной гипертензией, и надо отметить, что у больных этой группы с увеличением объема необратимых специфических и неспецифических (склероз, фиброз, цирроз) поражений возрастал индекс одышки. Таким образом, с увеличением интенсивности изменений уменьшается расстояние при выполнении теста с 6-минутной ходьбой (рис. 1).
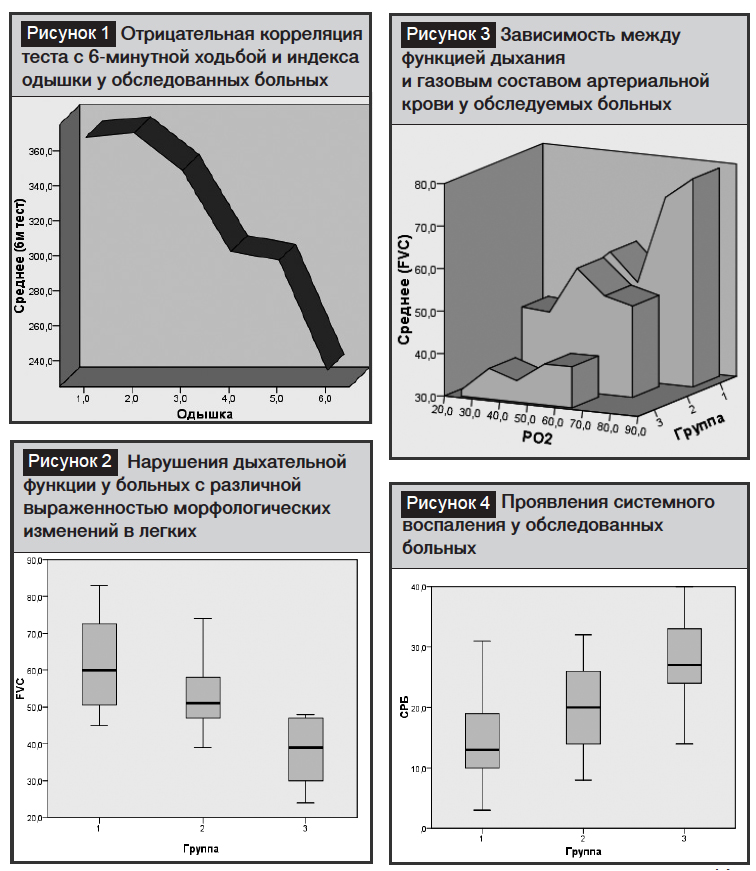
Сравнение клинических симптомов у больных различных групп выявило важность функциональных показателей легких.
Изучение основных параметров функции внешнего дыхания показало, что у больных I группы, с наименьшими специ-фическими поражениями, нарушение дыхательной функции не носило острый характер. Во II группе, у больных с двусторонними специфическими поражениями, дыхательная функция резко изменилась, увеличилась выраженность рестрикции. У больных III группы, со специфическими поражениями целого легкого и одной доли другого легкого, наблюдалось более выраженное нарушение дыхательной функции (рис. 2).
Во всех сравниваемых группах больных наблюдалось изменение функции внешнего дыхания по рестриктивному типу. Но выраженность рестрикции увеличивалось в зависимости от объема специфических и неспецифических процессов в легких. Именно по сравнительным результатам полученных данных можно сказать, что между объемом специфических и неспеци-фических необратимых морфологических изменений в легких и показателями FVC есть отрицательная корреляционная зависимость. Это говорит о том, что чем больше морфологических изменений в легких, тем ниже функциональные показатели FVC (I–III группы больных и группа контроля: 61,4±2,2; 53,4±1,8; 38,1±1,6 и 99,2±1,6 соответственно, p<0,001). Функциональные изменения рестриктивного характера подтверждаются увеличением индекса Тиффно (FEV1/FVC≥75%), функциональные показатели FEV1 и FVCстали ниже нормы (80%). У всех сравниваемых больных показатель FEV1, отражающий степень нарушения проходимости бронхов и уменьшения скорости потока воздуха, уменьшился; однако показатели FVCу различных групп больных снизились в большей степени, чем показатели FEV1, что позволяет оценивать нарушения внешнего дыхания у обследуемых нами больных как развивающиеся по рестриктивному типу.
Один из важных моментов – неактуальность у наших больных курения как фактора риска, в связи с чем была минимизирована возможность бронхиальной обструкции (мы привлекли к исследованию некурящих) [6–8].
Газовый состав артериальной крови при комнатных условиях – еще один важный показатель. Выраженные изменения газового состава артериальной крови в легких, как следствие развития респираторного ацидоза, наблюдалось у больных III группы, с большим объемом специфических изменений в легких (рис. 3). Именно поэтому изменения в газовом составе артериальной крови характеризуются изменениями функции дыхания с позитивной гемодинамикой.
Анализ изменения функциональных показателей в связи с интенсивностью специфических изменений показал прямую зависимость между ними. Большие изменения выявлялись у больных III группы.
Остаточный объем (RV) (I–III группы больных и группа контроля: 88,1±1,0; 82,9±0,9; 71,4±1,6 и 94,9±0,8 соответственно, p<0,001) и максимальный объем легких (TLC) (I–III группы больных и группа контроля: 78,4±1,5; 70,2±1,5; 60,7±2,6 и 89,3±1,3 соответственно, p<0,001) в большей степени уменьшается у больных IIIгруппы. Уменьшение объема легких приводит к потере площади перфузионной вентиляции легких, и это в свою очередь завершается уменьшением объема диффузии монооксида карбоната (CO) легкими.
Вышеуказанные изменения вызывают развитие длительной гипоксемии и эффект Ейлера – Лильестранда (альвеолярно-васкулярный рефлекс) проявляющиеся как гипоксическая пульмонарная вазоконстрикция, а затем и пульмонарная артериальная гипертензия. Надо отметить, что уменьшение диффузионной способности легких находится в прямой зависимости от объема необратимых морфологических изменений в легких. Именно поэтому наиболее резкое уменьшение диффузионной способности легких наблюдалось у больных III группы (I–III группы больных и группа контроля: 56,3±1,7; 46,9±1,7; 35,8±2,1 и 88,8±1,3 соответственно, p<0,001).
Результаты биологических исследований, а также последующее повреждение и ремодуляция легочных сосудов у больных этой категории доказывают формирование пульмонарной артериальной гипертензии (ПАГ) как постоянного компонента системного воспаления. Установлены различия при изучении у наблюдаемых пациентов концентрации C-реактивного белка (рис. 4).
Во время эхокардиографических обследований в различных группах больных были обнаружены изменения в правых отделах сердца; в левом желудочке функциональных нарушений не выявлено. У больных с ХДТЛ для обнаружения развития Cor pulmonale, одновременно с методом эхокардиографии, был проведен более точный метод правожелудочковой катетеризации.
Во время обследований, проведенных с помощью катетера Свана – Ганца, установлено, что острые нарушения гемодинамики находились в прямой зависимости от специфических и неспецифических изменений в легких. Так, систолическое, диастолическое и среднее давление в легочной артерии изменяется в зависимости от объема необратимых морфологических изменений в легких, а это в наиболее острой форме проявлялось у больных III группы, с высокими показателями среднего давления в легочной артерии (СДЛА) (I–III группы больных и группа контроля: 27,3±1,5; 32,0±1,4; 47,8±1,7 и 13,7±0,7соответственно, p<0,001) (рис. 5).
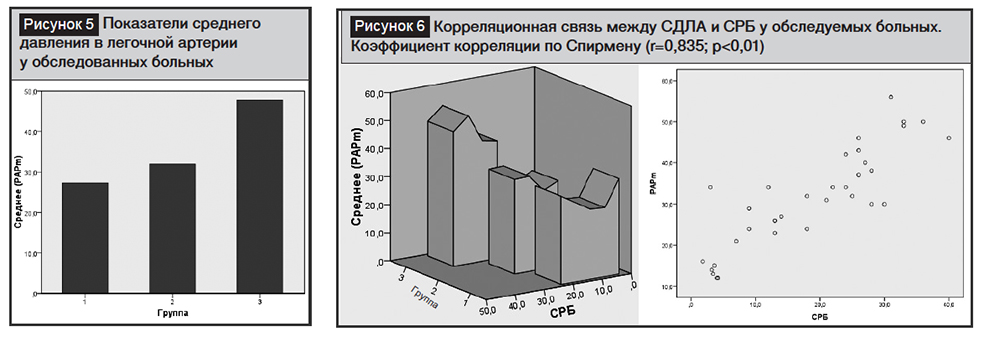
Необходимо отметить, что была обнаружена позитивная корреляционная зависимость между СРБ, являющимся предиктором у больных с системным воспалением, и СДЛА (рис. 6).
Другой важный бросающийся в глаза факт – наличие у больных связи между резистентностью пульмонарной артерии (РПА) и изменениями газового состава артериальной крови. Наши наблюдения показали, что наибольшее увеличение резистентности легочной артерии приводит к острому уменьшению артериальной гипоксемии.
Таким образом, у больных с ХДТЛ в формировании легочной гипертензии начальным механизмам является артериальная гипоксемия вследствие регионарного и тотального нарушения вентиляции на легочном уровне в связи с развитием в легких специфических (каверны) и неспецифических (фиброз, цирроз, склероз) необратимых изменений. В свою очередь, нарушения вентиляции становятся причиной перфузионных нарушений локального (регионарного) или тотального (на уровне легкого) характера и причиной гипоксемической пульмонарной вазоконстрикции, связанной с гиповентиляцией, а это становится непосредственной причиной повышения персистентной резистентности в системе пульмонарной артерии.
Один из следующих факторов – соотношение AP/AO (диаметра пульмонарной артерии и диаметра аорты). Наиболее высокие показатели соотношения диаметра пульмонарной артерии и диаметра аорты – у больных III группы, с наибольшими специ-фическими и неспецифическими необратимыми морфологическими изменениями в легких (Iи IIгруппы больных – 0,842±0,021 и 0,986±0,021, III группа – 1,130±0,019, группа контроля – 0,757±0,017; p<0,001).
У больных с ХДТЛ, несмотря на минимальность симптомов, в связи с развитием специфического процесса в результате постоянной комплексной противотуберкулезной терапии очень важный клинический признак связан с пульмонарной гипертензией, а основные признаки – одышка и тахикардия. Таким больным необходима медикаментозная корреляция в сочетании с постоянной вентиляционной поддержкой, при этом проводится длительная (15 часов и более в течение суток) кислородотерапия, а некоторым больным с гиперкапнией одновременно требуется длительная неинвазивная вентиляционная поддержка [6–9].
Л И Т Е Р А Т У Р А
1. Calcuetteea A., Chung R., Lindquist P. et al. // Heart. – 2011. – Vol.97, N12. – P.1004–1011.
2. Galie N. et al. // Eur. Respir. – 2009. – N34. – P.1219–1263.
3. Campo A., Mathai S.C., Pavec J. et al. // Eur. Respir. – 2011. – N38. – S.359–367.
4. World Health Organization. Global Tuberculosis Datalase. – Geneva, Switzerland [updated 2009, march 24; accessed 2009 December 27].
5. Rabinovitch M. // J.Clin. Invest. – 2008. – Vol.118. – S.2372–2779.
6. Seeger W., Adir Y., Barbera J.A. et al. // J. An Coll Cardiol. – 2013. – Vol.62 (suppl. 25). – P.D109–D116.
7. Rahagi F.N., Van Beek E.J. Washko G.R. // J. Thorac. imaging. – 2014. – Vol.29. – P.80–91.
8. Burgess M.I., Mogulkoc N., Bright-Thomas R.J. et al. // J. Am. Soc Echocardiogr. – 2002. – Vol.15. – P.633–639.
9. Iyer A.S., Wells J.M., Vishin S. et al. // Chest. – 2014. – Vol.145. – P.824–832.
Медицинские новости. – 2016. – №3. – С. 78-82.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|