AstapenkoA.V.1, YakovlevA.N.2, TarasevichM.I3., ZubritskiS.M.4,
1Republican Scientific and Practical Center of Neurology and Neurosurgery, Minsk, Belarus
2Minsk Municipal Centre for Medical Rehabilitation of Children with Neurological Disorders, Belarus
3Minsk Municipal Hospital N2, Belarus
4Minsk Municipal Hospital N9, Belarus
Mydocalm in clinical practice: effectiveness and safety
Резюме. Приведены результаты мониторинга применения Мидокалма (толперизона) у 1591 пациента для лечения спастичности: у взрослых при органических заболеваниях нервной системы (восстановительный период и последствия острого нарушения мозгового кровообращения, черепно-мозговой травмы, демиелинизирующие заболевания и др.), при мышечно-тонических болевых синдромах вертеброгенного генеза, а также в педиатрии при детском церебральном параличе и близких к нему нозологических формах. Подтверждена достаточная эффективность Мидокалма в терапии спастичности центрального генеза у взрослых и детей. Отмечен достоверный регресс болевого и мышечно-тонического вертеброгенных синдромов. Установлен высокий уровень безопасности применения Мидокалма в инъекционной и таблетированной формах, в том числе при комбинации с НПВС.
Ключевые слова: спастичность, мышечно-тонические болевые синдромы, детский церебральный паралич, мидокалм (толперизон), эффективность, безопасность.
Медицинские новости. – 2016. – №3. – С. 57–61.
Summary. The article describes the results of cohort monitoring of routine Mydocalm (tolperison) use in 1591 patients with spasticity in nervous system diseases (recovery and residuals after stroke, head injure, demyelinating diseases etc.), in muscle spasms due to back pain, in Little’s disease and similar diseases in children. The results confirmed effectiveness of Mydocalm for spasticity treatment in children and adults. The reliable regress of pain level and muscular spasm in back pain was shown. The monitoring confirmed high safety profile of Mydocalm tablets and injections, including its combination with NSAID.
Keywords: muscular spasticity, painful muscular spasm, Little’s disease, Mydocalm, tolperison, effectiveness, safety.
Meditsinskie novosti. – 2016. – N3. – P. 57–61.
Изменение мышечного тонуса, приводящее к ограничению двигательных функций, болевой синдром, вторичные изменения суставов и мышц наблюдаются при заболеваниях нервной системы различного генеза. Непроизвольное мышечное напряжение встречается при поражениях головного и спинного мозга, повышенной возбудимости сегментарных мотонейронов, периферических нервов, мышечных волокон. Для лечения этого патологического состояния широко применяется фармакотерапия с использованием миорелаксантов.
Нарушение двигательных функций является одной из основных причин инвалидизации пациентов после инсульта. Для сохранения способности к самообслуживанию значимую роль играет возможность самостоятельного передвижения. Расстройства движений после инсульта могут быть обусловлены не только парезом, но и повышением мышечного тонуса, что снижает двигательную активность, ухудшает качество жизни пациента. По данным И.В. Дамулина, спастичность встречается у 65% пациентов, перенесших инсульт [2].
Исследование эффективности применения толперизона для фармакотерапии спастичности позволило сделать вывод, что снижение тонуса мышц сопровождалось улучшением повседневной активности пациентов, ростом их независимости и способности к самообслуживанию. Индивидуальный подбор дозы может существенно повысить уровень эффективности толперизона без риска для здоровья пациентов [5, 11].
Заболевания опорно-двигательного аппарата часто сопровождаются длительным болевым синдромом и рефлекторными мышечно-тоническими реакциями. Ведущее место в структуре этой патологии занимает дорсопатия – болевой синдром в области спины, обусловленный дистрофическими и функциональными изменениями в дугоотростчатых суставах, межпозвоночном диске, фасциях, мышцах, сухожилиях, связках, с возможным вовлечением смежных структур (корешка, нерва). В многообразии клинических признаков остеохондроза позвоночника ведущее место занимают рефлекторные синдромы с формированием мышечно-тонических, нейродистрофических и вегетативно-сосудистых проявлений. Рефлекторный мышечный спазм в ответ на боль в результате раздражения рецепторов синувертебрального нерва на начальных этапах заболевания имеет компенсаторно-приспособительный характер, но с течением времени приводит к формированию замкнутого круга: боль – мышечный спазм – боль. Распространенным методом воздействия на мышечный компонент боли при дорсопатии является использование миорелексантов. В ряде случаев комбинация миорелаксантов с нестероидными противовоспалительными средствами (НПВС) более эффективна, чем монотерапия НПВС [1, 3, 4, 6–9, 12].
Мидокалм (толперизон) относится к миорелаксантам центрального действия. Миорелаксирующее действие препарата реализуется на нескольких уровнях: периферический нерв, спинной мозг, ствол мозга, что обеспечивает эффективный разрыв связей в патологической цепи «боль – мышечный спазм – боль». Препарат обладает также мембраностабилизирующим эффектом, слабыми свойствами антагонистов??-адренергических рецепторов и антимускариновым действием, частично блокирует натриевые каналы. Важное качество Мидокалма (толперизона) – миорелаксация без сопутствующего седативного эффекта и влияния на повседневные виды активности пациентов. По литературным данным, побочные реакции встречаются менее чем в 1% случаев (Quasthoff, 2008; Slíva, 2008; Skála, 2009; Girish, 2010).
Широкое применение Мидокалма в клинической практике вызвало необходимость продолжения изучения безопасности и эффективности его использования, в том числе – частоты встречаемости реакций гиперчувствительности.
С этой целью в 2013 г. был начат международный фармакоэпидемиологический наблюдательный проект по изучению применения Мидокалма в реальной клинической практике при лечении болевых синдромов, сопровождающихся мышечным спазмом в рамках проспективного многоцентрового открытого несравнительного исследования, результаты которого были опубликованы в 2015 г. Проект был осуществлен на базе 2090 лечебно-профилактических учреждений в 284 городах 13 стран Восточной Европы. Объем выборки составлял более 30 тыс. случаев приема препарата пациентами со спастичностью и болевыми синдромами, сопровождавшимися мышечным спазмом, что было достаточным для оценки безопасности лекарственного средства. Полученные данные позволили сделать вывод о значительной распространенности использования Мидокалма в клинической практике, достаточном уровне эффективности и безопасности, отсутствии клинически значимого увеличения числа нежелательных реакций при комбинации с НПВС [10].
В Республике Беларусь проведен многоцентровой когортный мониторинг применения Мидокалма (толперизона) по утвержденным показаниям к его назначению у 1591 пациента на базе неврологических отделений УЗ «2-я городская клиническая больница» и «9-я городская клиническая больница», а также «Минский городской центр медицинской реабилитации детей с психоневрологическими заболеваниями». Срок проведения мониторинга: 01.10.2013–30.09.2014.
Мидокалм назначался по следующим показаниям:
1 – лечение гипертонуса и спастичности поперечно-полосатой мускулатуры при органических заболеваниях нервной системы;
2 – заболевания опорно-двигательного аппарата (дегенеративные поражения позвоночника), сопровождавшиеся болевым и мышечно-тоническим синдромом;
3 – болезнь Литтла и энцефалопатии у детей, протекающие со спастичностью поперечно-полосатой мускулатуры.
В соответствии с показаниями к назначению Мидокалма пациенты были распределены на три группы.
Для оценки эффективности терапии использовались шкалы:
– модифицированная шкала спастичности Ашворт (1-я и 3-я группы),
– визуальная аналоговая шкала боли – ВАШ (2-я группа),
– шкала мышечного напряжения (2-я группа),
– шкала общего клинического впечатления (1, 2 и 3-я группы).
Первая группа включала 463 пациента в возрасте от 24 до 84 лет, в том числе 205 (44%) женщин, 258 (56%) мужчин. Подавляющее большинство пациентов этой группы имели цереброваскулярные заболевания: восстановительный период после инфаркта мозга и внутримозгового кровоизлияния, а также их последствия (табл. 1).
Таблица 1. Нозологический состав 1-й группы пациентов с показаниями «1» и «1+2»
|
Код МКБ-10
|
Название рубрики MKБ-10
|
Количество пациентов
|
|
абс.
|
%
|
|
I63
|
Инфаркт мозга
|
310
|
67,1%
|
|
I69
|
Последствия цереброваскулярных болезней
|
61
|
13,2%
|
|
I61
|
Внутримозговое кровоизлияние
|
38
|
8,2%
|
|
G35
|
Рассеянный склероз
|
15
|
3,2%
|
|
I67
|
Другие цереброваскулярные болезни
|
9
|
1,9%
|
|
G51
|
Поражения лицевого нерва
|
9
|
1,9%
|
|
T90
|
Последствия травм головы
|
4
|
0,9%
|
|
G95
|
Другие болезни спинного мозга
|
4
|
0,9%
|
|
G09
|
Последствия воспалительных болезней центральной нервной системы
|
3
|
0,6%
|
|
G06
|
Внутричерепной и внутрипозвоночный абсцесс
и гранулема
|
2
|
0,4%
|
|
D32
|
Доброкачественное новообразование мозговых оболочек
|
2
|
0,4%
|
|
G81
|
Гемиплегия
|
1
|
0,2%
|
|
G80
|
Детский церебральный паралич
|
1
|
0,2%
|
|
G37
|
Другие демиелинизирующие болезни центральной нервной системы
|
1
|
0,2%
|
|
G36
|
Другая форма острой диссеминированной
демиелинизации
|
1
|
0,2%
|
|
G24
|
Дистония
|
1
|
0,2%
|
|
D48
|
Новообразование неопределенного или неизвестного характера других и неуточненных локализаций
|
1
|
0,2%
|
В 15 наблюдениях Мидокалм вводили внутримышечно, в 4 – внутримышечно с последующим переходом на прием препарата внутрь, 444 пациентам препарат назначали в таблетированной форме внутрь. Во всех случаях внутримышечного введения в группе с показаниями «1» и «1+2» Мидокалм применяли в дозе 1 мл (100 мг) один раз в день, при приеме внутрь суточная доза составляла 450 мг, равномерно распределенных на 3 приема (табл. 2).
Таблица 2. Способ введения Мидокалма и продолжительность терапии в 1-й группе пациентов с показаниями «1» и «1+2»
|
Способ введения
|
Количество пациентов
|
Медиана продолжительности терапии, дней;
Me (Q1:Q3)
|
Минимальная – максимальная продолжительность терапии, дни
|
|
Внутримышечно
|
15
|
7 (5:9,5)
[внутримышечное введение]
|
1?11
[внутримышечное введение]
|
|
Внутримышечно с последующим переходом на прием внутрь
|
4
|
|
Прием препарата внутрь
|
444
|
16 (12:18)
|
1?31
|
|
Все способы введения
|
463
|
16 (12:18)
|
1?31
|
Сопутствующая медикаментозная терапия у пациентов 1-й группы включала препараты нейрометаболического действия, антигипертензивные и гиполипидемические лекарственные средства.
Исходное значение мышечного напряжения по модифицированной шкале спастичности Ашворт составило 3 (2:4) балла [медиана и межквартильный размах], после окончания лечения – 1 (0:3) балл (рис. 1). Положительная динамика была достоверна (тест Wilcoxon, парный, p<0.0001).
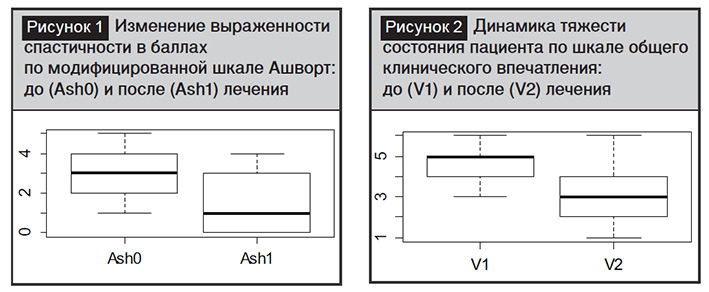
Медианный балл и межквартильный размах по шкале общего клинического впечатления до лечения составили 5 (4:5), что соответствовало значительной степени выраженности заболевания. После лечения – 3 (2:4), что соответствует слабой степени выраженности заболевания. Регресс показателя по шкале общего клинического впечатления графически представлен на рис. 2.
По оценке лечащих врачей, общее состояние пациентов 1-й группы после окончания курса лечения «значительно улучшилось» в 270 случаях (58%), «заметно улучшилось» – в 96 (21%), «немного улучшилось» – в 79 (17%), «без изменений» – в 18 (4%) наблюдениях
Вторую группу составили 988 пациентов в возрасте от 18 до 91 года с мышечно-тоническими и болевыми синдромами вертеброгенного генеза – Me (Q1:Q3) 57 (44:66), в том числе 343 (35%) женщины, 645 (65%) мужчин. В нозологической структуре этой группы подавляющее большинство составили неврологические проявления остеохондроза позвоночника (табл. 3).
Таблица 3. Нозологический состав 2-й группы пациентов с показанием «2»
|
Код МКБ-10
|
Название рубрики MKБ-10
|
Количество пациентов
|
|
абс.
|
%
|
|
M54
|
Дорсалгия
|
573
|
58%
|
|
M51
|
Поражение межпозвоночных дисков других отделов (M51.0, M51.1)
|
377
|
38%
|
|
M53
|
Другие дорсопатии, не классифицированные в других рубриках
|
24
|
2%
|
|
M50
|
Поражение межпозвоночных дисков шейного отдела
|
10
|
1%
|
|
C50
|
Злокачественное новообразование молочной железы (метастаз в позвоночник)
|
1
|
0,1%
|
|
D16
|
Доброкачественное новообразование костей
и суставных хрящей
|
1
|
0,1%
|
|
M46
|
Другие воспалительные спондилопатии
|
1
|
0,1%
|
|
M47
|
Спондилез
|
1
|
0,1%
|
В 126 наблюдениях Мидокалм вводили внутримышечно, в 73 – внутримышечно с последующим переходом на прием препарата внутрь, в 789 случаях препарат назначали в таблетированной форме внутрь. Внутримышечное введение Мидокалма осуществлялось в 196 случаях 1 раз в сутки по 100 мг и в 3 случаях – 2 раза в сутки по 100 мг; при приеме внутрь суточная доза составляла 450 мг, равномерно распределенных на 3 приема (табл. 4). У 666 пациентов сопутствующая терапия включала НПВС (нимесулид, диклофенак, кеторолак, ибупрофен). Исходная выраженность болевого синдрома в подгруппе, получавшей НПВС, была достоверно ниже, чем в подгруппе, их не получавшей [6 (6:7) баллов против 7 (6:8) (приведены медианы и межквартильный размах)].
Таблица 4. Способ введения Мидокалма и продолжительность терапии во 2-й группе пациентов
|
Способ введения
|
Количество пациентов
|
Медиана продолжительности терапии, дней; Me(Q1:Q3)
|
Минимальная – максимальная продолжительность терапии, дни
|
|
Внутримышечно
|
126
|
5 (5:12)
|
1?15
|
|
Внутримышечно с последующим
переходом на прием препарата внутрь
|
73
|
13 (11:15)
|
4?10
|
|
Прием препарата внутрь
|
789
|
11 (9:13)
|
1?30
|
|
Все способы введения
|
988
|
11 (9:13)
|
1?30
|
Выраженность болевого синдрома по шкале ВАШ у пациентов 2-й группы до лечения составила 6 (6:7) баллов, после курса лечения – 2 (1:3) балла (рис. 3). Разница достоверна (парный тест Wilcoxon, p<0,0001).
Регресс мышечно-тонического синдрома, оцененного по 5-балльной шкале, является наиболее адекватным параметром оценки основного фармакодинамического эффекта Мидокалма, поскольку другие миорелаксанты пациентам не назначались. Выраженность мышечного напряжения до лечения составила 2 (2:3) балла, после лечения 0 (0:1), p<0,0001 (рис. 4).
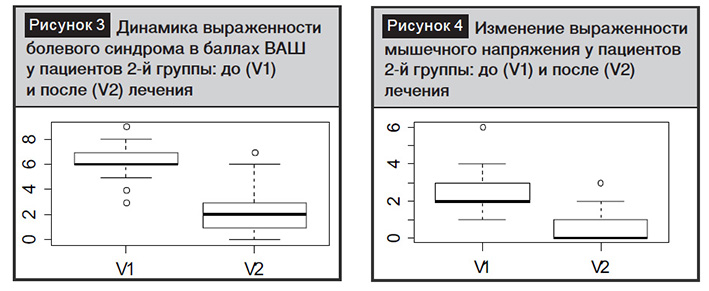
Исходная тяжесть состояния пациентов 2-й группы по шкале общего клинического впечатления [медиана (межквартильный размах)] была 4 балла (4:5), что соответствовало «умеренной степени выраженности заболевания». После курса лечения тяжесть состояния в группе составила 2 балла (1:3) – «состояние на грани нормы и патологии».
По оценке лечащих врачей, общее состояние пациентов после окончания курса лечения «значительно улучшилось» в 646 случаях (65,4%), «заметно улучшилось» – в 230 (23,3%), «немного улучшилось» – в 105 (10,6%), «без изменений» – в 7 (0,7%) наблюдениях.
Эффективность внутримышечного способа введения Мидокалма у взрослых пациентов
Мидокалм в виде внутримышечных инъекций (без последующего применения таблетированной формы) назначали 141 пациенту: 126 пациентам во 2-й группе и 14 – в 1-й, один пациент получал инъекции препарата по сочетанию показаний. Мидокалм в дозе 100 мг (1,0 мл) вводили 138 пациентам 1 раз в сутки, 3 пациентам – 2 раза в сутки.
У пациентов 1-й группы до лечения медианный балл по шкале спастичности Ашворт составил 4 с межквартильным размахом 3,5:4 балла. После лечения – 3 (3:3,5) балла. Различия достоверны, P=0,013(рис. 5).
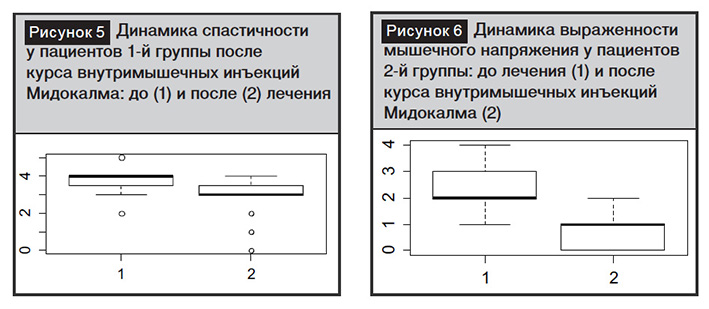
Выраженность болевого синдрома по ВАШ у пациентов 2-й группы после курса инъекций Мидокалма достоверно снизилась с 7 (6:7) до 2 (1:3) баллов. Мышечное напряжение, определенное по 5-балльной шкале, также достоверно снизилось с 2 (2:3) до 1 (0:1) балла (приведены медианы и межквартильный размах). Графически динамика выраженности мышечного напряжения представлена на рис. 6.
Исходно тяжесть состояния пациентов в анализируемой группе составила 5 (4:5) баллов по шкале общего клинического впечатления, после курса лечения – 3 (2:3) балла [медиана (межквартильный размах)]. В 75% случаев врачи оценили результат лечения как «значительное» или «заметное улучшение». Незначительное улучшение было отмечено в 25% случаев.
Эффективность Мидокалма в педиатрической практике
Третья группа. Применение Мидокалма в педиатрической практике изучено у 140 пациентов (41 (29%) девочка и 99 (71%) мальчиков). Большинство пациентов получали Мидокалм по поводу спастичности поперечно-полосатой мускулатуры при детском церебральном параличе и близких к нему нозологических формах: G80-G82 (табл. 5).
Таблица 5. Нозологический состав 3-й группы пациентов с показаниями в педиатрии
|
Код МКБ-10
|
Название рубрики MKБ-10
|
Количество пациентов
|
|
абс.
|
%
|
|
G80
|
Детский церебральный паралич
|
113
|
80,7%
|
|
G82
|
Параплегия и тетраплегия
|
11
|
7,9%
|
|
G81
|
Гемиплегия
|
8
|
5,7%
|
|
F82
|
Специфические расстройства развития моторной функции
|
3
|
2,1%
|
|
G96
|
Другие нарушения центральной нервной системы
|
3
|
2,1%
|
|
R26
|
Нарушения походки и подвижности
|
1
|
0,7%
|
|
Q03
|
Врожденная гидроцефалия
|
1
|
0,7%
|
Мидокалм назначали для приема внутрь, так как в соответствии с инструкцией по медицинскому применению у детей используются только таблетированные формы. Длительность терапии Мидокалмом в детском возрасте составила от 4 до 41 дней (медиана – 22,5, межквартильный размах Q1:Q3 – 17:25). Сопутствующая терапия включала препараты нейрометаболического действия, витамины В6, В12 и Е. В единичных случаях назначали антиконвульсанты (карбамазепин, вальпроаты). Только Мидокалм, без сопутствующей медикаментозной терапии, получали 36 пациентов.
Исходное значение спастичности по модифицированной шкале Ашворт составило 3 (3:4) балла [медиана и межквартильный размах], после курса лечения – 2 (2:3) балла. Положительная динамика спастичности была достоверна (тест Wilcoxon, парный, p<0,0001) (рис. 7).
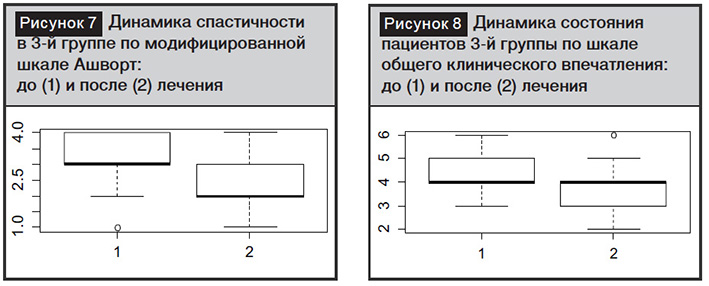
Тяжесть состояния пациентов 3-й группы по шкале общего клинического впечатления до лечения была 4 (4:5) балла, что соответствовало «умеренной степени выраженности заболевания». После курса лечения – 3 (3:4) балла. Динамика статистически значима (p<0,0001) (рис. 8).
По оценке лечащих врачей, общее состояние пациентов после окончания курса лечения «значительно улучшилось» в 99 случаях (71%), «заметно улучшилось» – в 39 (28%), «немного улучшилось» – в 105 (10,6%). Учитывая специфику 3-й группы, в которой повышенный мышечный тонус составлял ядро клинической картины заболевания, а другие факторы (болевой синдром и др.) не оказывали существенного влияния на выраженность спастики, положительная динамика была отнесена к терапевтическому эффекту Мидокалма. Принимая во внимание стойкость патологических изменений при детском церебральном параличе, заметное улучшение в 28% описанных случаев является существенным эффектом терапии.
Безопасность применения Мидокалма
В рамках проведенного мониторинга было зарегистрировано 3 случая несерьезных побочных явлений из 1591 находившихся под наблюдением пациентов. К побочным явлениям относились явно манифестные случаи с резким и необычным изменением самочувствия или объективными признаками побочных реакций (например, кожная сыпь).
В одном случае у пациентки 1-й группы с патологией центральной нервной системы и у одной пациентки 2-й группы на фоне приема Мидокалма внутрь развилась аллергическая реакция в виде сыпи и зуда в области лица и спины, которые регрессировали после отмены препарата и назначения лоратадина.
В одном наблюдении у пациентки с наличием спастичности центрального генеза отмечалась общая слабость на фоне приема Мидокалма 450 мг в сутки внутрь. После снижения дозы препарата до 150 мг в сутки указанные явления регрессировали.
Таким образом, проведенный мониторинг использования Мидокалма (толперизона) в неврологической практике показал его хорошую эффективность в терапии спастичности центрального генеза у взрослых и у детей, отмечен достоверный регресс болевого и мышечно-тонического синдромов при дегенеративных процессах в позвоночнике. Установлен высокий уровень безопасности применения Мидокалма в инъекционной и таблетированной формах, в том числе при комбинации с НПВС.
Л И Т Е Р А Т У Р А
1. Гурак С.В., Борисов К.Н., Парфенов В.А. // Боль. – 2006. – №3. – С.27–30.
2. Дамулин И.В. // Рос. мед. журн. – 2005. – №7. – С.3–7.
3. Камчатнов П.Р., Трубецкая Е.А. // Рос. мед. журн. – 2012. – №2. – С.39–43.
4. Камчатнов П.Р., Умарова Х.Я., Чугунов А.В.., Казаков А.Ю. // Нервно-мышечные болезни. – 2013. – №3. – С.32–37.
5. Ковальчук В.В., Скоромец А.А., Васильева И.В. // Журн. неврологии и психиатрии им. С.С.Корсакова. – 2008. – №8. – С.14–19.
6. Кремис В.М. // Кубанск. науч. мед. вестник. – 2009. – №3 (180). – С.63–66.
7. Кукушкин М.Л. // Рос. журн. боли. – 2012. – №2 (35). – С.15–19.
8. Лихачев С.А., Войтов В.В., Ващилин В.В. и др. // Рецепт. – 2007. – №2 (52). – С.95–98.
9. Садоха К.А. // ARS medica. Неврология и нейрохирургия. – 2010. – №7 (27). – С.90–95.
10. Скоромец А.А., Гехт А.Б., Галанов Д.В. и др. // Журн. неврологии и психиатрии им. С.С.Корсакова. – 2015. – №12. – С.104–109.
11. Стаменова П., Койтчев Р., Кюн К. и др. // Журн. неврологии и психиатрии им. С.С.Корсакова. – 2006. – №1 (106). – С.34–42.
12. Умарова Х.Я., Камчатнов П.Р., Осмаева З.Х. // Рос. мед. журн. – 2015. – №10. – С.584–588.
Медицинские новости. – 2016. – №3. – С. 57-61.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.