.jpg)
Kozhanova I.N., Romanova I.S.
Belarusian State Medical University, Minsk
Lisinopril in clinical practice
Резюме. Ингибиторы ангиотензинпревращающего фермента занимают ведущие позиции в лечении пациентов с сердечно-сосудистыми заболеваниями. Эти препараты наряду с отчетливым антигипертензивным эффектом оказывают и выраженное органопротективное действие, связанное с влиянием на тканевые ренин-ангиотензин-альдостероновые системы, локализованные в различных органах. Лизиноприл является самым исследованным в клинических испытаниях ингибитором ангиотензинпревращающего фермента длительного действия. В статье представлены особенности фармакокинетики и фармакодинамики лизиноприла, а также показания к применению в клинической практике с позиций доказательной медицины.
Ключевые слова: ингибиторы ангиотензинпревращающего фермента, лизиноприл, сердечно-сосудистые заболевания.
Summary. ACE inhibitors have leading positions in the treatment of patients with cardiovascular disease. These drugs have antihypertensive effect and organoprotective effect associated with exposure to the tissue renin-angiotensin-aldosterone system, localized in different organs. Lisinopril is one of the most studied in clinical trials of long-acting ACE inhibitors. The article presents the features of the pharmacokinetics and pharmacodynamics lisinopril and indications in the clinical practice for use from the perspective of evidence-based medicine.
Keywords: ACE inhibitors, lisinopril, cardiovascular disease.
На современном этапе развития фармакологии ингибиторы ангиотензинпревращающего фермента (иАПФ) рассматриваются как один из ведущих классов лекарственных средств (ЛС), применяемых для лечения сердечно-сосудистых заболеваний [1, 9]. Одним из наиболее часто используемых в клинической практике препаратов данной группы является лизиноприл. Препарат представлен на белорусском рынке 20 лет.
Лизиноприл относится к дикарбоксилсодержащим иАПФ (табл. 1).
Таблица 1. Классификация иАПФ
|
Классификация иАПФ
|
Препараты
|
|
По химическому строению
|
|
препараты, содержащие сульфгидрильную группу
|
каптоприл, зофеноприл
|
|
препараты, содержащие карбоксиалкильную группу
|
эналаприл, лизиноприл, периндоприл, квинаприл, рамиприл
|
|
препараты, содержащие фосфинильную группу
|
фозиноприл и церонаприл
|
|
препараты, содержащие гидроксамовую группу
|
индраприл
|
|
По биологической активности
|
|
ЛС, непосредственно обладающие биологической активностью
|
каптоприл, лизиноприл
|
|
Пролекарства, превращающиеся в активные метаболиты путем гидролиза в печени или желудочно-кишечном тракте
|
эналаприл, фозиноприл, периндоприл, квинаприл, рамиприл, зофеноприл
|
|
По продолжительности действия
|
|
ЛС с короткой продолжительностью действия
|
каптоприл – 3 р/сут
|
|
ЛС со средней продолжительностью действия
|
эналаприл 2 р/сут
|
|
ЛС длительного действия
|
лизиноприл, фозиноприл, периндоприл, рамиприл, квинаприл, зофеноприл – 1 раз в сутки
|
|
В зависимости от особенностей метаболизма и путей элиминации выделяют три класса иАПФ (Opie L., 1992)
|
|
Класс I – липофильные лекарства, неактивные метаболиты которых имеют
печеночный путь выведения
|
каптоприл
|
|
Класс II – липофильные пролекарства
|
|
Подкласс IIА – препараты, активные метаболиты которых выводятся
преимущественно через почки
|
квинаприл, эналаприл, периндоприл и др.
|
|
Подкласс IIВ – препараты, активные метаболиты которых имеют печеночный
и почечный пути элиминации
|
фозиноприл, моэксиприл, рамиприл, трандолаприл
|
|
Класс III – гидрофильные лекарства, не метаболизируются в организме и выводятся почками в неизмененном виде
|
лизиноприл
|
Механизм действия лизиноприла обусловлен ингибированием ангиотензинпревращающего фермента (АПФ) и, соответственно, блокадой основных эффектов ренин-ангиотензин-альдостероновой, а также калликреин-кининовой систем (рис. 1, 2).
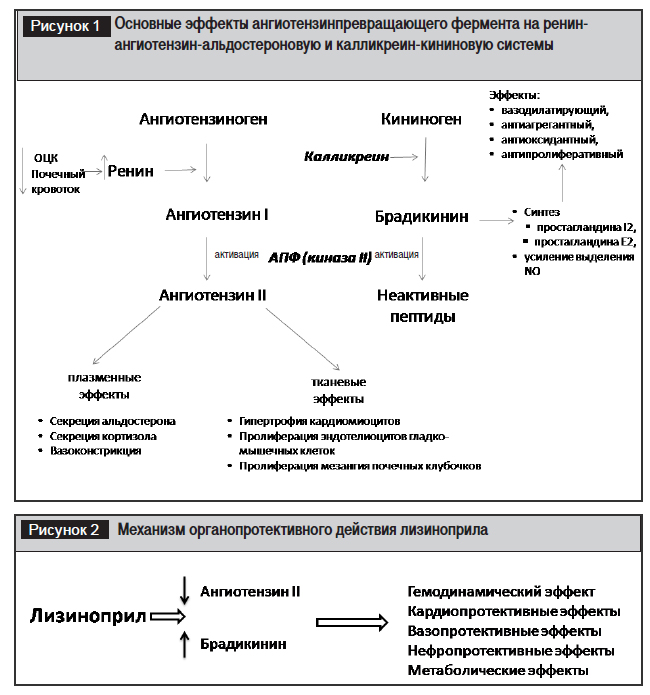
Таким образом, механизм действия лизиноприла рассматривается с двух позиций.
Блокада влияния циркулирующего ангиотензина II обеспечивает быструю системную вазодилатацию и оказывает диуретический эффект, что способствует снижению АД, уменьшению одышки и утомляемости при ХСН. Блокада тканевой активности ангиотензина II, снижение активности симпатической нервной системы, ингибирование действия альдостерона, а также предотвращение инактивации брадикикина позволяют реализовать долговременные органопротекторные эффекты препарата, но для этого требуется его длительное применение.
Основные гемодинамические эффекты лизиноприла заключаются в периферической вазодилатации (снижение пред- и постнагрузки на миокард), снижении общего периферического сопротивления сосудов и системного АД, улучшении ре-гионарного кровотока. Следует отметить, что при применении лизиноприла, в отличие от других вазодилататоров, не развивается рефлекторная тахикардия. После физической нагрузки или изменения положения тела частота сердечных сокращений не нарушается [26].
Кардиопротекторное действие: регрессия гипертрофии миокарда левого желудочка, замедление процессов ремоделирования сердца, антиишемическое и антиаритмическое действие [41, 43, 47].
Ангиопротекторное действие: усиление эндотелийзависимой вазодилатации, торможение пролиферации гладкой мускулатуры артерий, цитопротекторное действие, антитромбоцитарный эффект.
Нефропротекторное действие: увеличение натрийуреза и уменьшение калийуреза, снижение внутриклубочкового давления, торможение пролиферации и гипертрофии мезангиальных клеток, эпителиальных клеток почечных канальцев и фибробластов. Лизиноприл, как типичный представитель группы ингибиторов АПФ, превосходит другие группы антигипертензивных средств по нефропротекторной активности, которая, по крайней мере частично, не зависит от его антигипертензивного эффекта [34].
Нейрогуморальные эффекты: снижение активности РААС (снижение уровня ангиотензина II, альдостерона) снижение активности САС (снижение уровня нор-адреналина, вазопрессина); повышение активности калликреин-кининовой системы (повышение уровня кининов и простагландинов I2 и E2); повышение высвобождения оксида азота; повышение уровня предсердного натрийуретического пептида; уменьшение секреции эндотелина-I; повышение фибринолитической активности за счет увеличения высвобождения тканевого активатора плазминогена и уменьшения синтеза ингибитора тканевого активатора плазминогена I типа [1, 47].
Метаболические эффекты: повышение чувствительности периферических тканей к действию инсулина, антиатерогенный, противовоспалительный [21, 27, 29, 36, 38, 39, 42, 44].
Лизиноприл обладает пролонгированным действием и принимается один раз в день. Прием пищи не влияет на биодоступность. Препарат поступает в организм в виде активного вещества и не нуждается в гидролизе в ЖКТ, в отличие от других представителей группы (за исключением каптоприла) (табл. 2).
Таблица 2. Основные фармакокинетические характеристики иАПФ
|
ЛС
|
Биодоступность, %
|
Биологическая активность
|
Пути
выведения
|
Влияние пищи
на биодоступность
|
Связь
с белками плазмы, %
|
|
Каптоприл
|
75–90
|
Активное
средство
|
Печень 10%,
почки 90%
|
Уменьшает
|
25–30
|
|
Эналаприл
|
40
|
Пролекарство
|
Печень 10%, почки 90%
|
Не влияет
|
50
|
|
Лизиноприл
|
6–60
|
Активное
средство
|
Почки 100%
|
Не влияет
|
5
|
|
Периндоприл
|
65–95
|
Пролекарство
|
Печень 10%, почки 90%
|
Не влияет
|
20
|
|
Рамиприл
|
55–65
|
Пролекарство
|
Печень 40%, почки 60%
|
Не влияет
|
73
|
|
Фозиноприл
|
32
|
Пролекарство
|
Печень 50%, почки 50%
|
Не влияет
|
95
|
|
Квинаприл
|
60
|
Пролекарство
|
Почки, примерно 100%
|
Не влияет
|
97
|
|
Зофеноприл
|
100
|
Пролекарство
|
Печень 26%, почки 69%
|
Не влияет
|
88
|
Лизиноприл не связывается с другими белками сыворотки крови, что позволяет избежать лекарственных взаимодействий на этом уровне и риска передозировки у пациентов с гипоальбуминемией [2, 4]. Лизиноприл – гидрофильный иАПФ, не распределяющийся в жировой ткани. Это свойство позволяет считать его препаратом первого выбора у тучных пациентов с артериальной гипертензией [2, 6].
Лизиноприл полностью выводится почками и, невзирая на то что, как и другие иАПФ, обладает нефропротективным действием, – необходима коррекция его дозы у пациентов со снижением клиренса креатинина (КК) (табл. 3).
Таблица 3. Дозы лизиноприла и их коррекция у пациентов со снижением клиренса креатинина [2]
|
Клиренс
креатинина, мл/мин
|
Начальная доза, мг/сут
|
|
31–80
|
5–10&
|
|
10–30
|
2,5–5
|
|
< 10 (включая пациентов на диализе)*
|
2,5#
|
П р и м е ч а н и е : # – прием лизиноприла может быть прекращен на время проведения диализа; * – доза и частота приема определяется по параметрам снижения артериального давления; & – максимальная доза лизиноприла составляет 40 мг/сут.
Лизиноприл, наряду с каптоприлом и эналаприлом, является одним из самых исследованных в клинических испытаниях препаратов (табл. 4).
Таблица 4. Результаты запроса в базе данных MEDLINE о клинических испытаниях ИАПФ (для отдельных препаратов и для прямых сравнений препаратов между собой)
|
Запрос
|
Число ссылок
|
|
Captopril Clinical Trial
|
1686
|
|
Enalapril Clinical Trial
|
2058
|
|
Lisinopril Clinical Trial
|
663
|
|
Fosinopril Clinical Trial
|
170
|
|
Perindopril Clinical Trial
|
531
|
|
Quinapril Clinical Trial
|
237
|
|
Ramipril Clinical Trial
|
586
|
|
Zofenopril Clinical Trial
|
36
|
|
Lisinopril Captopril Clinical Trial
|
58
|
|
Lisinopri Enalapril Clinical Trial
|
156
|
|
Lisinopril Fosinopril Clinical Trial
|
3
|
|
Lisinopril Perindopril Clinical Trial
|
3
|
|
Lisinopril Quinapril Clinical Trial
|
9
|
|
Lisinopril Ramipril Clinical Trial
|
3
|
|
Enalapril Captopril Clinical Trial
|
221
|
|
Captopril Fosinopril Clinical Trial
|
9
|
|
Enalapril Fosinopril Clinical Trial
|
13
|
|
Enalapril Perindopril Clinical Trial
|
40
|
|
Enalapril Quinapril Clinical Trial
|
28
|
|
Enalapril Ramipril Clinical Trial
|
26
|
|
Enalapril Zofenopril Clinical Trial
|
5
|
Но если фармакокинетические параметры каптоприла и эналаприла (назначение 3 или 2 раза в день) делают их недостаточно привлекательными для длительного применения, то лизиноприл, назначаемый один раз в сутки, является, таким образом, самым исследованным из препаратов длительного действия. Прямые сравнения иАПФ между собой немногочисленны. Наибольшее их количество также связано с тремя препаратами: каптоприл, эналаприл, лизиноприл.
Лизиноприл включен в клинические протоколы Республики Беларусь по лечению сердечно-сосудистых заболеваний:
·?Клинический протокол диагностики и лечения заболеваний, характеризующихся повышенным кровяным давлением [11]
·?Клинический протокол диагностики и лечения инфаркта миокарда, нестабильной стенокардии [12] (в данном протоколе имеется уточняющее указание о предпочтительном использовании лизиноприла у пациентов с печеночной недостаточностью).
·?Клинические протоколы диагностики и лечения взрослого населения с заболеваниями эндокринной системы при оказании медицинской помощи в амбулаторных условиях [10] (лизиноприл входит в схемы коррекции артериальной гипертензии у пациентов с СД и для профилактики прогрессирования диабетической нефропатии).
Национальные рекомендации диагностики, лечения и профилактики артериальной гипертензии рекомендуют использование лизиноприла при сочетании АГ с ХСН, дисфункцией ЛЖ, после ИМ, с диабетической нефропатией, нефропатией, не связанной с СД, гипертрофией миокарда левого желудочка, каротидным атеросклерозом, протеинурией/микроальбуминурией, фибрилляцией предсердий, метаболическим синдромом [11].
Клиническая эффективность и безопасность лизиноприла изучена во многих крупных клинических испытаниях.
В базе данных PUBMED представлено 485 публикаций, связанных с клиническими исследованиями лизиноприла при АГ; 121 – при сердечной недостаточности, 102 – при СД, 87 – при нефропатии.
Прием лизиноприла приводит к стойкому снижению артериального давления (систолического – в среднем на 13% (24,46–3,14), диастолического – на 6% (11,7–0,28)) без сопутствующей тахикардии у 50–80% пациентов с АГ [28]. Крупные хорошо организованные клинические испытания (ALLHAT, TROPHY, STOP-2, HOT и др.) продемонстрировали тот факт, что лизиноприл не уступает по эффективности другим ингибиторам АПФ, в том числе эналаприлу [23], тиазидным диуретикам (гидрохлоротиазид), бета-адреноблокаторам (метопролол, небиволол) [28, 41], антагонистам кальция (амлодипин, верапамил ретард, нифедипин ретард, фелодипин ретард), БРА (телмисартан [45], валсартан [31]).
В исследовании ALLHAT [22] оценивалась смертность от ИБС и частота инфарктов миокарда у пациентов старше 55 лет, страдающих АГ и получавших хлорталидон в дозе 12,5–25 мг (15255 больных), амлодипин в дозе 2,5–10 мг (9048 больных), доксазозин (9061 больной) и лизиноприл в дозе 10–40 мг в сутки (9054 пациента). Если целевого уровня АД достигнуть не удавалось, добавляли второй препарат (атенолол 25–100 мг, резерпин 0,05–0,2 мг однократно в сутки или клонидин 0,1–0,3 мг два раза в сутки). Третьим препаратом был гидралазин (25–100 мг два раза в сутки). Исследование в группе доксазозина было остановлено уже через 3,2 года после начала лечения в связи с достоверным повышением риска сердечно-сосудистых осложнений. По способности предотвращать наступление первичной комбинированной конечной точки (инфаркт миокарда и сердечно-сосудистая смерть) не было показано преимуществ ни одного из этих трех лекарственных препаратов. Лизиноприл оказался значительно эффективнее амлодипина в отношении профилактики развития сердечной недостаточности. Следует также отметить, что лизиноприл эффективно предотвращал возникновение новых случаев СД 2 типа [18]. Частота новых случаев СД через 2 года терапии оказалась почти в 2 раза выше в группе хлорталидона [13].
Клиническое исследование SAMPLE продемонстрировало способность лизиноприла уменьшать гипертрофию левого желудочка. Индекс массы миокарда ЛЖ уменьшался на 15,8% при лечении лизиноприлом в дозе 20 мг в сутки [32]. Лизиноприл улучшал систолическую и диастолическую функции ЛЖ [40]. В исследовании ELVERA было обнаружено достоверное уменьшение индекса массы миокарда при назначении лизиноприла у пожилых больных АГ [46].
Целый ряд крупных клинических испытаний проведен для изучения эффективности лизиноприла у пациентов с СД. В многоцентровом плацебо-контролируемом исследовании EUCLID было изучено влияние лизиноприла на развитие и прогрессирование диабетической нефропатии и ретинопатии у 530 больных СД 2 типа без АГ [25]. Через 2 года уровень микроальбуминурии в группе лизиноприла оказался на 18,8% ниже по сравнению с группой плацебо. Особенно выраженным был эффект лизиноприла у больных с микроальбуминурией в начале исследования: у них снижение экскреции альбумина с мочой составило 49,7%, в то время как у пациентов с исходной нормоальбуминурией снижение экскреции альбумина с мочой по сравнению с плацебо составило 12,7%. Кроме того, в группе лизиноприла было выявлено снижение риска прогрессирования диабетической ретинопатии на 50% по сравнению с группой плацебо. При этом максимальный протективный эффект лизиноприла в отношении развития и прогрессирования диабетической ретинопатии был отмечен у пациентов с компенсированным СД (при уровне гликированного гемоглобина < 7%).
Еще в одном крупном исследовании (3463 больных СД 2-го типа с диабетической нефропатией и АГ) через 3 месяца после назначения лизиноприла помимо снижения АД было отмечено улучшение азотвыделительной функции (почти у 50% больных с исходно повышенным уровнем креатинина этот показатель достоверно снизился). Также было отмечено положительное влияние лизиноприла на уровень гликированного гемоглобина и липиды крови. Лизиноприл очень хорошо переносился: побочные эффекты были выявлены всего у 2,2% пациентов [37].
Крупное исследование 2014 года, включающее 486 пациентов с поликистозом почек и III стадией хронической болезни почек продемонстрировало эффективность лизиноприла в виде монотерапии у данной категории пациентов [49]. Поскольку элиминация лизиноприла осуществляется через почки, у пациентов с почечной недостаточностью начальная доза зависит от показателей КК. Поддерживающую дозу устанавливают в зависимости от клинической реакции и подбирают при регулярном измерении показателей функции почек, концентрации калия и натрия в крови (см. табл. 2).
Назначение лизиноприла показано в острый период инфаркта миокарда при условии стабильной гемодинамики, для лечения в течение первых 24 часов для предотвращения последующего нарушения функции левого желудочка и развития сердечной недостаточности, а также для повышения выживаемости [2]. В исследовании GISSI-3, включавшем более 19000 больных, было показано, что прием лизиноприла (5–10 мг), начинавшийся с первых суток ОИМ (при стабильной гемодинамике) и продолжавшийся в течение 6 недель, привел к достоверному снижению общей смертности и существенному улучшению функции левого желудочка [27]. Наиболее эффективным применение лизиноприла было у больных с сопутствующим СД, у них смертность снизилась в среднем на 32%. Снижение шестинедельной смертности при лечении лизиноприлом составило в среднем 27% у больных СД 1 типа и 44% у больных СД 2 типа.
В отношении лечения стабильных форм ишемической болезни сердца (ИБС) показательно клиническое исследование COURAGE, продемонстрировавшее преимущества консервативной стратегии лечения перед чрескожным коронарным вмешательством. Оптимальная медикаментозная терапия, применяемая в данном исследовании, в числе прочих включала иАПФ лизиноприл [13, 30].
Самые ранние клинические испытания лизиноприла показали преимущества его назначения при ХСН [24]. Эффективность лизиноприла при ХСН была доказана в двойном слепом рандомизированном исследовании ATLAS [35]. В это исследование были включены 3164 больных сердечной недостаточностью II–IV функционального класса по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA) с фракцией выброса ниже 30%. Больные получали лизиноприл в низких (2,5–5 мг/сут) и высоких дозах (32,5–35 мг/сут). Длительность наблюдения составила 39–58 мес. Было показано, что даже при назначении в небольших дозах (а из-за склонности к гипотонии далеко не всегда удается применять рекомендованные дозы) иАПФ позволяют добиться улучшения прогноза при этом тяжелом заболевании. Достоверных различий в общей смертности между группами больных, получавшими высокие или низкие дозы лизиноприла, отмечено не было. Клиническое улучшение также было примерно одинаковым. Однако в группе больных, получавших лизиноприл в высоких дозах, достоверно ниже оказался риск смерти и госпитализации из-за сердечно-сосудистых причин (на 9%, р=0,027), риск госпитализации в связи с декомпенсацией ХСН снизился на 24%, что означает необходимость достижения по возможности более высоких доз иАПФ. Важно подчеркнуть, что частота побочных эффектов в группе низких и высоких доз лизиноприла оказалась сопоставимой.
Ряд фармакокинетических характеристик лизиноприла (выведение почками и отсутствие необходимости в метаболизме в печени для образования активного вещества) делают его препаратом выбора у пациентов с заболеваниями печени. Это особенно актуально на фоне как роста вирусных заболеваний печени (хронические гепатиты), так и значительного количества пациентов с невирусной патологией (стеатогепатоз и др.). Н.Ф. Шустваль и соавт. изучали сравнительную эффективность и переносимость лизиноприла (Диротона, ОАО «Гедеон Рихтер») и эналаприла у пациентов с АГ 1-й и 2-й степени и сопутствующим хроническим вирусным гепатитом [15]. Оба препарата примерно одинаково снижали АД, снижали периферическое сосудистое сопротивление, улучшали эластичность сосудов, однако лизиноприл достоверно чаще снижал уровень трансаминаз и билирубина по сравнению с эналаприлом, на основании чего авторы сделали вывод о более выраженном гепатопротективном действии лизиноприла.
В России также есть опыт применения лизиноприла (Диротона) у больных с АГ и сопутствующим заболеванием печени [7, 13]. Л.Б. Лазебник с соавт. после изучения эффективности Диротона у пациентов с АГ и сопутствующей различной патологией органов пищеварения (стеатозом, циррозом печени, язвенной болезнью 12-перстной кишки) сделали вывод, что эффективность Диротона не зависит от выраженности изменений печени у пациентов с АГ [52, 13].
В Беларуси Диротон зарегистрирован в 1997 г., и уже накоплен большой клинический опыт, подтверждающий эффективность его применения у пациентов с сердечно-сосудистыми заболеваниями.
При применении лизиноприла, как и других представителей группы иАПФ, возможен ряд потенциально предсказуемых побочных реакций, развивающихся с разной вероятностью. Закономерным и предсказуемым побочным эффектом является гипотония, обусловленная устранением сосудосуживающего эффекта ангиотензина II, особенно у пациентов с сопутствующей диуретической терапией. Сухой кашель развивается у 2–10% больных [20, 50, 51]. Он может быть следствием увеличения уровней брадикинина легочной ткани.
Гиперкалиемия, связанная со снижением секреции альдостерона, редко встречается у пациентов с нормальной функцией почек, но достаточно часто развивается при застойной сердечной недостаточности и у пожилых людей [1, 48].
Ингибиторы АПФ могут вызвать повышение уровней азота мочевины и креатинина крови. У большинства пациентов концентрация креатинина остается стабильной или снижается до исходных значений при продолжении терапии. Острая почечная недостаточность чаще развивается на фоне лечения диуретиками в высоких дозах, при наличии гипонатриемии, двустороннего стеноза почечных артерий, стеноза преобладающей почечной артерии, одной почки и после трансплантации почки. При этих состояниях повышается секреция ренина и уровень ангиотензина II, который вызывает селективное сужение эфферентной артериолы клубочков и поддерживает СКФ. Ингибиторы АПФ снижают уровень ангиотензина II, расширяют эфферентные артериолы и снижают клубочковую фильтрацию, что приводит к росту уровня креатинина. Риск острой почечной недостаточности при лечении ингибиторами АПФ особенно высокий у пожилых пациентов с застойной сердечной недостаточностью. После отмены ингибиторов АПФ функция почек фактически у всех пациентов восстанавливается [8, 52].
Ангионевротический отек – это редкий побочный эффект, однако он может создавать угрозу для жизни. Симптомы его варьируют от легких желудочно-кишечных нарушений (тошнота, рвота, диарея, колики) до тяжелой одышки, связанной с отеком гортани, и смерти. Ангионевротический отек чаще возникает в течение первого месяца терапии, а также у афроамериканцев. Проявления исчезают в течение нескольких часов после отмены ингибитора АПФ [3, 17, 19, 33]. Причиной ангионевротического отека считают накопление брадикинина и его метаболита – десаргининбрадикинина и ингибирование инактиватора эстеразы комплемента-1.
Все представители группы иАПФ относятся к категории D (FDA) применения препаратов в период беременности и не должны назначаться беременным женщинам. Женщин детородного возраста, которым назначается лизиноприл, необходимо предупредить о необходимости контрацепции и немедленной отмене препаратов в случае возникновения беременности.
Переносимость иАПФ у большинства пациентов хорошая. Об этом свидетельствует и то, что ЛС, влияющие на систему ренин – ангиотензин, занимают третье место в ТОП-10 анатомо-терапевтических групп на фармацевтическом рынке Республики Беларусь в целом и второе место в розничном секторе [14]. Наиболее популярным представителем группы в ТОП-10 МНН на фармацевтическом рынке 2014 г. был лизиноприл: девятая позиция среди препаратов в целом и третья – в розничном секторе.
Фармакокинетические особенности лизиноприла (гидрофильность, отсутствие связи с белками плазмы) способствуют предсказуемости терапевтического эффекта в назначенной дозе. Лизиноприл является не пролекарством, в отличие от прочих представителей иАПФ (за исключением каптоприла), а изначально активным гидрофильным лекарственным средством. Препарат выводится из организма в неизмененном виде через почки. Печень в процессах метаболизма, инактивации и выведения лизиноприла не участвует.
Таким образом, иАПФ – наиболее значимый класс лекарственных средств в лечении пациентов с АГ, СН, СД, нефропатией, ИБС. Лизиноприл – один из самых исследованных в клинических испытаниях препаратов. Он обладает отличными фармакокинетическими характеристиками: отсутствие метаболизма в печени, гидрофильность, отсутствие влияния пищи на всасывание, выведение почками. В определенных клинических ситуациях лизиноприл можно считать препаратом первого выбора. Лизиноприл предпочтителен у пациентов с нарушением жирового обмена, заболеваниями печени, а также у лиц, уже принимающих потенциально гепатотоксичные или изменяющие метаболизм печеночных ферментов препараты. Таким образом, лизиноприл, благодаря своим уникальным свойствам, по праву остается лидером среди иАПФ длительного действия.
Л И Т Е Р А Т У Р А
1. Артериальная гипертензия и высокий риск сердечно-сосудистых осложнений: фокус на лизиноприл [Электрон. ресурс] / А.Г.Евдокимова [и др.] // Трудный пациент. – 2010. – №11. – Режим доступа: http://www.t-pacient.ru/ archive/tp11-10/ tp11-10_709.html
2. Диротон. Инструкция по применению лекарственного средства для специалистов. Приказ Министерства здравоохранения Республики Беларусь №128 от 06.02.2012.
3. Заключение экспертов Европейского Общества Кардиологов по применению ингибиторов ангиотензинпревращающего фермента при сердечно-сосудистых заболеваниях. Рабочая группа по ингибиторам АПФ Европейского общества кардиологов (J.Lopez-Sendon и др.) // Рациональная фармакотерапия в кардиологии. – 2005. – №1. – С.49–69.
4. Клиническая фармакокинетика. Практика дозирования лекарств / Ю.Б.Белоусов, К.Г.Гуревич – М., 2005. – 288 с.
5. Лазебник Л.Б., Михеева О.М., Комиссаренко И.А. // Лечащий Врач. – 2012. – №7.
6. Маколкин В.И. // РМЖ. – 2005. – №26. – С.1721–1727.
7. Михеева О.М., Комиссаренко И.А., Дроздов В.Н. и др. // Consilium medicum. – 2007. – №9 (11). – С.72–76.
8. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр) // Сердечная недостаточность. – 2013. – Т.14, №7 (81). – С.379–472.
9. Национальные рекомендации. Диагностика, лечение и профилактика артериальной гипертензии. – Минск, 2010. – 52 с.
10. Приказ Министерства здравоохранения Республики Беларусь от 02.07.2013 №764.
11. Приложение №1 к Постановлению Министерства здравоохранения Республики Беларусь 30 декабря 2014 г. №117.
12. Приложение №2 к Постановлению Министерства здравоохранения Республики Беларусь 30 декабря 2014 г. №117.
13. Роль ингибиторов ангиотензинпревращающего фермента в лечении артериальной гипертензии: фокус на лизиноприл / Г.А.Барышникова, И.И.Степанова, Н.В.Чупрова // Лечащий врач. – 2013. – №2. Электрон. ресурс: http://www.lvrach.ru/ 2013/02/15435617/
14. Фармацевтический рынок Республики Беларусь. Электрон. доступ: www.intellix.by/ pdf/2014_Intellix.pdf
15. Шустваль Н.Ф., Малый В.П., Пеньков Д.Б. // Укр. мед. журн. – 2004. – №1 (39). – С.45–50.
16. Ahuja T.S., Freeman D., Mahnken J.D. et al. // Am. J. Nephrot. – 2000. – Vol.20. – P.268–272.
17. Baram M., Kommuri A., Sellers S.A., Cohn J.R. // J. Allergy Clin. Immunol. Pract. – 2013. – Vol.1(5). – P.442–445. doi: 10.1016/j.jaip.2013.07.005.
18. Black H., Davis B. // J. Hypertens. – 2005. – Vol.23 (Suppl.2). – S.146.
19. Brown N., Ray W., Snowden M. et al. // Clin. Pharmacol. Ther. – 1996. – Vol.60. – P.8–13.
20. Charton V., Dotlow S., Fidel J. et al. // J. Clin. Pharmacol. – 1995. – Vol.39. – P.125–129.
21. Cunha V., Tham D.M., Martin McNulty et al. // Atherosclerosis. – 2005. –Vol.178. – P.9–17
22. Davis B.R., Culter J.A., Gordon D.J. // Am. J. Hypertens. – 1996. –Vol.9. – P.342–360.
23. Diamant M., Vincent H. H. // J. Hum. Hypertens. – 1999. – Vol.13 (6). – P.405–412.
24. Dickstein K., Aarsland T., Woie L. et al. // Am. Heart J. – 1986. – Vol.112 (1). – P.121–129.
25. EUCLID Study Group. / Effect of lisinopril on progression of retinopathy in normotensive people with type 1 diabetes // Lancet. – 1998. – Vol.351. – P.28–31.
26. Giannettasio C, Grassi G, Seravalle G et al. // Am. Heart J. – 1989. – Vol.117. – P.740–745.
27. GISSI-3: effects of lisinopril and transdermal glyceryltrinitrate singly and together on 6week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico // Lancet. – 1994. – Vol.343 (8906). – P.1115–1122.
28. Heran B.S., Wong M.M.Y., Heran I.K., Wright J.M. // Blood pressure lowering ef?cacy of angiotensin converting enzyme (ACE) inhibitors for primary hypertension. Cochrane Database of Systematic Reviews. – 2008, Issue 4. Art. No: CD003823. DOI. –10.1002/14651858.CD003823.pub2.
29. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58050 patients with suspected acute myocardial infarction. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group // Lancet. – 1995. – Vol.345 (8951). – P.669–685
30. Kereiakes D.J., Teirstein P.S., Sarembock I.J. et al. // J. Am. Coll. Cardiol. – 2007. – Vol.50 (16). – P.1598–1603.
31. Malacco E., Santonastaso M., Vari N.A. et al. // Clin. Ther. – 2004. – Vol.26 (6). – P.855–865.
32. Mancia G., Zanchetti A., Agabiti-Rosei E. et al. // Circulation. – 1997. – Vol.95 (6). – P.1464–1470.
33. Nikpoor B.I., Duan Q.L., Rouleau G.A. // Expert Opin. Pharmacother. – 2005. – Vol.6(11). – P.1851–1856.
34. Opie L.H. Angiotensin converting enzyme inhibitors. – 3rd ed. – New York, 1999.
35. Packer M., Poole-Wilson P.A., Armstrong P.W. et al. // Circulation. – 1999. – Vol.100 (23). – P.2312–2318.
36. Paolisso G.I., Gambardella A., Verza M. et al. // J. Hum. Hypertens. – 1992. – Vol.6 (3). – P.175–179.
37. Parving H. H. // J. Diabetes Complications. – 1996. – Vol.10 (3). – P.133–135.
38. Pfeffer M.A., Braunwald E., Moye L.A. et al. // N. Engl. J. Med. – 1992. – Vol.327 (10). – P.669–677.
39. Raimondo D., Tuttolomondo A., Butta C. et al. // Curr. Pharm. Des. – 2012. – Vol.18. – P.4385–4413.
40. Rizzoni D., Muiesan M. L., Porteri E. et al. // J. Hypertension. –1997. – Vol.15. – P.197–204.
41. Schiffrin E., Deng L. // Hypertension. – 1995. – Vol.25. – P.699–703.
42. Schmeisser A., Soehnlein O., Illmer T. et al. // Biochem. Biophys. Res. Commun. – 2004. – Vol.325. – P.532–540.
43. Schmieder R.E., Martus P., Klingbeil A. // JAMA. – 1996. – Vol.275. – P.1507–1513.
44. Soehnlein O., Schmeisser A., Cicha I. et al. // J. Vasc. Res. – 2005. – Vol.42. – P.399–407.
45. Stergiou G.S., Efstathiou S.P., Roussias L.G. et. al. // J. Cardiovasc. Pharmacol. – 2003. –Vol.42 (4). – P.491–496.
46. Terpstra W.F., May J.F., Smit A.J. et al. // J. Hypertens. – 2001. – Vol.19 (2). – P.303–309.
47. Thadei S., Virdis A., Ghiadoni L. et al. // J. Hypertens. – 1998. – Vol.16. – P.447–456.
48. The RALES investigators. Effectiveness of spironolactone added to an angiotensin-converting enzyme inhibitor and a loop diuretic for severe chronic congestive heart failure. (The randomized aldactone evaluation study: RALES) // Am. J. Cardioi. – 1996. – Vol.78. – P.902–907.
49. Torres V.E., Abebe K.Z., Chapman A.B. et al. // N. Engl. J. Med. – 2014. – Vol.371 (24). – P.2267–2276.
50. Visser L.E., Stricker B.H., van der Velden J. et al. // J. Clin. Epidemic. – 1995. – Vol.48. – P.851–857.
51. Wood R. // J. Clin. Pharmacol. – 1995. – Vol.39. – P.265–270.
52. Wynckel A., Ebikili B., Melin J.-P. et al. // Am.J. Hypertens. – 1998. – Vol.11. – P.1080–1086.
Международные обзоры: клиническая практика и здоровье. – 2016. – №1. – С. 44-57.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.