Yankouskaya L.V.
Grodno State Medical University, Belarus
Place of tizanidine in treatment of patients with chronic non-cancer pain
Резюме. Определено место адъювантов в комплексной терапии боли и обобщен опыт применения миорелаксанта центрального действия тизанидина в лечении пациентов с хронической неонкологической болью.
Ключевые слова: хроническая боль, лечение, миорелаксанты, тизанидин.
Медицинские новости. – 2015. – №7. – С. 31–33.
Resume. The aim of the present publication was to identify the place of the adjuvants in treatment of a pain and summarize the experience of using the centrally acting muscle relaxant tizanidine in patients with chronic non-cancer pain.
Keywords: chronic pain, treatment, muscle relaxants, tizanidine.
Meditsinskie novosti. – 2015. – N7. – P. 31–33.
Частота встречаемости хронического болевого синдрома, по данным эпидемиологических исследований, в странах Западной Европы составляет 20% среди взрослого населения. На фоне роста обращаемости населения к врачам первичного звена системы оказания медицинской помощи с жалобами на хронический болевой синдром различной локализации (боли при заболеваниях суставов, боли в спине, головные боли, невропатические боли и другие) у 40% пациентов противоболевая терапия не приносила желаемого обезболивания, а каждый третий считал, что врач не знает, как вылечить боль [7]. Ответной реакцией здравоохранения на растущую проблему терапии боли было создание специализированных противоболевых центров и клиник во многих странах мира. Хроническую боль стали рассматривать не как симптом какого-либо заболевания, а как самостоятельную болезнь, требующую комплексного лечения, поскольку при наличии хронического неонкологического болевого синдрома часто теряется прямая связь с органической патологией. Врачи столкнулись с ситуацией, при которой идентификация и устранение повреждения не сопровождались исчезновением болевого синдрома [17, 18].
В Республике Беларусь с целью улучшения оказания помощи пациентам с хронической неонкологической болью постановлением Министерства здравоохранения РБ 17.10.2014 г. приказом №1070 был утвержден «Клинический протокол диагностики и лечения пациентов с хронической неонкологической болью при оказании медицинской помощи в амбулаторных и стационарных условиях районных, областных и республиканских организаций здравоохранения» [21]. Клинический протокол определяет критерии выбора фармакотерапевтических групп и конкретных лекарственных средств для устранения хронической неонкологической боли, режимы их дозирования, продолжительность применения, критерии оценки эффективности и безопасности, меры профилактики и коррекции нежелательных реакций лекарственных средств.
Согласно определению экспертов Международной ассоциации по изучению боли, к хронической относят боль длительностью более 3 месяцев и продолжающуюся после нормального заживления тканей [14, 20]. Среди заболеваний, сопровождающихся хроническим болевым синдромом, пальму первенства имеют заболевания опорно-двигательного аппарата, среди которых хроническая боль в области спины, или дорсопатия, занимает лидирующее положение и встречается с частотой от 19 до 70% в разных возрастных группах. Особо стоит подчеркнуть высокую распространенность дорсопатии (до 67%) среди лиц в возрасте 35–45 лет [10, 6], что ставит эту причину на второе место после респираторных заболеваний по частоте обращаемости к врачу. При этом основной причиной боли в спине являются симптомы натяжения или напряжения мышц поясничного отдела позвоночника (70%), что объясняет высокую эффективность добавления миорелаксантов в комплекcную терапию боли данной локализации.
И в показаниях к применению мио-релаксанта тизанидина («Тизалуда») болезненный мышечный спазм, связанный со статическими и функциональными заболеваниями позвоночника (шейный и поясничный синдромы), стоит на первом месте. В то время как дегенеративные изменения (10%), пролапс (4%), остеопоретические деформации тел позвонков (4%), стеноз позвоночного канала (3%), спондилолистез (2%), спондилолиз (2%), травматические переломы (1%), врожденные заболевания (1%), рак (0,7%), инфекции (0,01%) составляют оставшиеся 30% и, как правило, не требуют применения миорелаксантов.
Оценка интенсивности болевого синдрома. У лиц с хронической неонкологической болью в большинстве случаев имеет место смешанный патофизиологический (ноцицептивный, нейропатический, психогенный) механизм возникновения боли. При первичном осмотре пациента врач должен оценить характер боли путем тщательного сбора анамнеза, физикального обследования, оценки психологического статуса. Особо следует подчеркнуть необходимость оценки интенсивности болевого синдрома. Наиболее простым, дешевым и доступным способом служит использование визуальной аналоговой шкалы (ВАШ). ВАШ представляет собой линейку, градуированную слева направо. На стороне линейки, обращенной к врачу, имеется градуировка от 0 до 10, позволяющая количественно оценить интенсивность болевого синдрома при первичном осмотре и в динамике, после назначения терапии: от отметки 0 – «нет боли» до 10 (баллов) – «невыносимая боль». Врач просит пациента показать точку на шкале, соответствующую его болевым ощущениям. Несмотря на то что ВАШ позволяет доступно и просто оценивать интенсивность болевого синдрома в динамике и контролировать эффективность назначенной терапии, врачи первичного звена не часто используют ВАШ в своей ежедневной практике.
Общие принципы лечения хронической неонкологической боли четко изложены в вышеуказанном клиническом протоколе [20], который предусматривает обязательное использование ВАШ как при назначении любого анальгетического средства, при контроле эффективности терапии через сутки, так и для коррекции схемы терапии на третьи, седьмые сутки и далее не реже 1 раза в неделю.
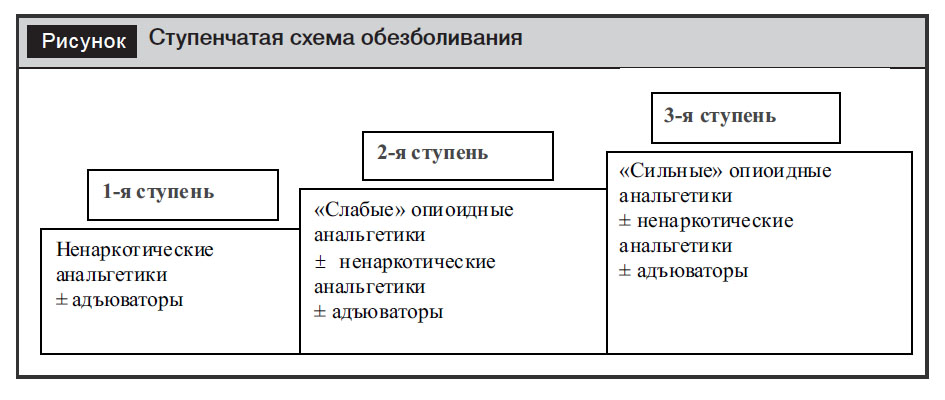
В основе терапии хронической неонкологической боли лежит трехступенчатая схема, предложенная Всемирной организацией здравоохранения в 1986 г., так называемая «лестница обезболивания», получившая интерпретацию в Scoping Document for WHO Treatment Guideline on Non-malignant Pain in Adults, Adoptedin WHO Steering Group on Pain Guidelines (14 October 2008) [21]. «Лестница обезболивания» представлена на рисунке, где 1-я ступень (боли) соответствует 1–3 баллам по ВАШ, 2-я ступень – 2–7 баллов, 3-я ступень – 8–10 баллов.
Аксиома, что лечение следует начинать с парацетамола или других нестероидных противовоспалительных средств (НПВС). Эффективность всех НПВС в средних и высоких терапевтических дозах при длительном применении одинакова (уровень доказательности А). Главным критерием выбора НПВС при назначении пациенту должна быть оценка безопасности лечения с учетом наличия или отсутствия соответствующих факторов риска развития гастроэнтерологических и сердечно-сосудистых осложнений. С другой стороны, большой арсенал НПВС, представленный сегодня в аптечной сети, требует от врача дифференцированного подхода в их назначении, с учетом способа введения, дозы, селективности, обезболивающего действия препаратов. Не рекомендуется назначать два и более НПВС, а следует, как представлено на рисунке, сочетать с адъювантами, которые рекомендованы к применению на всех ступенях обезболивания.
Адъюванты – лекарственные средства, которые сами непосредственно не обладают анальгетическим эффектом, но способны повысить эффективность анальгетиков. К ним относятся антиконвульсанты, антидепрессанты, транквилизаторы, глюкокортикостероиды, нейролептики, седативные средства и миорелаксанты, которые также перечислены в клиническом протоколе диагностики и лечения пациентов с хронической неонкологической болью [21].
Цель настоящей публикации – определить место адъюванта и обобщить опыт применения миорелаксанта центрального действия тизанидина в лечении пациентов с хронической неонкологической болью.
Патогенетическая цепочка «боль – мышечный спазм – боль» в начале формирования болевого синдрома носит компенсаторно-приспособительный характер, формируя через несколько недель собственную альгическую систему замкнутого круга [4, 13]. Это следует помнить врачу при включении миорелаксанта к комплексную терапию обезболивания (НПВС, физиотерапия, мануальная терапия), поскольку устранение рефлекторного мышечного спазма в остром периоде может приводить даже к усилению болевого синдрома.
Механизм действия тизанидина связан со стимуляцией пресинаптических альфа2-рецепторов, что приводит к подавлению высвобождения возбуждающих аминокислот (кислота глутаминовая, кислота аспарагиновая), которые стимулируют рецепторы к N-метил-D-аспартату. Вследствие этого на уровне промежуточных нейронов спинного мозга подавляется полисинаптическая передача возбуждения, что уменьшает возбудимость альфа- и гамма-мотонейронов в спинном мозге и, как следствие, приводит к исчезновению мышечного спазма. Тизанидин оказывает также умеренный центральный анальгезирующий эффект, обусловленный угнетением функции вставочных нейронов задних рогов спинного мозга. Препарат не оказывает влияния на нервно-мышечную передачу, его миорелаксирующий эффект не сопровождается снижением мышечной силы. К немаловажным достоинствам этого препарата следует отнести его гастропротективные свойства, обусловленные его воздействием на альфа2-рецепторы желудка [5].
Позитивный эффект тизанидина в лечении хронической неонкологической боли вертеброгенного характера доказан в ряде законченных клинических исследований [2, 9, 15]. Например, результаты многоцентрового исследования по лечению пациентов с дорсопатиями показывают, что сочетание НПВС ацеклофенака и тизанидина более эффективно и безопасно, чем монотерапия ацеклофенаком [15]. Аналогичными были и результаты польского исследования, показавшего эффективность комбинированной терапии НПВС с тизанидином уже на 2-й день лечения, до полного купирования болевого синдрома через 4 дня (согласно результатам ВАШ), по сравнению с показателями в группе пациентов, принимавших только НПВС, у которых боль купировалась через 7 дней; при этом доза тизанидина была минимальной [9].
Белорусский опыт применения генерического тизанидина «Тизалуда» (Киевский витаминный завод) у пациентов с болями в нижней части спины в дозе 6 мг в сутки показал, что включение препарата в комплексную терапию позволяет эффективно устранить основные симптомы при затянувшемся течении дорсопатии как в качестве монотерапии, так и в комбинации с НПВС [3]. Лечение пациентов с вертеброгенной поясничной патологией (люмбалгией, люмбоишиалгией, радикулопатией) с умеренным и выраженным болевым мышечно-тоническим синдромом указывает на дозозависимое действие данного препарата, с быстрым развитием миорелаксирующего эффекта [1].
Лечение хронического болевого синдрома при центральной невропатической боли, в частности обусловленной травмой спинного мозга, несмотря на значительный прогресс в понимании патофизиологии боли, остается крайне сложной задачей. Комплексная терапия боли включает в себя как нефармакологические методы лечения (физические упражнения, иглоукалывание, интервенционные процедуры, психологическая коррекция), так и медикаментозную терапию. В прошлом для фармакологического лечения хронической боли, обусловленной травмой спинного мозга, было рекомендовало применение НПВС, действие которых объяснялось подавлением воспаления, что способствовало уменьшению боли. Тем не менее опыт показывает, что противовоспалительные препараты более эффективны при лечении скелетно-мышечной, а не хронический центральной боли.
В качестве потенциальной терапии центральной невропатической боли, обусловленной травмой спинного мозга, в настоящее время рекомендованы следующие группы препаратов: опиоиды, антиконвульсанты, трициклические антидепрессанты, анестетики и миорелаксанты. Среди миорелаксантов прежде всего баклофен и тизанидин [11]. Эффективность тизанидина в снижении гипертонуса и спастичности сопоставима с таковой при приеме перорального баклофена, однако тизанидин имеет лучший профиль переносимости и оказывает действие без возникновения мышечной слабости, сопровождающей прием баклофена [19]. Так, в исследовании с участием 47 пациентов, перенесших инсульт, лечение тизанидином достоверно уменьшило спастичность, связанную с болью [8]. Результаты этого и целого ряда других исследований позволили внести в показания к применению тизанидина спастичность скелетных мышц при ряде неврологических заболеваний (рассеянный склероз, хроническая миелопатия, дегенеративные заболевания спинного мозга, нарушения мозгового кровообращения, церебральный паралич).
Отчет о клиническом применении тизанидина в лечении миофасциальной боли жевательных мышц, опубликованный сотрудниками кафедры неврологии университета Пизы (Италия), указывает на значительный положительный эффект терапии тизанидином в дозе 4 мг в день на протяжении 2 недель [12], однако для внесения показаний в инструкцию по применению требуется проведение рандомизированных контролируемых клинических испытаний.
Опыт применения тизанидина 4 мг внутрь в качестве премедикации при проведении абдоминальных операций под общей анестезией показал, что во время операции в группе с использованием тизанидина артериальное давление и частота сердечных сокращений были более стабильными, при этом доза пропофола была меньше, что позволило авторам, учитывая его короткую продолжительность действия, рекомендовать применение тизанидина при премедикации для седации и стабилизации гемодинамики во время операций [16]. В то же время результаты других исследований позволили рекомендовать использование тизанидина после хирургических вмешательств (по поводу грыжи межпозвонкового диска, остеоартроза тазобедренного сустава).
Таким образом, обобщая опыт использования миорелаксанта центрального действия тизанидина, следует отметить эффективность и хорошую переносимость при множестве заболеваний, сопровождающихся хроническим болевым синдромом. Своевременное включение миорелаксанта в качестве адъюванта в трехступенчатую схему обезболивания позволит уменьшить дозу анальгетика и снизить риск развития нежелательных реакций (кардиоваскулярных, гастроинтестинальных, почечных, печеночных) при лечении пациентов с хронической неонкологической болью.
Л И Т Е Р А Т У Р А
1. Дзяк Л.А., Сук В.М., Цуркаленко А.С. // Здоров’я України. – 2009. – вересень. – С.62–63.
2. Парфенов В.А. // Рус. мед. журн. – 2009. – №4. – С. 267–270.
3. Пономарев В.В., Аркинд Г.Д., Щенснович А.Я. // Мед. новости. – 2012. – №1. – С.59–62.
4. Попелянский Я.Ю. Болезни периферической нервной системы. – М.: Медицина, 1989. – 462 с.
5. Ушкалова Е.А. // Consilium-medicum. – 2005. – Т.7, №8.
6. Breen A.C., Carr E., Langworthy J.E. et al. // BMC Musculoskelet Disord. – 2011. – N12. – P.28.
7. Breivik H., Collett B., Ventafridda V. et al. // Eur. J. Pain. – 2006. – Vol.10. – P.287–333.
8. Gelber D.A., Good D.C., Dromerick A. et al. // Stroke. – 2001. – N32(8). – P.1841–1846.
9. Gorska J. // Ortop. Traumatol. Rehabil. – 2005. – N3. – P.306–309.
10. Harms M.C., Peers Ch. E., Chase D. // BMC Musculoskelet. Disord. – 2010. – N11. – P.236.
11. Lee S., Zhao X., Hatch M.et al. // Crit. Rev. Phys. Rehabil. Med. – 2013. – N25 (3-4). – P.159–172.
12. Manfredini D., Romagnoli M., Cantini E. et al. // Minerva Med. – 2004. – N95 (2). – P165–171.
13. Mashford M.L., Collin M.H. Therapeutic GuidelinesAnalgesic. – 4nd ed. – North Melburn: Ther. Guidelines Ltd., 2002.
14. Merskey H., Bogduk N. Association for the Study of Pain, Task Force on Taxonomy. – 2nd ed. – Seattle: IASP Press, 1994. – 222 p.
15. Pareek A., Chandurkar N., Chandanwale A. et al. // Eur. Spine J. – 2009. – N12. – Р.1836–1842.
16. Tabari M., Alipour M., Esalati H. // Iran. Red. Crescent. Med. J. – 2013. – N15 (7). – P.541–546.
17. Tunks E.R., Weir R., Cook J. // The Canadian J. Psychiatry. – 2008. – Vol.53, N4. – P.235–242.
18. Waddell G., Burton A.K. // Occup. Med. – 2001. – Vol. 51, N2. – P.124–135.
19. Wallace J.D. // Neurology. – 1994. – N44 (11), suppl. 9. – S.60–68.
20. http://minzdrav.gov.by/ dadvfiles/000913_767755_1 __kp17_10_20142a.pdf
21. http://www.who.int/medicines/areas/quality_safety/ Scoping_WHO Guide_ non-malignant_pain_adults.pdf
Медицинские новости. – 2015. – №7. – С. 31-33.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.