Voronina L.P.
Belarusian Medical Academy of Post-Graduate Education, Minsk
On the issue of eradication therapy
Резюме. Представлен релиз возможностей и проблем эрадикационной терапии с учетом пересмотров последних Маастрихтских консенсусов (III и IV), согласно принципам доказательной медицины. Обсуждаются вопросы о причинах снижения эффективности эрадикационных схем и их некорректном назначении, растущей резистентности H. pylori к кларитромицину и метронидазолу, снижении комплаентности пациентов к лечению. Для практического врача предложены рекомендации по тактике ведения пациентов с H.pylori и возможности повышения эффективности эрадикационных схем за счет увеличения доз ИПП. Представлена тактика использования в антихеликабактерных схемах пантопразола (контролока), отличающегося выраженной клинической эффективностью, безопасностью и высоким (более 90%) уровнем эрадикации, в том числе у лиц старших возрастных категорий с язвенной болезнью.
Ключевые слова: Маастрихтские консенсусы, H. pylori, ингибиторы протонной помпы (ИПП), эрадикационные схемы, микробная резистентность, язвенная болезнь, пантопразол (контролок).
Медицинские новости. – 2015. – №4. – С. 29–34.
Summary. The release of the opportunities and challenges of eradication therapy is offered, in consideration of last Maastricht consensus (III and IV), according to evidence-based medical principles. The questions about the reasons for reducing the effectiveness of eradication schemes and its incorrect administration the growing resistance of H.pylori to clarithromycin and metronidazole, decreasing patient compliance to treatment were discussed. For the practicing physician recommendations on tactics of patients with H.pylori and opportunities to improve the efficiency of eradication schemes by increasing doses of PPIs were offered. There were offered the tactics of using pantoprazole (Сontroloс) in antihelicobacterial schemes different in pronounced clinical efficacy, safety, and a high percentage of eradication (>90%) inсluding older age categories of people with the peptic ulcer disease.
Keywords: Maastricht consensuses, H. pylori, proton pump inhibitors (PPIs), eradication schemes, microbial resistance, peptic ulcer disease, pantoprazole (Сontroloс).
Meditsinskie novosti. – 2015. – N4. – P. 29–34.
Более тридцати лет прошло с момента открытия этиопатогенетической роли микроорганизма Helicobacter pylory (Н. pylori) в формировании ряда заболеваний желудочно-кишечного тракта (ЖКТ). При этом интерес к вопросам инфекции Н. pylori в мировом медицинском научном сообществе не угасает. Данной проблематике посвящено огромное количество научных работ, освещаемых на ведущих международных и национальных конгрессах [1, 2]. За это время произошло существенное продвижение вперед как в области диагностики, так и в области лечения Н. pylori-ассоциированных заболеваний.
Помимо хронического гастрита и язвенной болезни (ЯБ), значимость инфекции Н. pylori доказана в патогенезе НПВС-гастропатии, MALT-лимфомы и некардиального рака желудка. Широкое распространение этой инфекции во всем мире (распространенность Н. pylori превышает 50% человеческой популяции) и связь с заболеваниями, опасными своими исходами, поставили Н. pylori-ассоциированную инфекцию в ранг социально значимой [3, 4].
В ряде европейских стран, в США, Японии, Австралии методика тестирования микроорганизма и тактика антихеликобактерной терапии широко внедрена в практическое здравоохранение. Тестирование инфекции Н. pylori для лечения ЯБ и функциональной диспепсии, для профилактики НПВС-гастропатии и рака желудка в некоторых странах поддерживается государственными медицинскими программами, рекомендуется проведение внутрисемейной профилактики инфекции Н. pylori, даже несмотря на отсутствие убедительной научной базы. В этих регионах тактика test-and-treat является легитимной, а издержки также покрываются страховыми компаниями. Это позволило существенно снизить уровень микробной инфицированности и заболеваемости Н. pylori-ассоциированными заболеваниями [1, 3, 5, 6].
Однако сегодня можно сказать, что опыт практического применения эрадикационной терапии и результаты сотен клинических исследований однозначно говорят об отсутствии гарантированного 100% успеха вне зависимости от выбранной схемы лечения. Интерес клиницистов к проблеме недостаточной эффективности эрадикационных схем подчеркивается колоссальным числом публикаций, включающим более 100 метаанализов контролируемых исследований по изучению разных аспектов антихеликобактерной терапии. Наибольшее число метаанализов посвящено оценке эффективности схем 1-й линии, традиционно включающих ингибитор протонной помпы (ИПП), кларитромицин и амоксициллин (или метронидазол) [7]. Этот интерес понятен, так как в последние годы эффективность тройной терапии 1-й линии в силу разных причин прогрессивно снижается [8, 9]. Подобная ситуация возникает и с использованием схем 2-й линии эрадикационной терапии, а также альтернативных. Напрашивается вывод, что схем, гарантирующих стабильно максимальный уровень эрадикации микроорганизма, не существует.
Работы ведущих отечественных и зарубежных специалистов показывают, что на эффективность эрадикационной терапии может влиять большой спектр гетерогенных факторов [3, 8–14]. Вот основные из них:
– индивидуальные особенности микроорганизма: резистентность штамма к антибактериальным препаратам, высокая бактериальная нагрузка, вариабельность вирулентности штамма бактерии, отсутствие необходимой концентрации антибактериального препарата в желудке;
– состояния, ассоциированные с гиперсекрецией соляной кислоты: синдром Золлингера – Эллисона, идиопатическая гиперсекреция соляной кислоты, системный мастоцитоз, нарушенная фармакокинетика ингибиторов протонной помпы за счет полиморфизма генов CYP2C19 и MDR1;
– вариабельность индивидуального иммунного ответа организма-хозяина на проводимое лечение за счет полиморфизма генов: ИЛ-1бета,, ИЛ-8, ИЛ-10, ИЛ-12; FNO-альфа;
– низкий комплаенс пациента;
– некорректное назначение антихеликобактерных схем.
Наиболее значимый фактор снижения эффективности среди всех перечисленных – растущая антибиотикорезистентность Н. pylori. В ряде исследований выявлена четкая корреляционная связь между снижением эффективности классической эрадикационной тройной терапии и ростом резистентности микроба к основным антибактериальным препаратам, применяемым в схемах эрадикации микроорганизма первой линии, особенно к кларитромицину [8, 9, 15]. Попытка увеличить эффективность тройной терапии посредством удлинения курса до 10–14 дней дает не такой большой результат, как ожидалось. По данным некоторых метаанализов, этот шаг обеспечивает всего 3–5% преимущества при потенциально неблагоприятных фармакоэкономических показателях [16]. Эта негативная тенденция прослеживается в странах Европы, где общая резистентность к этому антибиотику увеличилась с 9% (1998) до 17,6% (2008–2009) [17, 18]. Увеличению кларитромициновой резистентности способствует широкое применение этого антибиотика в качестве монотерапии респираторных инфекций [19]. Например, в Японии рост клинического применения кларитромицина в период 1993–2000 гг. был прямо пропорционален росту резистентности Н. pyloriк этому антибиотику [20].
В России резистентность Н. pylori к кларитромицину варьирует в разных регионах. По некоторым региональным исследованиям, этот показатель приближается к рубежу в 15–20% [21, 22, 23]. В Республике Беларусь в 2010–2011 гг. по Витебску и Гомелю резистентность Н. pylori к кларитромицину составляла около 5,5%, а по Минску около 15% [24]. Однако в ряде зарубежных стандартов тройная терапия с кларитромицином остается дееспособной. Так, результаты европейского консенсуса по проблемам инфекции Н. pyloriМаастрихт IV (2010) свидетельствуют о возможности применения тройной терапии 1-й линии с кларитромицином в регионах, где резистентность Н. pylori к кларитромицину не выше 15–20% [25]. В разработках схем лечения Н. pylori-ассоциированной язвенной болезни 12-перстной кишкиУправлением по контролю качества пищевых продуктов и лекарственных средств США (Food and Drug Administation, FDA) также отмечена необходимость применения стандартной терапии 1-й линии с кларитромицином [26]. Российская гастроэнтерологическая ассоциация рекомендует этот вариант как терапию 1-й линии в качестве конкурентоспособной схемы [2, 27–29].
Практикующему врачу сложно разобраться в ситуации, когда даже ведущие мировые эксперты разошлись во мнениях, говоря, что, с одной стороны, «имеются очевидные доказательства неприемлемо низкой эффективности схем антихеликобактерной терапии 1-й линии», а с другой, что «стандартная тройная терапия 1-й линии остается терапией выбора во всем мире». Тем более в случаях недостаточности информации о частоте антибактериальной резистентности в конкретных регионах [29, 30]. Причины оставить в мировой практике тройную терапию 1-й линии с кларитромицином в качестве конкурентоспособной следующие:
– в ряде стран стандартная тройная терапия является единственной официально разрешенной к применению в качестве эрадикационной 1-й линии, так как не разрешены к применению препараты висмута;
– стандартизация подхода практикующих врачей к лечению (одна комбинация);
– применение трехкомпонентных схем, с унифицированным приемом лекарств 2 раза в день упрощает режим лечения для пациента, что потенциально может влиять на комплаентность, а следовательно, и на эффективность терапии;
– кларитромицин обладает минимальной ингибирующей концентрацией в отношении Н. pylori, способностью проникать и накапливаться в слизистой желудка, позитивным лекарственным взаимодействием с ИПП – за счет метаболизма общим путем через CYP3A4 – отмечается двукратное увеличение площади под кривой «концентрация – время» и повышение эффекта антихеликобактерной терапии.
Биологические особенности инфекции Н. pyloriуникальны, что отражается и на способности бактерии приобретать антимикробную резистентность. Огромное количество бактерий в желудке человека, длительный период персистирования инфекции приводят к тому, что формируется микст-популяция бактерий, когда часть субпопуляций может иметь резистентность к разным антибиотикам и при использовании только одного препарата небольшая устойчивая к нему популяция бактерий может выжить и реколонизировать желудок. Для уменьшения возможных проблем используют одновременно несколько антибиотиков или проводят предварительную терапию препаратами, снижающими колонизационную плотность, например ИПП или препаратами висмута, которые делают выживание мелких популяций менее вероятным [14, 31, 32].
Использование ИПП в высоких дозах (удвоенная разовая доза относительно стандартной в прежнем режиме – дважды в сутки) является еще одним решением проблемы снижающейся эффективности стандартной тройной терапии первой линии [33, 34].
На успешность эрадикации Н. pylori влияет внутренняя среда желудка, так как бактерия находится в нереплицирующемся, но жизнеспособном состоянии, когда окружающая ее среда имеет pH от 3 до 6. Повышение рН выше 6 дает бактериям возможность перейти в репликативное состояние, когда они становятся чувствительными к амоксициллину и кларитромицину. При таких же значениях рН отмечается наибольшая устойчивость (максимальный период полураспада) амоксициллина и кларитромицина [35]. Любопытно, что при условии наличия времени с внутрижелудочным рН<4,0 менее 10% в течение 1 суток и/или при среднесуточном рН>6,0 эрадикация Н. pylori отмечается практически обязательно, вне зависимости от резистентности к антибактериальным препаратам [36].
Целесообразность использования удвоенных доз ИПП подтверждена серьезной доказательной базой. Среди пионерских работ нужно отметить метаанализ M. Vallve и соавт., в котором удалось показать, что использование стандартных доз ИПП дает 6,2% (анализ по протоколу) преимущества в эффективности эрадикации над половинными дозами (для ИПП первых генераций – омепразола, пантопразола, лансопразола и рабепразола). С момента публикации этой работы применение ИПП в стандартных дозах (омепразол, эзомепразол и рабепразол – 20 мг, лансопразол 30 мг и пантопразол 40 мг) 2 раза в сутки стало базой для всех схем антихеликобактерной терапии [3, 9, 10, 33, 37]. Подтверждение результатов названного исследования демонстрировалось и в более поздних работах. Так, по результатам метаанализа, проведенного A.Villoria и соавт., двойные дозы ИПП дают в среднем 8% преимущества над стандартными дозами ИПП [38].
Обоснованность концепции о необходимости более мощной антисекреторной терапии для повышения уровня эрадикации нашла свое отражение и в последнем метаанализе A.G. McNicholl и соавт., включавшем 35 исследований (5998 пациентов). Показаны достоверные преимущества более мощных в плане антисекреторного эффекта эзомепразола и рабепразола над ИПП первых генераций в схемах АХТ на 4,7 и 4,1% соответственно (отношение шансов 1,32 (95% ДИ: 1,01–1,73) и 1,21 (95% ДИ: 1,02–1,42) соответственно) [39].
Таким образом, более выраженное антисекреторное действие двойных доз ИПП определяет значимое повышение эффективности схем эрадикационной терапии первой линии за счет различных факторов, среди которых наиболее важным можно признать повышение устойчивости кларитромицина и амоксициллина при слабокислых значениях pH. Действительно, согласно экспериментальным данным, добиться 100% эрадикации инфекции Н. pylori можно только в том случае, если среднесуточный pH в желудке достигает 6,4 (5,0–7,6), что достоверно выше среднего pH в желудке у лиц с неэффективным лечением (5,2 (2,2–6,2), р=0,0131). Кроме того, 100% эрадикация возможна только у тех пациентов, у которых отмечался уровень pH в теле желудка выше 4 на протяжении 90% времени и более в течение суток даже в присутствии кларитромицин-резистентных штаммов Н. pylori[51]. Например, в исследовании G.Manes и соавт. увеличение дозы омепразола до 80 мг/сут давало 20% преимущество у лиц с кларитромицин-резистентными штаммами [36, 40]. Но происходит ли аналогичный эффект при использовании иных схем, растет ли эффективность при утроении и большем увеличении доз ИПП – на сегодняшний день эти вопросы изучаются.
Вероятно, самым распространенным способом повышения эффективности лечения является удлинение курса эрадикационной терапии. Однако с увеличением растущей антибиотикорезистентности микроорганизма эффективность даже этого способа начала снижаться. Если ранее, согласно выводам консенсуса Маастрихт III (2005), пролонгация курса антихеликобактерной терапии с 7 до 10–14 дней повышала уровень эффективности на 9–12%, то в настоящее время этот шаг обеспечивает не более 5% преимущества при потенциально неблагоприятных фармакоэкономических показателях (увеличение стоимости курса лечения) [31]. Помимо этого, удлинение курса лечения способствует росту частоты нежелательных побочных эффектов и ухудшает комплаентность [30, 41].
Вопрос выбора схемы антихеликобактерной терапии, особенно схемы 1-й линии, всегда был актуальным для практического врача. С одной стороны, нет информации о реальной резистентности Н. pylori к макролидам по регионам республики (возможно, в некоторых областях она может быть высокая), с другой – существует приоритет выбора в отношении тройной терапии с кларитромицином, о чем говорилось выше. В соответствии с новыми Маастрихтскими рекомендациями, при выборе схемы следует основываться на данных о резистентности штаммов Н. pylori к кларитромицину в регионе, так как этот рост связывают со снижением эффективности стандартных схем эрадикационной терапии. Поэтому в регионах с низкой резистентностью Н.pylori к кларитромицину, в соответствии с консенсусом Маастрихт IV, в качестве эрадикационной терапии первой линии рекомендуется либо та же схема тройной терапии (ИПП + амоксициллин + кларитромицин), либо квадротерапия с препаратом висмута (ИПП + висмута трикалия дицитрат + метронидазол + тетрациклин). В регионах же с высокой резистентностью Н. pylori к кларитромицину (15–20%) в качестве эрадикационной терапии первой линии рекомендуется только квадротерапия с препаратом висмута. В тех регионах, где препараты висмута недоступны, как альтернативу первой линии терапии стоит рассматривать последовательную эрадикационную терапию (первые 5 дней ИПП + амоксициллин, последующие 5 дней ИПП + кларитромицин + тинидазол/метронидазол) или квадротерапию, не содержащую препаратов висмута (ИПП + кларитромицин + амоксициллин + метронидазол). Согласно данным недавно проведенных клинических исследований, эта схема показала достаточно многообещающие результаты, что позволило включить ее в последний пересмотр европейских рекомендаций по лечению и диагностике инфекции Н. pylori в качестве одной из альтернативных схем первой линии [10, 14, 25, 29, 41, 42].
В консенсусе Маастрихт III было постулировано, что замена амоксициллина на метронидазол в схемах тройной терапии имеет некоторые преимущества, однако целесообразна в регионах, где низкая резистентность штаммов микроорганизмов к метронидазолу. Экспертный совет согласительного совещания 2010 г. при обсуждении такого же вопроса сделал вывод, что замена вышеуказанных антибиотиков не дает каких-либо преимуществ, так как их эффективность в схемах тройной терапии эквивалентна.
Терапией второй линии по прошлому Маастрихтскому консенсусу предлагалась схема квадротерапии на основе препаратов висмута. В соответствии с последним консенсусом эта схема второй линии также является приоритетной для регионов с низкой резистентностью штаммов Н. pylori к кларитромицину, а в качестве альтернативы выдвигается тройная терапия с левофлоксацином (ИПП + амоксициллин + левофлоксацин). Что же касается регионов с высокой резистентностью штаммов Н. pylori к кларитромицину, то согласно консенсусу Маастрихт IV, терапией второй линии, при неэффективности квадротерапии первой линии, также является тройная терапия с левофлоксацином. Однако экспертный совет рекомендует учитывать растущий уровень резистентности к левофлоксацину, который в ближайшем будущем может поставить под угрозу эффективность данной схемы [12, 18, 41, 43, 44].
По рекомендациям экспертов Российской гастроэнтерологической ассоциации, простым способом повышения эффективности классической трехкомпонентной схемы является включение в ее состав висмута трикалия дицитрата. При отсутствии данных многоцентровых исследований по оценке уровня резистентности Н. pylori к кларитромицину такой подход дает возможность увеличить показатель успешной эрадикации на 15–20%, в том числе и за счет преодоления резистентности бактерии к этому антибиотику [45].
Нововведением консенсуса Маастрихт IV стали регламентированные схемы эрадикационной терапии для пациентов с аллергией на антибиотики группы пенициллина, когда нельзя использовать схемы с включением амоксициллина. Так, у этой категории пациентов в регионах с низким уровнем резистентности Н. pylori к кларитромицину в качестве терапии первой линии может применяться схема ИПП + кларитромицин + метронидазол, а в регионах с высоким уровнем резистентности к кларитромицину – квадротерапия с препаратами висмута (ИПП + висмута трикалия дицитрат + метронидазол + тетрациклин). При этом в качестве альтернативы («терапия спасения») в регионах с низким уровнем резистентности к фторхинолонам может использоваться схема ИПП + кларитромицин + левофлоксацин.
Алгоритм и схемы эрадикационной терапии в соответствии с рекомендациями IV Маастрихтского консенсуса представлены в табл. 1.
Таблица 1. Схемы эрадикационной терапии Н. pylori, рекомендуемые консенсусом Маастрихт IV (Флоренция, 2010)
|
Схема лечения
|
Регионы с низким
уровнем распространенности резистентных штаммов
к кларитромицину
|
Регионы с высоким
уровнем распространенности
резистентных штаммов
к кларитромицину
|
|
Терапия 1 линии
|
ИПП + кларитромицин + амоксициллин/ метронидазол
Квадротерапия на основе препаратов висмута
|
Квадротерапия на основе препаратов висмута
Последовательная терапия
Квадротерапия без препаратов висмута
|
|
Терапия 2 линии
|
Квадротерапия на основе препаратов висмута ИПП + левофлоксацин + амоксициллин
|
ИПП + левофлоксацин + амоксициллин
|
|
Терапия 3 линии
|
Индивидуальный подбор препаратов на основании результатов тестирования резистентности Helicobacter pylori к антибиотикам
|
|
Пациенты
с аллергией
на производные
пенициллина
|
ИПП + кларитромицин + метронидазол
«Терапия спасения»:
ИПП + кларитромицин + левофлоксацин
|
Квадротерапия на основе
препаратов висмута
|
|
Квадротерапия на основе препаратов висмута: ИПП + метронидазол + тетрациклин + висмута трикалия дицитрат
Квадротерапия без препаратов висмута: ИПП + кларитромицин + амоксициллин + метронидазол
Последовательная терапия: ИПП + амоксициллин (первые 5 дней), ИПП + кларитромицин + метронидазол (последующие 5 дней)
|
Согласно консенсусу Маастрихт III, лечение после неудачи двух курсов терапии должно основываться на определении индивидуальной чувствительности микроорганизма к антибиотикам. Это положение в согласительном совещании 2010 г. осталось без изменений для регионов как с низкой резистентностью штаммов Н. pylori к кларитромицину, так и с высокой.
Итак, можно полагать, что наиболее простым для врача-терапевта и одновременно наиболее научно обоснованным путем повышения эффективности тройной терапии 1-й линии с кларитромицином на сегодняшний день является модификация схемы лечения с использованием двойных доз ИПП.
Одним из мощных, высокоэффективных ИПП, представленных в Республике Беларусь, является пантопразол (торговое наименование оригинального лекарственного средства – Контролок; производитель Такеда, Япония), обладающий уникальными фармакокинетическими и фармакодинамическими свойствами.
Пантопразол, как и другие ИПП из группы замещенных бензимидазолов, обладает тканевой селективностью в отношении париетальных клеток желудка. Действующее вещество после всасывания в тонкой кишке накапливается в зонах с наиболее низкими значениями pH, в области секреторных париетальных клеток, где рН около 1–2. В этих условиях происходит протонирование ИПП, превращение в активную форму – сульфенамид, который необратимо связывается с цистеиновым остатком Н+/K+-АТФазы и блокирует необратимо ее функцию. Диапазон рН, при котором происходит активация ИПП, обусловлен особенностями их молекулы. Скорость активации пантопразола при повышении pH до 3 падает вдвое и практически прекращается при рН= 4. Активация других ИПП продолжается и при более высоких pH: так, скорость образования сульфенамида омепразола, эзомепразола и лансопразола снижается в 2 раза при рН=4, рабепразола при рН=4,9. Эта особенность позволяет рассматривать пантопразол как препарат, наиболее селективный для париетальных клеток желудка. Фармакодинамика пантопразола не предполагает возможности блокады Н+/K+-АТФаз и Н+/Na+-АТФаз клеток других структур: билиарного или кишечного эпителия, почечных канальцев, эпителия роговицы, мышц, иммунокомпетентных клеток, а также влияния на органеллы с кислой средой (лизосомы, нейросекреторные клетки, эндосомы). Избирательность действия предполагает меньшую вероятность нежелательных явлений, особенно при длительном применении [46].
ИПП метаболизируются в микросомах печени с участием субъединиц цитохрома Р450 – CYP2C9, CYP2C19, CYP2D6, CYP3A4. При этом они в разной степени угнетают окислительную активность ферментов CYP. Значимым является влияние на CYP2С19 и CYP3А4.
По результатам исследований, среди пяти наиболее часто применяющихся ИПП пантопразол в наименьшей степени подавляет CYP2С19 и в наибольшей степени CYP3А4. По выраженности угнетения функции CYP2С19 за лансопразолом следует омепразол, эзомепразол, рабепразол и пантопразол; по силе влияния на CYP3А4 за пантопразолом следуют омепразол, эзомепразол, рабепразол и лансопразол.
CYP2С19 отличается полиморфностью, что отражается на терапевтическом эффекте ИПП. Он принимает участие в метаболизме многих лекарственных препаратов, поэтому большое практическое значение имеет влияние ИПП именно на эту субъединицу цитохрома Р450. Пантопразол обладает наименьшим потенциалом взаимодействия с лекарствами, метаболизм которых протекает с участием CYP2С19 (табл. 2).
Таблица 2. Лекарственное взаимодействие различных ИПП c другими лекарственными средствами (по [47])
|
Лекарственное
средство
|
Пантопразол
(Контролок)
|
Эзоме-
празол
|
Ланзопразол
|
Рабе-
празол
|
Оме-
празол
|
|
Антациды
|
0
|
–
|
*
|
0
|
0
|
|
Карбамазепин
|
0
|
–
|
–
|
–
|
+
|
|
Контрацептивы
|
0
|
–
|
*
|
–
|
*
|
|
Диазепам
|
0
|
+
|
0
|
0
|
+
|
|
Диклофенак
|
0
|
–
|
–
|
–
|
0
|
|
Дигоксин
|
0
|
–
|
–
|
+
|
+
|
|
Этанол
|
0
|
–
|
0
|
–
|
0
|
|
Глибенкламид
|
0
|
–
|
–
|
–
|
–
|
|
Левотироксин
|
0
|
–
|
–
|
–
|
–
|
|
Метопролол
|
0
|
–
|
–
|
–
|
0
|
|
Нифедипин
|
0
|
–
|
–
|
–
|
+
|
|
Фенитоин
|
0
|
+
|
0
|
0
|
+
|
|
Пироксикам
|
0
|
–
|
–
|
–
|
0
|
|
Теофиллин
|
0
|
–
|
*
|
0
|
0
|
|
Варфарин
|
0
|
+
|
0
|
0
|
+
|
П р и м е ч а н и е : «0» – взаимодействий нет; «+» – взаимодействия зафиксированы; * – конфликтные результаты; «–» – данных нет.
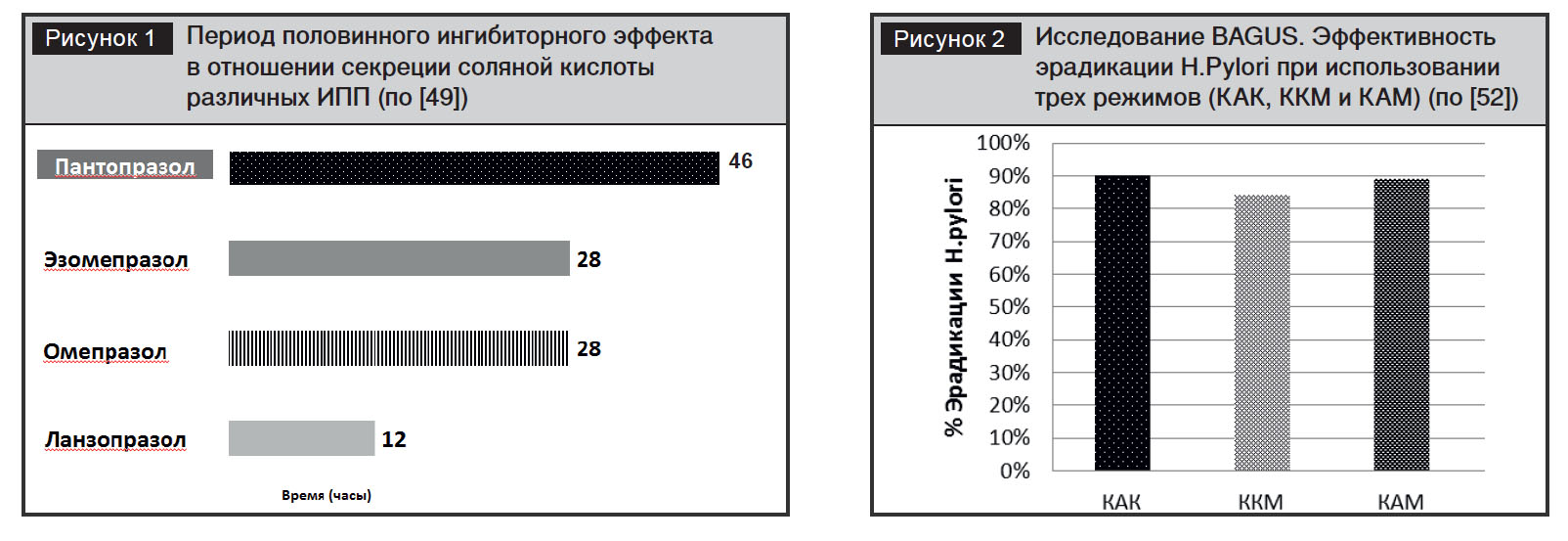
Помимо узкого диапазона pH, при котором наблюдается активация препарата, пантопразол отличается от других ИПП более длительным связыванием с протонной помпой вследствие образования ковалентной связи с дополнительным цистеиновым остатком (Цис 822). В результате период полувыведения препарата не коррелирует с продолжительностью антисекреторного эффекта и после прекращения приема пантопразола желудочная секреция восстанавливается спустя 46 часов [48, 49] (рис. 1).
По пантопразолу (Контролоку) были проведены многочисленные исследования с отработкой оптимальных режимов эрадикационной терапии в комбинации с различными антибиотиками, применявшимися в разных дозах. При проведении трехкомпонентной терапии на основе Контролока в течение 7 дней (ККМ = Контролок в дозе 40 мг 2 раза в сутки, кларитромицин в дозе 500 мг 2 раза в сутки, метронидазол в дозе 500 мг 2 раза в сутки) с целью эрадикацииH. pylori у страдающих язвенной болезнью двенадцатиперстной кишки, а также при оценке частоты заживления язв удлинения курса терапии до 14 дней не потребовалось (различие между двумя режимами в частоте эрадикации составило 1%). Таким образом, после завершения трехкомпонентной недельной терапии на основе Контролока последующего противоязвенного лечения с целью заживления язв двенадцатиперстной кишки не требуется [50].
В другом исследовании отмечалась эквивалентность режимов эрадикационной терапии ККМ (Контролок, кларитромицин и метронидазол) и ККА (Контролок, кларитромицин, амоксициллин). Так, у больных с пептическими язвами трехкомпонентная терапия в течение 7–10 дней ККА (контролок, кларитромицин, амоксициллин), или ККМ (контролок, кларитромицин, метронидазол), или КАМ (контролок, амоксициллин, метронидазол) обеспечивала эффективное заживление пептических язв (>95%) без последующего противоязвенного лечения (96% при режиме ККМ и 94% при режиме ККА) [51].
В рамках 14 различных контроли-руемых исследований Контролок в дозе 40 мг 1 раз в сутки получали 2500 пациентов с эндоскопически верифицированной язвой 12-перстной кишки. Средняя частота заживления составила 73% после 2 недель терапии и 96% после 4 недель лечения. Дополнительно к этому были проведены сравнительные исследования, включав-шие 750 пациентов, у которых было продемонстрировано преимущество Контролока 40 мг по сравнению с омепразолом 20 мг.
Исследование BAGUS – наиболее крупное рандомизированное парал-лельное сравнительное исследование по оценке режимов эрадикационной терапии на основе Контролока у пациентов, страдающих язвенной болезнью желудка [52]. В исследование были включены более 500 Н. pylori-позитивных пациентов, имевших 1–2 язвенных дефекта желудка (размером 5–20 мм). При использова-нии трех режимов эрадикационной терапии на основе Контролока была зарегистрирована высокая частота эрадикации: Контролок, амоксициллин, кларитромицин (КАК) – 90%; Контролок, кларитромицин, метронидазол (ККМ) – 84%; Контролок, амоксициллин, метронидазол (КАМ) – 89% (рис. 2). Показано, что эрадикационная терапия с последующей терапией ИПП является наиболее эффективным подходом к лечению язвенной болезни желудка, обеспечивающим максимальную часто-ту заживления дефектов и профилактику их рецидива.
На базе Республиканского клинического госпиталя инвалидов Великой Оте-чественной войны им. П.М. Машерова в 2010–2011 гг. проведено изучение эффективности и переносимости трехкомпонентной эрадикационной терапии (Контролок, амоксициллин, кларитромицин) больных пожилого и старческого возраста с язвенной болезнью двенадцатиперстной кишки (ЯБДК), ассоциированой с Н. pylori. Для определения инфицированности пациентов Н. pyloriбрались биоптаты из антрума и тела желудка.
В исследование были включены 24 пациента (20 мужчин и 4 женщины), страдавших ЯБДК, ассоциированной с Н. pylori, в стадии обострения. Возраст пациентов колебался в пределах 68–89 лет, составляя в среднем 74,4±8,2 года. Средняя длительность заболевания 16,5±0,8 года. Типы течения болезни были следующие: впервые обнаруженная язва – 3 (12%) пациента, редко и умеренно рецидивирующие типы течения – 16 (65%) чел., рецидивирующий тип – 5 (20%) больных. Наследственность по язвенной болезни имели 3 (12%) больных. Злоупотребляли курением и алкоголем 7 (30%) пациентов. Сопутствующие заболевания были обнаружены у всех (100%) пациентов: ИБС, инфаркт миокарда в анамнезе (4 больных), артериальная гипертензия, хронический бронхит, сахарный диабет 2 типа, хронический калькулезный и бескаменный холециститы, хронический панкреатит. Таким образом, исследуемую группу составили 24 пациента обоих полов пожилого и старческого возраста, страдавшие язвенной болезнью двенадцатиперстной кишки, ассоциированной с H-pylori, в стадии обострения, на фоне сопутствующей патологии.
Назначалось лечение по схеме: Контролок 40 мг 2 раза в сутки, амоксициллин 1000 мг 2 раза в сутки, кларитромицин 500 мг 2 раза в сутки в течение 10 дней. По окончании данного курса больные продолжали принимать Контролок до полного рубцевания язвы.
Эффективность лечения оценива-лась по срокам рубцевания язвы, по эрадикации Н. pylori через 3 месяца в биоптатах из антрума и тела желудка; по срокам купирования болевого и диспептического синдрома, по безопасности и переносимости лечения.
Исходно у больных диаметр язвы колебался в пределах от 5 до 20 мм. Одиночные язвы встречались у 21 больного, множественные – у 3. Через 3 недели полное рубцевание язвенного дефекта отмечено у 18 (75%) пациентов, через 4 недели – у всех остальных. Средний срок рубцевания составил 18,2±3,8 дня. Эрадикация была достигнута у 21 (около 90%) пациента. Такие клинические проявления, как дневные и ночные боли в животе, отрыжка, изжога, метеоризм, запоры, тошнота, исчезали в сроки от 2 до 10 дней после начала лечения. Безопасность и переносимость лечения: у двух пациентов были зафиксированы легкая тошнота и слабость, у трех других – расстройство стула. Симптомы исчезли к пятому дню лечения. Эти изменения не потребовали отмены эрадикационной терапии.
Таким образом, эрадикационная терапия на основе Контролока эф-фективна и безопасна, в том числе и у лиц старших возрастных категорий, имеющих сопутствующую патоло-гию, поскольку имеет низкий риск лекарственного взаимодействия и обес-печивает высокий процент эрадикации микроба даже у пациентов с отсутствием эффекта от ранее проводимой анти-хеликобактерной терапии.
Л И Т Е Р А Т У Р А
1. Mandeville К. L., Krabshuis J., Ladep N. G. et al. // World J. Gastroenterol. – 2009. – Vol.15 (23). – Р.2839–2854.
2. Ивашкин В.Т., Маев И.В., Лапина Т.Л. и др. // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2012. – № 1. – С.87–91.
3. Peura D.A., Crowe S.Е. Helicobacter pylori. In: Feldman М., Friedman L.S., Brandt L.J., eds. Sleisenger, Fordtran’s Gastrointestinal and Liver Disease. 9th ed. – Philadelphia: Saunders Elsevier, 2010. – Chap 50.
4. Маев И.В., Самсонов А.А., Андреев Д.H.и др. // Клинич. медицина. – 2013. – №8. – С.4–12.
5. Nakajima S., Nishiyama Y., Yamaoka M. et al. // J. Gastroenterol. Hepatol. – 2010. – Vol.25 (Suppl.1). – Р.S99–S110.
6. Wang A. Y., Peura D.A. // Gastrointest. Endoscop. Clin. N. Am. – 2011. – Vol.21 (4). – Р.613–635.
7. Buras C.M. // World J. Gastroenterol. – 2010. – Vol.16 (31). – Р.3865–3870.
8. Кучерявый Ю.А., Андреев Д.К, Баркалова Е.В. // Мед. совет. – 2013. – №10. – С.11–15.
9. Gasparetto М., Pescarin М., Guariso G. // ISRN Gastroenterol. – 2012. – Vol.2012. – Р.186–734.
10. Malfertheiner P., Megraud F., О‘Morain C. et al. // Gut. – 2007. – Vol.56. – Р.772–781.
11. De Francesco V, Ierardi E., Hassan C., Zulio A. // World J. Gastrointest. Pharmacol. Ther. – 2012. – Vol.3 (4). – Р.68–73.
12. Андреев Д. H., Кучерявый Ю.А. // Consilium Medicum. – 2013. – №8. – С.5–9.
13. Маев И.В., Кучерявый Ю.А., Андреев Д.Н. // РЖГГК. – 2013. – №6. – С.62–72.
14. Graham D.Y., Fischbach L. // Gut. – 2010. – Vol.59 (8). – Р.1143–53.
15. Кучерявый Ю.А. // Эксперим. и клинич. гастроэнтерол. – 2009. – №4. – С.128–132.
16. Fuccio L., Minardi M., Zagari R. et al. // Ann. Intern. Med. – 2007. – Vol.147 (8). – Р.553–62.
17. Glupczynski Y., Megraud F., Lopez-Brea M.еt al. // Eur. J. Clin. Microbiol. Infcct. Dis. – 2001. – Vol.20. – Р.820–823.
18. Megraud E, Coenen S., Versporten A. еt al. // Gut. – 2013. – Vol.1. – Р.4–42.
19. Wu W., Yang Y, Sun G. // Gastroenterol. Res. Pract. – 2012. – Vol.2012. – ID23183.
20. Perez Aldana L., Kato М., Nakagawa S. et al. // Helicobacter. –2002. – Vol.7. – Р.306–309.
21. Перфилова К. М., Неумоина Н. В., Неумои-на М.В. и др. // Рос. журн. гастроэнтерол., гeпатол., колопроктол. – 2012. – №5 (прилож. 40). – С.37.
22. Лазебник Л.Б., Рустамов М.Н. // Тез. докл. XII съезда Науч. общества гастроэнтерологов России «Классическая и прикладная гастроэнтерология» 1–2 марта 2012 г. – М., 2012.
23. Маев И. В., Кучерявый Ю.А., Андреев Д. Н. // Лечащий врач. – 2014. – №2. – С.34–39.
24. Янович О.О. и др. // Здравоохранение. – 2011.– №12. – С.9–12.
25. Маев И.В., Самсонов А. А., Андреев Д.Н., Кочетов С.А. // Вестн. практич. врача. – 2012. – №1. – С.23–30.
26. Htth: //www.fda.gov/dounloads/Drugs/Guiance Compliance Regulatory Information / Guidances/UCM18450. pdf
27. O’Connor J.P., Taneike I., O’Morain C. // Therap. Adv. Gastroenterol. – 2009. – Vol.2 (5). – Р.273–279.
28. Wermeille J., Cunningham М., Girard L. et al. // Gastroenterol. Clin. Biol. – 2002. – Vol.26(3). – Р.216–219.
29. Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacterpyloriзаболеваний (Пятое московское соглашение) // Эксперим. и клин. гастроэнтерол. – 2013. – №5. – С.3–11.
30. Tepes В., O’Connor A., Gisbert J., O’Morain С. // Helicobacter. – 2012. – Vol. 17 (Suppl.I). – Р.36–42.
31. Stratton C.W., Warner R.R., Coudron P.E., Lilly N.A. // J. Antimicrob. Chemother. – 1999. – Vol. 43 (5). – Р. 659–666.
32. Bland М.V., Ismail S., Heinentann J.A., Keenan J.I. // Antimicrob. Agents. Chcmother. – 2004. – Vol. 48 (6). – Р. 1983–1988.
33. Кучерявый Ю.А., Баркалова E.В. // Фарматека. – 2013. – № 10. – С.11 – 17.
34. Кучерявый Ю.А., Баркалова E. В. // Лечебное дело. – 2012. – №1. – С.36–42.
35. Еrah P.O., Goddard A.F., Barrett D.A. et al. // J. Antimicrob. Chemother. – 1997. – Vol.39 (1). – Р.5–12.
36. Sugimoto М., FurutaТ., Shirai N. et al. // Helicobacter. – 2007. – Vol. 12 (4). – Р. 317–323.
37. Vallve М., Vergara М., Gisbert J. P., Calvet X. // Aliment. Pharmacol. Ther. 2002. – Vol.16 (6). – Р.1149–1156.
38. Villoria A., Garcia P., Calvet X. et al. // Aliment. Pharmacol. Ther. – 2008. – Vol.28 (7). – Р.868–877.
39. McNicholl A. G., Linares P. М., Nyssen O. P. et al. // Aliment. Pharmacol. Ther. – 2012. – Vol.36 (5). – Р.414–425.
40. Manes G., Pieramico O., Perri F. et al. // Dig. Dis. Sci. – 2005. – Vol.50 (3). – Р.443–448.
41. Malfertheiner P., Megraud F., O’Morain С. еt al. // Gut. – 2012. – Vol.61 (7). – Р.646–664.
42. Yoon J. H., Baik G. H., Kim Y.S. et al. // Gut Liver. – 2012. – Vol. 6(4). – Р.434–439.
43. Бордин Д. С., Машарова А.А., Хомерики С. Г. // Эксперим. и клинич. гастроэнтерол. – 2012. – №5. – С.99–106.
44. Ergul B., Dogan Z, Sarikaya М., Filik L. // Helicobacter. – 2013. – Vol.18 (6). – Р.454–458.
45. Маев И.В., Самсонов А.А., Коровина Т.Н. и др. // Эксперим. и клинич. гастроэнтерол. – 2012. – № 8. – С.92–97.
46. Ritton A., Wiseman L. // Drugs. – 1996. – Vol. 1 (3). – Р.460–82.
47. Blume et al. // Drug. Safety. – 2006. – Vol.29(9). – P.15–20.
48. Besancon M., Simon A., Sachs G. et al. // J. Biol. Chem. – 1997. – Vol.272 (36). – Vol.22. – P.438–46.
49. Shin J., Sachs G. // Gastroenterology. – 2002. – Vol.123. – Р.1588–97.
50. Dammann H.G. et al. Helicobacter. – 2000. – Vol. 5 (1). – Р.41–51.
51. Frevel M. // Aliment. Pharmacol. Ther. – 2000. – Vol.9. – P.1151–1157
52. Malfertheiner P. // Gut. – 2000. – P. 47, Suppl III. – P. A127.
Медицинские новости. – 2015. – №4. – С. 29-34.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.