 Kozhanova I.N., Romanova I.S.
Kozhanova I.N., Romanova I.S.
Belarusian State Medical University, Minsk
Lisinopril in clinical practice
Резюме. Ингибиторы ангиотензинпревращающего фермента занимают ведущие позиции в лечении пациентов с сердечно-сосудистыми заболеваниями. Эти препараты наряду с отчетливым антигипертензивным эффектом оказывают и выраженное органопротективное действие, связанное с влиянием на тканевые ренин-ангиотензин-альдостероновые системы, локализованные в различных органах. Лизиноприл является самым исследованным в клинических испытаниях ингибитором ангиотензинпревращающего фермента длительного действия. В статье представлены особенности фармакокинетики и фармакодинамики лизиноприла, а также показания к применению в клинической практике с позиций доказательной медицины.
Ключевые слова: ингибиторы ангиотензинпревращающего фермента, лизиноприл, сердечно-сосудистые заболевания.
Медицинские новости. – 2015. – №4. – С. 22–27.
Summary. ACE inhibitors have leading positions in the treatment of patients with cardiovascular disease. These drugs have antihypertensive effect and organoprotective effect associated with exposure to the tissue renin-angiotensin-aldosterone system, localized in different organs. Lisinopril is one of the most studied in clinical trials of long-acting ACE inhibitors. The article presents the features of the pharmacokinetics and pharmacodynamics lisinopril and indications in the clinical practice for use from the perspective of evidence-based medicine.
Keywords: ACE inhibitors, lisinopril, cardiovascular disease.
Meditsinskie novosti. – 2015. – N4. – P. 22–27.
На современном этапе развития фармакологии ингибиторы ангиотензинпревращающего фермента (иАПФ) рассматриваются как один из ведущих классов лекарственных средств (ЛС), применяемых для лечения сердечно-сосудистых заболеваний [1, 9]. Одним из наиболее часто используемых в клинической практике препаратов данной группы является лизиноприл. Препарат представлен на белорусском рынке 20 лет.
Таблица 1. Классификация иАПФ
|
Классификация иАПФ
|
Препараты
|
|
По химическому строению
|
|
препараты, содержащие сульфгидрильную группу
|
каптоприл, зофеноприл
|
|
препараты, содержащие карбоксиалкильную группу
|
эналаприл, лизиноприл, периндоприл, квинаприл, рамиприл
|
|
препараты, содержащие фосфинильную группу
|
фозиноприл и церонаприл
|
|
препараты, содержащие гидроксамовую группу
|
индраприл
|
|
По биологической активности
|
|
ЛС, непосредственно обладающие биологической активностью
|
каптоприл, лизиноприл
|
|
Пролекарства, превращающиеся в активные метаболиты путем гидролиза в печени или желудочно-кишечном тракте
|
эналаприл, фозиноприл, периндоприл, квинаприл, рамиприл, зофеноприл
|
|
По продолжительности действия
|
|
ЛС с короткой продолжительностью действия
|
каптоприл – 3 р/сут
|
|
ЛС со средней продолжительностью действия
|
эналаприл 2 р/сут
|
|
ЛС длительного действия
|
лизиноприл, фозиноприл, периндоприл, рамиприл, квинаприл, зофеноприл – 1 раз в сутки
|
|
В зависимости от особенностей метаболизма и путей элиминации выделяют три класса иАПФ (Opie L., 1992)
|
|
Класс I – липофильные лекарства, неактивные метаболиты которых имеют
печеночный путь выведения
|
каптоприл
|
|
Класс II – липофильные пролекарства
|
|
Подкласс IIА – препараты, активные метаболиты которых выводятся
преимущественно через почки
|
квинаприл, эналаприл, периндоприл и др.
|
|
Подкласс IIВ – препараты, активные метаболиты которых имеют печеночный
и почечный пути элиминации
|
фозиноприл, моэксиприл, рамиприл, трандолаприл
|
|
Класс III – гидрофильные лекарства, не метаболизируются в организме и выводятся почками в неизмененном виде
|
лизиноприл
|
Лизиноприл относится к дикарбоксилсодержащим иАПФ (табл. 1). Механизм действия лизиноприла обусловлен ингибированием ангиотензинпревращающего фермента (АПФ) и, соответственно, блокадой основных эффектов ренин-ангиотензин-альдостероновой, а также калликреин-кининовой систем (рис. 1, 2).
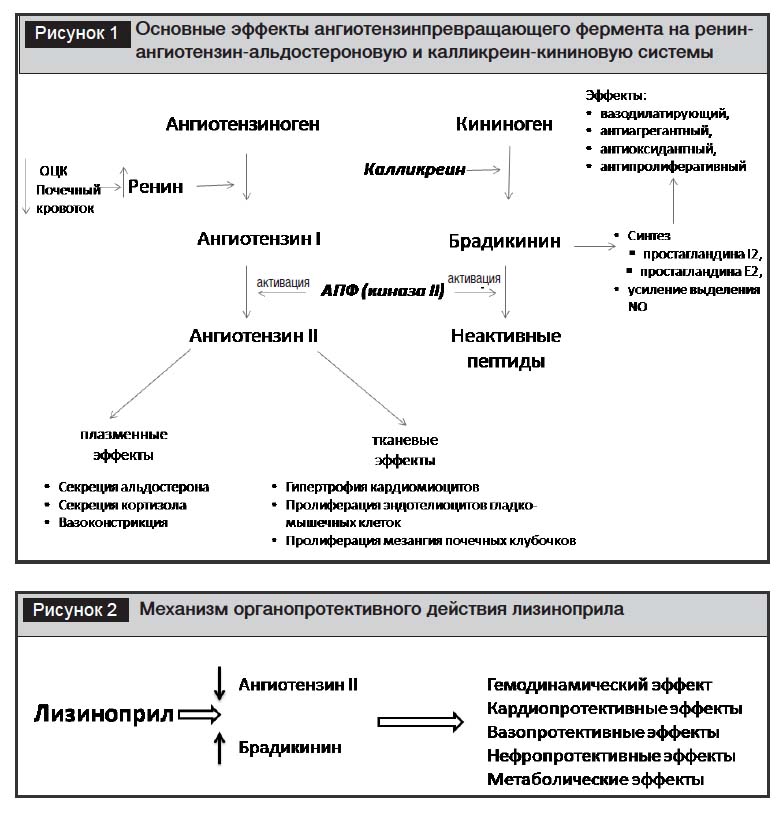
Таким образом, механизм действия лизиноприла рассматривается с двух позиций.
Блокада влияния циркулирующего ангиотензина II обеспечивает быструю системную вазодилатацию и оказывает диуретический эффект, что способствует снижению АД, уменьшению одышки и утомляемости при ХСН. Блокада тканевой активности ангиотензина II, снижение активности симпатической нервной системы, ингибирование действия альдостерона, а также предотвращение инактивации брадикикина позволяют реализовать долговременные органопротекторные эффекты препарата, но для этого требуется его длительное применение.
Основные гемодинамические эффекты лизиноприла заключаются в периферической вазодилатации (снижение пред- и постнагрузки на миокард), снижении общего периферического сопротивления сосудов и системного АД, улучшении ре-гионарного кровотока. Следует отметить, что при применении лизиноприла, в отличие от других вазодилататоров, не развивается рефлекторная тахикардия. После физической нагрузки или изменения положения тела частота сердечных сокращений не нарушается [26].
Кардиопротекторное действие: регрессия гипертрофии миокарда левого желудочка, замедление процессов ремоделирования сердца, антиишемическое и антиаритмическое действие [41, 43, 47].
Ангиопротекторное действие: усиление эндотелийзависимой вазодилатации, торможение пролиферации гладкой мускулатуры артерий, цитопротекторное действие, антитромбоцитарный эффект.
Нефропротекторное действие: увеличение натрийуреза и уменьшение калийуреза, снижение внутриклубочкового давления, торможение пролиферации и гипертрофии мезангиальных клеток, эпителиальных клеток почечных канальцев и фибробластов. Лизиноприл, как типичный представитель группы ингибиторов АПФ, превосходит другие группы антигипертензивных средств по нефропротекторной активности, которая, по крайней мере частично, не зависит от его антигипертензивного эффекта [34].
Нейрогуморальные эффекты: снижение активности РААС (снижение уровня ангиотензина II, альдостерона) снижение активности САС (снижение уровня нор-адреналина, вазопрессина); повышение активности калликреин-кининовой системы (повышение уровня кининов и простагландинов I2 и E2); повышение высвобождения оксида азота; повышение уровня предсердного натрийуретического пептида; уменьшение секреции эндотелина-I; повышение фибринолитической активности за счет увеличения высвобождения тканевого активатора плазминогена и уменьшения синтеза ингибитора тканевого активатора плазминогена I типа [1, 47].
Метаболические эффекты: повышение чувствительности периферических тканей к действию инсулина, антиатерогенный, противовоспалительный [21, 27, 29, 36, 38, 39, 42, 44].
Лизиноприл обладает пролонгированным действием и принимается один раз в день. Прием пищи не влияет на биодоступность. Препарат поступает в организм в виде активного вещества и не нуждается в гидролизе в ЖКТ, в отличие от других представителей группы (за исключением каптоприла) (табл. 2).
Таблица 2. Основные фармакокинетические характеристики иАПФ
|
ЛС
|
Биодоступность, %
|
Биологическая активность
|
Пути
выведения
|
Влияние пищи
на биодоступность
|
Связь
с белками плазмы, %
|
|
Каптоприл
|
75–90
|
Активное
средство
|
Печень 10%,
почки 90%
|
Уменьшает
|
25–30
|
|
Эналаприл
|
40
|
Пролекарство
|
Печень 10%, почки 90%
|
Не влияет
|
50
|
|
Лизиноприл
|
6–60
|
Активное
средство
|
Почки 100%
|
Не влияет
|
5
|
|
Периндоприл
|
65–95
|
Пролекарство
|
Печень 10%, почки 90%
|
Не влияет
|
20
|
|
Рамиприл
|
55–65
|
Пролекарство
|
Печень 40%, почки 60%
|
Не влияет
|
73
|
|
Фозиноприл
|
32
|
Пролекарство
|
Печень 50%, почки 50%
|
Не влияет
|
95
|
|
Квинаприл
|
60
|
Пролекарство
|
Почки, примерно 100%
|
Не влияет
|
97
|
|
Зофеноприл
|
100
|
Пролекарство
|
Печень 26%, почки 69%
|
Не влияет
|
88
|
Лизиноприл не связывается с другими белками сыворотки крови, что позволяет избежать лекарственных взаимодействий на этом уровне и риска передозировки у пациентов с гипоальбуминемией [2, 4]. Лизиноприл – гидрофильный иАПФ, не распределяющийся в жировой ткани. Это свойство позволяет считать его препаратом первого выбора у тучных пациентов с артериальной гипертензией [2, 6].
Лизиноприл полностью выводится почками и, невзирая на то что, как и другие иАПФ, обладает нефропротективным действием, – необходима коррекция его дозы у пациентов со снижением клиренса креатинина (КК) (табл. 3).
Таблица 3. Дозы лизиноприла и их коррекция у пациентов со снижением клиренса креатинина [2]
|
Клиренс
креатинина, мл/мин
|
Начальная доза, мг/сут
|
|
31–80
|
5–10&
|
|
10–30
|
2,5–5
|
|
? 10 (включая пациентов на диализе)*
|
2,5?
|
Лизиноприл, наряду с каптоприлом и эналаприлом, является одним из самых исследованных в клинических испытаниях препаратов (табл. 4).
Таблица 4. Результаты запроса в базе данных MEDLINE о клинических испытаниях ИАПФ (для отдельных препаратов и для прямых сравнений препаратов между собой)
|
Запрос
|
Число ссылок
|
|
Captopril Clinical Trial
|
1686
|
|
Enalapril Clinical Trial
|
2058
|
|
Lisinopril Clinical Trial
|
663
|
|
Fosinopril Clinical Trial
|
170
|
|
Perindopril Clinical Trial
|
531
|
|
Quinapril Clinical Trial
|
237
|
|
Ramipril Clinical Trial
|
586
|
|
Zofenopril Clinical Trial
|
36
|
|
Lisinopril Captopril Clinical Trial
|
58
|
|
Lisinopri Enalapril Clinical Trial
|
156
|
|
Lisinopril Fosinopril Clinical Trial
|
3
|
|
Lisinopril Perindopril Clinical Trial
|
3
|
|
Lisinopril Quinapril Clinical Trial
|
9
|
|
Lisinopril Ramipril Clinical Trial
|
3
|
|
Enalapril Captopril Clinical Trial
|
221
|
|
Captopril Fosinopril Clinical Trial
|
9
|
|
Enalapril Fosinopril Clinical Trial
|
13
|
|
Enalapril Perindopril Clinical Trial
|
40
|
|
Enalapril Quinapril Clinical Trial
|
28
|
|
Enalapril Ramipril Clinical Trial
|
26
|
|
Enalapril Zofenopril Clinical Trial
|
5
|
Но если фармакокинетические параметры каптоприла и эналаприла (назначение 3 или 2 раза в день) делают их недостаточно привлекательными для длительного применения, то лизиноприл, назначаемый один раз в сутки, является, таким образом, самым исследованным из препаратов длительного действия. Прямые сравнения иАПФ между собой немногочисленны. Наибольшее их количество также связано с тремя препаратами: каптоприл, эналаприл, лизиноприл.
Лизиноприл включен в клинические протоколы Республики Беларусь по лечению сердечно-сосудистых заболеваний:
•?Клинический протокол диагностики и лечения заболеваний, характеризующихся повышенным кровяным давлением [11]
•?Клинический протокол диагностики и лечения инфаркта миокарда, нестабильной стенокардии [12] (в данном протоколе имеется уточняющее указание о предпочтительном использовании лизиноприла у пациентов с печеночной недостаточностью).
•?Клинические протоколы диагностики и лечения взрослого населения с заболеваниями эндокринной системы при оказании медицинской помощи в амбулаторных условиях [10] (лизиноприл входит в схемы коррекции артериальной гипертензии у пациентов с СД и для профилактики прогрессирования диабетической нефропатии).
Национальные рекомендации диагностики, лечения и профилактики артериальной гипертензии рекомендуют использование лизиноприла при сочетании АГ с ХСН, дисфункцией ЛЖ, после ИМ, с диабетической нефропатией, нефропатией, не связанной с СД, гипертрофией миокарда левого желудочка, каротидным атеросклерозом, протеинурией/микроальбуминурией, фибрилляцией предсердий, метаболическим синдромом [11].
Клиническая эффективность и безопасность лизиноприла изучена во многих крупных клинических испытаниях.
В базе данных PUBMED представлено 485 публикаций, связанных с клиническими исследованиями лизиноприла при АГ; 121 – при сердечной недостаточности, 102 – при СД, 87 – при нефропатии.
Прием лизиноприла приводит к стойкому снижению артериального давления (систолического – в среднем на 13% (24,46–3,14), диастолического – на 6% (11,7–0,28)) без сопутствующей тахикардии у 50–80% пациентов с АГ [28]. Крупные хорошо организованные клинические испытания (ALLHAT, TROPHY, STOP-2, HOT и др.) продемонстрировали тот факт, что лизиноприл не уступает по эффективности другим ингибиторам АПФ, в том числе эналаприлу [23], тиазидным диуретикам (гидрохлоротиазид), бета-адреноблокаторам (метопролол, небиволол) [28, 41], антагонистам кальция (амлодипин, верапамил ретард, нифедипин ретард, фелодипин ретард), БРА (телмисартан [45], валсартан [31]).
В исследовании ALLHAT [22] оценивалась смертность от ИБС и частота инфарктов миокарда у пациентов старше 55 лет, страдающих АГ и получавших хлорталидон в дозе 12,5–25 мг (15255 больных), амлодипин в дозе 2,5–10 мг (9048 больных), доксазозин (9061 больной) и лизиноприл в дозе 10–40 мг в сутки (9054 пациента). Если целевого уровня АД достигнуть не удавалось, добавляли второй препарат (атенолол 25–100 мг, резерпин 0,05–0,2 мг однократно в сутки или клонидин 0,1–0,3 мг два раза в сутки). Третьим препаратом был гидралазин (25–100 мг два раза в сутки). Исследование в группе доксазозина было остановлено уже через 3,2 года после начала лечения в связи с достоверным повышением риска сердечно-сосудистых осложнений. По способности предотвращать наступление первичной комбинированной конечной точки (инфаркт миокарда и сердечно-сосудистая смерть) не было показано преимуществ ни одного из этих трех лекарственных препаратов. Лизиноприл оказался значительно эффективнее амлодипина в отношении профилактики развития сердечной недостаточности. Следует также отметить, что лизиноприл эффективно предотвращал возникновение новых случаев СД 2 типа [18]. Частота новых случаев СД через 2 года терапии оказалась почти в 2 раза выше в группе хлорталидона [13].
Клиническое исследование SAMPLE продемонстрировало способность лизиноприла уменьшать гипертрофию левого желудочка. Индекс массы миокарда ЛЖ уменьшался на 15,8% при лечении лизиноприлом в дозе 20 мг в сутки [32]. Лизиноприл улучшал систолическую и диастолическую функции ЛЖ [40]. В исследовании ELVERA было обнаружено достоверное уменьшение индекса массы миокарда при назначении лизиноприла у пожилых больных АГ [46].
Целый ряд крупных клинических испытаний проведен для изучения эффективности лизиноприла у пациентов с СД. В многоцентровом плацебо-контролируемом исследовании EUCLID было изучено влияние лизиноприла на развитие и прогрессирование диабетической нефропатии и ретинопатии у 530 больных СД 2 типа без АГ [25]. Через 2 года уровень микроальбуминурии в группе лизиноприла оказался на 18,8% ниже по сравнению с группой плацебо. Особенно выраженным был эффект лизиноприла у больных с микроальбуминурией в начале исследования: у них снижение экскреции альбумина с мочой составило 49,7%, в то время как у пациентов с исходной нормоальбуминурией снижение экскреции альбумина с мочой по сравнению с плацебо составило 12,7%. Кроме того, в группе лизиноприла было выявлено снижение риска прогрессирования диабетической ретинопатии на 50% по сравнению с группой плацебо. При этом максимальный протективный эффект лизиноприла в отношении развития и прогрессирования диабетической ретинопатии был отмечен у пациентов с компенсированным СД (при уровне гликированного гемоглобина < 7%).
Еще в одном крупном исследовании (3463 больных СД 2-го типа с диабетической нефропатией и АГ) через 3 месяца после назначения лизиноприла помимо снижения АД было отмечено улучшение азотвыделительной функции (почти у 50% больных с исходно повышенным уровнем креатинина этот показатель достоверно снизился). Также было отмечено положительное влияние лизиноприла на уровень гликированного гемоглобина и липиды крови. Лизиноприл очень хорошо переносился: побочные эффекты были выявлены всего у 2,2% пациентов [37].
Крупное исследование 2014 года, включающее 486 пациентов с поликистозом почек и III стадией хронической болезни почек продемонстрировало эффективность лизиноприла в виде монотерапии у данной категории пациентов [49]. Поскольку элиминация лизиноприла осуществляется через почки, у пациентов с почечной недостаточностью начальная доза зависит от показателей КК. Поддерживающую дозу устанавливают в зависимости от клинической реакции и подбирают при регулярном измерении показателей функции почек, концентрации калия и натрия в крови (см. табл. 2).
Назначение лизиноприла показано в острый период инфаркта миокарда при условии стабильной гемодинамики, для лечения в течение первых 24 часов для предотвращения последующего нарушения функции левого желудочка и развития сердечной недостаточности, а также для повышения выживаемости [2]. В исследовании GISSI-3, включавшем более 19000 больных, было показано, что прием лизиноприла (5–10 мг), начинавшийся с первых суток ОИМ (при стабильной гемодинамике) и продолжавшийся в течение 6 недель, привел к достоверному снижению общей смертности и существенному улучшению функции левого желудочка [27]. Наиболее эффективным применение лизиноприла было у больных с сопутствующим СД, у них смертность снизилась в среднем на 32%. Снижение шестинедельной смертности при лечении лизиноприлом составило в среднем 27% у больных СД 1 типа и 44% у больных СД 2 типа.
В отношении лечения стабильных форм ишемической болезни сердца (ИБС) показательно клиническое исследование COURAGE, продемонстрировавшее преимущества консервативной стратегии лечения перед чрескожным коронарным вмешательством. Оптимальная медикаментозная терапия, применяемая в данном исследовании, в числе прочих включала иАПФ лизиноприл [13, 30].
Самые ранние клинические испытания лизиноприла показали преимущества его назначения при ХСН [24]. Эффективность лизиноприла при ХСН была доказана в двойном слепом рандомизированном исследовании ATLAS [35]. В это исследование были включены 3164 больных сердечной недостаточностью II–IV функционального класса по классификации Нью-Йоркской ассоциации кардиологов (New York Heart Association, NYHA) с фракцией выброса ниже 30%. Больные получали лизиноприл в низких (2,5–5 мг/сут) и высоких дозах (32,5–35 мг/сут). Длительность наблюдения составила 39–58 мес. Было показано, что даже при назначении в небольших дозах (а из-за склонности к гипотонии далеко не всегда удается применять рекомендованные дозы) иАПФ позволяют добиться улучшения прогноза при этом тяжелом заболевании. Достоверных различий в общей смертности между группами больных, получавшими высокие или низкие дозы лизиноприла, отмечено не было. Клиническое улучшение также было примерно одинаковым. Однако в группе больных, получавших лизиноприл в высоких дозах, достоверно ниже оказался риск смерти и госпитализации из-за сердечно-сосудистых причин (на 9%, р=0,027), риск госпитализации в связи с декомпенсацией ХСН снизился на 24%, что означает необходимость достижения по возможности более высоких доз иАПФ. Важно подчеркнуть, что частота побочных эффектов в группе низких и высоких доз лизиноприла оказалась сопоставимой.
Ряд фармакокинетических характеристик лизиноприла (выведение почками и отсутствие необходимости в метаболизме в печени для образования активного вещества) делают его препаратом выбора у пациентов с заболеваниями печени. Это особенно актуально на фоне как роста вирусных заболеваний печени (хронические гепатиты), так и значительного количества пациентов с невирусной патологией (стеатогепатоз и др.). Н.Ф. Шустваль и соавт. изучали сравнительную эффективность и переносимость лизиноприла (Диротона, ОАО «Гедеон Рихтер») и эналаприла у пациентов с АГ 1-й и 2-й степени и сопутствующим хроническим вирусным гепатитом [15]. Оба препарата примерно одинаково снижали АД, снижали периферическое сосудистое сопротивление, улучшали эластичность сосудов, однако лизиноприл достоверно чаще снижал уровень трансаминаз и билирубина по сравнению с эналаприлом, на основании чего авторы сделали вывод о более выраженном гепатопротективном действии лизиноприла.
В России также есть опыт применения лизиноприла (Диротона) у больных с АГ и сопутствующим заболеванием печени [7, 13]. Л.Б. Лазебник с соавт. после изучения эффективности Диротона у пациентов с АГ и сопутствующей различной патологией органов пищеварения (стеатозом, циррозом печени, язвенной болезнью 12-перстной кишки) сделали вывод, что эффективность Диротона не зависит от выраженности изменений печени у пациентов с АГ [52, 13].
В Беларуси Диротон зарегистрирован в 1997 г., и уже накоплен большой клинический опыт, подтверждающий эффективность его применения у пациентов с сердечно-сосудистыми заболеваниями.
При применении лизиноприла, как и других представителей группы иАПФ, возможен ряд потенциально предсказуемых побочных реакций, развивающихся с разной вероятностью. Закономерным и предсказуемым побочным эффектом является гипотония, обусловленная устранением сосудосуживающего эффекта ангиотензина II, особенно у пациентов с сопутствующей диуретической терапией. Сухой кашель развивается у 2–10% больных [20, 50, 51]. Он может быть следствием увеличения уровней брадикинина легочной ткани.
Гиперкалиемия, связанная со снижением секреции альдостерона, редко встречается у пациентов с нормальной функцией почек, но достаточно часто развивается при застойной сердечной недостаточности и у пожилых людей [1, 48].
Ингибиторы АПФ могут вызвать повышение уровней азота мочевины и креатинина крови. У большинства пациентов концентрация креатинина остается стабильной или снижается до исходных значений при продолжении терапии. Острая почечная недостаточность чаще развивается на фоне лечения диуретиками в высоких дозах, при наличии гипонатриемии, двустороннего стеноза почечных артерий, стеноза преобладающей почечной артерии, одной почки и после трансплантации почки. При этих состояниях повышается секреция ренина и уровень ангиотензина II, который вызывает селективное сужение эфферентной артериолы клубочков и поддерживает СКФ. Ингибиторы АПФ снижают уровень ангиотензина II, расширяют эфферентные артериолы и снижают клубочковую фильтрацию, что приводит к росту уровня креатинина. Риск острой почечной недостаточности при лечении ингибиторами АПФ особенно высокий у пожилых пациентов с застойной сердечной недостаточностью. После отмены ингибиторов АПФ функция почек фактически у всех пациентов восстанавливается [8, 52].
Ангионевротический отек – это редкий побочный эффект, однако он может создавать угрозу для жизни. Симптомы его варьируют от легких желудочно-кишечных нарушений (тошнота, рвота, диарея, колики) до тяжелой одышки, связанной с отеком гортани, и смерти. Ангионевротический отек чаще возникает в течение первого месяца терапии, а также у афроамериканцев. Проявления исчезают в течение нескольких часов после отмены ингибитора АПФ [3, 17, 19, 33]. Причиной ангионевротического отека считают накопление брадикинина и его метаболита – десаргининбрадикинина и ингибирование инактиватора эстеразы комплемента-1.
Все представители группы иАПФ относятся к категории D (FDA) применения препаратов в период беременности и не должны назначаться беременным женщинам. Женщин детородного возраста, которым назначается лизиноприл, необходимо предупредить о необходимости контрацепции и немедленной отмене препаратов в случае возникновения беременности.
Переносимость иАПФ у большинства пациентов хорошая. Об этом свидетельствует и то, что ЛС, влияющие на систему ренин – ангиотензин, занимают третье место в ТОП-10 анатомо-терапевтических групп на фармацевтическом рынке Республики Беларусь в целом и второе место в розничном секторе [14]. Наиболее популярным представителем группы в ТОП-10 МНН на фармацевтическом рынке 2014 г. был лизиноприл: девятая позиция среди препаратов в целом и третья – в розничном секторе.
Фармакокинетические особенности лизиноприла (гидрофильность, отсутствие связи с белками плазмы) способствуют предсказуемости терапевтического эффекта в назначенной дозе. Лизиноприл является не пролекарством, в отличие от прочих представителей иАПФ (за исключением каптоприла), а изначально активным гидрофильным лекарственным средством. Препарат выводится из организма в неизмененном виде через почки. Печень в процессах метаболизма, инактивации и выведения лизиноприла не участвует.
Таким образом, иАПФ – наиболее значимый класс лекарственных средств в лечении пациентов с АГ, СН, СД, нефропатией, ИБС. Лизиноприл – один из самых исследованных в клинических испытаниях препаратов. Он обладает отличными фармакокинетическими характеристиками: отсутствие метаболизма в печени, гидрофильность, отсутствие влияния пищи на всасывание, выведение почками. В определенных клинических ситуациях лизиноприл можно считать препаратом первого выбора. Лизиноприл предпочтителен у пациентов с нарушением жирового обмена, заболеваниями печени, а также у лиц, уже принимающих потенциально гепатотоксичные или изменяющие метаболизм печеночных ферментов препараты. Таким образом, лизиноприл, благодаря своим уникальным свойствам, по праву остается лидером среди иАПФ длительного действия.
Л И Т Е Р А Т У Р А
1. Артериальная гипертензия и высокий риск сердечно-сосудистых осложнений: фокус на лизиноприл [Электрон. ресурс] / А.Г.Евдокимова [и др.] // Трудный пациент. – 2010. – №11. – Режим доступа: http://www.t-pacient.ru/ archive/tp11-10/ tp11-10_709.html
2. Диротон. Инструкция по применению лекарственного средства для специалистов. Приказ Министерства здравоохранения Республики Беларусь №128 от 06.02.2012.
3. Заключение экспертов Европейского Общества Кардиологов по применению ингибиторов ангиотензинпревращающего фермента при сердечно-сосудистых заболеваниях. Рабочая группа по ингибиторам АПФ Европейского общества кардиологов (J.Lopez-Sendon и др.) // Рациональная фармакотерапия в кардиологии. – 2005. – №1. – С.49–69.
4. Клиническая фармакокинетика. Практика дозирования лекарств / Ю.Б.Белоусов, К.Г.Гуревич – М., 2005. – 288 с.
5. Лазебник Л.Б., Михеева О.М., Комиссаренко И.А. // Лечащий Врач. – 2012. – №7.
6. Маколкин В.И. // РМЖ. – 2005. – №26. – С.1721–1727.
7. Михеева О.М., Комиссаренко И.А., Дроздов В.Н. и др. // Consilium medicum. – 2007. – №9 (11). – С.72–76.
8. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр) // Сердечная недостаточность. – 2013. – Т.14, №7 (81). – С.379–472.
9. Национальные рекомендации. Диагностика, лечение и профилактика артериальной гипертензии. – Минск, 2010. – 52 с.
10. Приказ Министерства здравоохранения Республики Беларусь от 02.07.2013 №764.
11. Приложение №1 к Постановлению Министерства здравоохранения Республики Беларусь 30 декабря 2014 г. №117.
12. Приложение №2 к Постановлению Министерства здравоохранения Республики Беларусь 30 декабря 2014 г. №117.
13. Роль ингибиторов ангиотензинпревращающего фермента в лечении артериальной гипертензии: фокус на лизиноприл / Г.А.Барышникова, И.И.Степанова, Н.В.Чупрова // Лечащий врач. – 2013. – №2. Электрон. ресурс: http://www.lvrach.ru/ 2013/02/15435617/
14. Фармацевтический рынок Республики Беларусь. Электрон. доступ: www.intellix.by/ pdf/2014_Intellix.pdf
15. Шустваль Н.Ф., Малый В.П., Пеньков Д.Б. // Укр. мед. журн. – 2004. – №1 (39). – С.45–50.
16. Ahuja T.S., Freeman D., Mahnken J.D. et al. // Am. J. Nephrot. – 2000. – Vol.20. – P.268–272.
17. Baram M., Kommuri A., Sellers S.A., Cohn J.R. // J. Allergy Clin. Immunol. Pract. – 2013. – Vol.1(5). – P.442–445. doi: 10.1016/j.jaip.2013.07.005.
18. Black H., Davis B. // J. Hypertens. – 2005. – Vol.23 (Suppl.2). – S.146.
19. Brown N., Ray W., Snowden M. et al. // Clin. Pharmacol. Ther. – 1996. – Vol.60. – P.8–13.
20. Charton V., Dotlow S., Fidel J. et al. // J. Clin. Pharmacol. – 1995. – Vol.39. – P.125–129.
21. Cunha V., Tham D.M., Martin McNulty et al. // Atherosclerosis. – 2005. –Vol.178. – P.9–17
22. Davis B.R., Culter J.A., Gordon D.J. // Am. J. Hypertens. – 1996. –Vol.9. – P.342–360.
23. Diamant M., Vincent H. H. // J. Hum. Hypertens. – 1999. – Vol.13 (6). – P.405–412.
24. Dickstein K., Aarsland T., Woie L. et al. // Am. Heart J. – 1986. – Vol.112 (1). – P.121–129.
25. EUCLID Study Group. / Effect of lisinopril on progression of retinopathy in normotensive people with type 1 diabetes // Lancet. – 1998. – Vol.351. – P.28–31.
26. Giannettasio C, Grassi G, Seravalle G et al. // Am. Heart J. – 1989. – Vol.117. – P.740–745.
27. GISSI-3: effects of lisinopril and transdermal glyceryltrinitrate singly and together on 6week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico // Lancet. – 1994. – Vol.343 (8906). – P.1115–1122.
28. Heran B.S., Wong M.M.Y., Heran I.K., Wright J.M. // Blood pressure lowering ef?cacy of angiotensin converting enzyme (ACE) inhibitors for primary hypertension. Cochrane Database of Systematic Reviews. – 2008, Issue 4. Art. No: CD003823. DOI. –10.1002/14651858.CD003823.pub2.
29. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58050 patients with suspected acute myocardial infarction. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group // Lancet. – 1995. – Vol.345 (8951). – P.669–685
30. Kereiakes D.J., Teirstein P.S., Sarembock I.J. et al. // J. Am. Coll. Cardiol. – 2007. – Vol.50 (16). – P.1598–1603.
31. Malacco E., Santonastaso M., Vari N.A. et al. // Clin. Ther. – 2004. – Vol.26 (6). – P.855–865.
32. Mancia G., Zanchetti A., Agabiti-Rosei E. et al. // Circulation. – 1997. – Vol.95 (6). – P.1464–1470.
33. Nikpoor B.I., Duan Q.L., Rouleau G.A. // Expert Opin. Pharmacother. – 2005. – Vol.6(11). – P.1851–1856.
34. Opie L.H. Angiotensin converting enzyme inhibitors. – 3rd ed. – New York, 1999.
35. Packer M., Poole-Wilson P.A., Armstrong P.W. et al. // Circulation. – 1999. – Vol.100 (23). – P.2312–2318.
36. Paolisso G.I., Gambardella A., Verza M. et al. // J. Hum. Hypertens. – 1992. – Vol.6 (3). – P.175–179.
37. Parving H. H. // J. Diabetes Complications. – 1996. – Vol.10 (3). – P.133–135.
38. Pfeffer M.A., Braunwald E., Moye L.A. et al. // N. Engl. J. Med. – 1992. – Vol.327 (10). – P.669–677.
39. Raimondo D., Tuttolomondo A., Butta C. et al. // Curr. Pharm. Des. – 2012. – Vol.18. – P.4385–4413.
40. Rizzoni D., Muiesan M. L., Porteri E. et al. // J. Hypertension. –1997. – Vol.15. – P.197–204.
41. Schiffrin E., Deng L. // Hypertension. – 1995. – Vol.25. – P.699–703.
42. Schmeisser A., Soehnlein O., Illmer T. et al. // Biochem. Biophys. Res. Commun. – 2004. – Vol.325. – P.532–540.
43. Schmieder R.E., Martus P., Klingbeil A. // JAMA. – 1996. – Vol.275. – P.1507–1513.
44. Soehnlein O., Schmeisser A., Cicha I. et al. // J. Vasc. Res. – 2005. – Vol.42. – P.399–407.
45. Stergiou G.S., Efstathiou S.P., Roussias L.G. et. al. // J. Cardiovasc. Pharmacol. – 2003. –Vol.42 (4). – P.491–496.
46. Terpstra W.F., May J.F., Smit A.J. et al. // J. Hypertens. – 2001. – Vol.19 (2). – P.303–309.
47. Thadei S., Virdis A., Ghiadoni L. et al. // J. Hypertens. – 1998. – Vol.16. – P.447–456.
48. The RALES investigators. Effectiveness of spironolactone added to an angiotensin-converting enzyme inhibitor and a loop diuretic for severe chronic congestive heart failure. (The randomized aldactone evaluation study: RALES) // Am. J. Cardioi. – 1996. – Vol.78. – P.902–907.
49. Torres V.E., Abebe K.Z., Chapman A.B. et al. // N. Engl. J. Med. – 2014. – Vol.371 (24). – P.2267–2276.
50. Visser L.E., Stricker B.H., van der Velden J. et al. // J. Clin. Epidemic. – 1995. – Vol.48. – P.851–857.
51. Wood R. // J. Clin. Pharmacol. – 1995. – Vol.39. – P.265–270.
52. Wynckel A., Ebikili B., Melin J.-P. et al. // Am.J. Hypertens. – 1998. – Vol.11. – P.1080–1086.
Медицинские новости. – 2015. – №4. – С. 22-27.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.