Samoilovich E.O.
Republican Research and Practical Center for Epidemiology and Microbiology, Minsk
Surneillance for polio-like illness among children in the Republic of Belarus
Резюме. В течение 1996–2013 гг. при исследовании двух образцов стула от 813 детей с синдромом острого вялого паралича (ОВП) вакцинные полиовирусы (ПВ) были изолированы от 47 (5,8%) детей, неполиомиелитные вирусы – от 45 (5,5%) детей. На основании клинико-эпидемиологических данных и результатов вирусологических исследований 12 случаев ОВП были классифицированы как вакциноассоциированный полиомиелит (ВАПП), 801 – как ОВП неполиомиелитной этиологии. Из 12 случаев ВАПП 11 были выявлены в 1996–2001 гг., когда для иммунизации использовалась только живая оральная вакцина, и только 1 случай у иммунодефицитного ребенка – в период 2002–2012 гг. при применении комбинированной схемы иммунизации. Идентифицированные неполиомиелитные вирусы, изолированные от детей с ОВП, были представлены вирусами Коксаки В трех серогрупп (Коксаки В1 – 3 пробы, Коксаки В5 – 7, Коксаки В4 – 2), вирусами Экхо шести серогрупп (Экхо 11 – 6 проб, Экхо 24 – 3, Экхо 7 – 2, Экхо 25 – 4, Экхо 6 – 2, Экхо 14 – 1), аденовирусами (обнаружены в 13 пробах). Не во всех случаях выявленные вирусы были этиологическими агентами ОВП. Наиболее вероятной их этиологическая роль была в случаях ОВП с выделением вирусов Коксаки В4, Экхо 25 и Коксаки В5.
Ключевые слова: полиомиелит, вакцинация, вакциноассоциированный паралитический полиомиелит, полиовирус, неполиомиелитные вирусы.
Медицинские новости. – 2014. – №5. – С. 71–74.
Summary. Within 1996–2012 in Belarus 813 children with acute flaccid paralysis (AFP) syndrome were revealed and virologicaly examinated. Vaccine polioviruses were isolated from 47 (5.8%) of them, non-polio viruses – from 45 (5.5%). According to clinico-epidemiological data and results of virus investigations 12 AFP cases were classified as vaccine-associated poliomyelitis (VAPP), 801 – as non-polio AFP. From 12 VAPP cases 11 were reported in 1996–2001, when only live oral polio vaccine were used for immunization, and only one VAPP case in child with immunodeficiency were reported in 2002–2013 when combined vaccination schedule was implemented. Identified 44 non-polio viruses, isolated from AFP cases, were belonged to Coxsackie viruses of 3 serotypes (type B1 – in 3 samples, type В5 – in 7 samples, type В4 – in 2 samples), to Echo viruses of 6 serotypes (Echo11 – in 6 samples, Echo 24 – in 3 samples, Echo 7 – in 2 samples, Echo 25 – in 4 samples, Echo 6 – in 2 samples, Echo 14 – in 1 sample), to adenoviruses – in 13 samples. Not in all cases isolated viruses were causative agent of AFP. The most probably it was in case of isolation Coxsakie virus B4, Echo virus 25, Coxsakie virus B5.
Keywords: poliomyelitis, vaccination, vaccine-associated paralytic poliomyelitis, poliovirus, non-polio viruses.
Meditsinskie novosti. – 2014. – N5. – P. 71–74.
Несмотря на достигнутые успехи в борьбе с полиомиелитом, в мире все еще ежегодно регистрируются случаи паралитического полиомиелита, вызванные диким полиовирусом (ПВ): 2009 г. – 1604, 2010 г. – 1352, 2011 г. – 650, 2012 г. – 223, 2013 г. – 400 (по данным ВОЗ на 18.02.2014). Три страны (Нигерия, Афганистан, Пакистан) остаются эндемичными по этой инфекции и являются источником импортации диких ПВ в другие страны [1]. По причине достаточно частых завозов дикого ПВ в страны, которые были свободными от этой инфекции, в отдельные годы число случаев полиомиелита, зарегистрированных в неэндемичных странах, превышало число случаев, зарегистрированных в эндемичных странах (2010 г.: 232 – в эндемичных странах и 1120 – в неэндемичных; 2013 г.: 160 – в эндемичных, 243 – в неэндемичных). Так, Европейский регион ВОЗ, сертифицированный как свободный от полиомиелита 21 июня 2002 г., в 2010 г. столкнулся с завозом дикого ПВ, что привело к вспышке полиомиелита в Таджикистане (460 случаев, 26 – с летальным исходом) и резко повысило вероятность появления новых очагов заболевания в других странах региона. Как показали результаты молекулярно-генетического исследования ПВ, выделенного в Таджикистане, он был завезен из Индии. Вспышка полиомиелита в Таджикистане привела к распространению вируса на соседние территории и возникновению там случаев заболевания (Россия – 14 случаев, Туркменистан – 3, Казахстан – 1) [2, 3].
Осложняет программу эрадикации по-лиомиелита еще одна проблема – существование вакцинородственных полиовирусов (ВРПВ), которые в значительной степени (1–15% нуклеотидов в VP1 области генома) дивергировали от вакцинных штаммов Себина и способны вызывать развитие паралитического полиомиелита [4, 5]. Вспышки, вызванные ВРПВ, были отмечены в Египте, Гаити, Доминиканской Республике, Филиппинах, Мадагаскаре, Китае, Индонезии, Нигерии, Индии, Камбодже и др. [6, 7].
События последнего десятилетия показывают, что вспышки полиомиелита, вызванные как диким ПВ, так и ВРПВ происходят там, где не в полной мере выполняются программы иммунизации против полиомиелита и имеет место снижение уровня популяционного иммунитета.
В соответствии с рекомендациями ВОЗ, одним из основных компонентов надзора за полиомиелитом в контексте инициативы глобальной ликвидации этого заболевания является надзор за полиомиелитоподобными заболеваниями, т.е. заболеваниями, протекающими с синдромом острого вялого паралича (ОВП) у детей до 15 лет [6]. Сложный клинический синдром ОВП может иметь множество возможных причин развития. Вирусологическое обследование больных с этим синдромом чрезвычайно важно для этиологической расшифровки диагноза.
ВОЗ разработаны основные критерии оценки качества проводимых мероприятий для обеспечения адекватного надзора за ОПВ: своевременное выявление и регистрация случаев, соблюдение сроков сбора и доставки образцов стула в лабораторию, изоляция и идентификация ПВ, молекулярно-генетическое изучения ПВ с целью определения происхождения (вакцинный, дикий, вакцинородственный) [6, 7].
Надзор за заболеваниями с синдромом ОВП по программе ЕРБ ВОЗ проводится в Республике Беларусь с 1996 г.
Цель исследования – обобщение результатов надзора за ОВП за период 1996–2013 гг. с анализом частоты выделения полиовирусов и неполиомиелитных кишечных вирусов от детей с ОВП.
Материалы и методы
В течение 1996–2013 гг. в Национальном референс-центре по полиомиелиту (РНПЦ эпидемиологии и микробиологии) проведено вирусологическое обследование 813 детей с синдромом ОВП из всех регионов Республики Беларусь.
Обследование проводили в соответствии с рекомендациями ВОЗ для национальных лабораторий по полиомиелиту [8]. От каждого ребенка исследовано по 2 пробы стула. Выделение вирусов осуществляли с использованием культур клеток RD и L20D, дополнительно также использовалась культура клеток Hep 2C. В целях идентификации ПВ полученные в любой из культур клеток вирусные изоляты исследовали в реакции нейтрализации с гипериммунными сыворотками к ПВ 1, 2 и 3 типов (ПВ1, ПВ2 и ПВ3 соответственно) производства Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН или Института общественного здоровья, Билтховен, Нидерланды). Изоляты, в которых ПВ не определялся, были исследованы в реакции нейтрализации с использованием набора типоспецифических сывороток к энтеровирусам (производства Института общественного здоровья, Билтховен, Нидерланды). Использование данных пулов сывороток позволяет идентифицировать наряду с ПВ всех трех серотипов вирусы Коксаки В1-6, Кокасаки А9 и вирусы Экхо 20 различных серотипов.
Начиная с 2009 г. вирусы, которые на культуре клеток Нер 2С давали типичный для аденовирусов цитопатический эффект (морфологически округлые клетки, напоминающие гроздья винограда), исследовали с применением коммерческой диагностической ПЦР тест-системы «АмплиСенс Adenovirus-Eph» (Россия) в соответствии с инструкцией производителя.
Внутритиповую дифференциацию полиовирусов (определение диких и вакцинных штаммов) выполняли на основании анализа полиморфизма длин рестрикционных фрагментов области генома, кодирующей структурный белок VP1 по методу, предложенному J. Balanant [9].
Секвенирование нуклеотидных последовательностей генома ПВ проводили с использованием набора «Big Dye Terminator v.3.1 cycle sequencing kit» на капиллярном секвенаторе Avant 3100 («Applied Biosystems», Нидерланды) или набора «Thermo SequenceTM CyTM 5 Dye Terminator Sequencing Kit» на секвенаторе ALFexpress II («Amersham Biosciences», США). Множественное выравнивание нуклеотидных и аминокислотных последовательностей проводили с помощью программы CLUSTAL W, version 1.83 [10].
Результаты и обсуждение
За 18 лет (1996–2013 гг.) проведения надзора за полиомиелитоподобными заболеваниями по программе ЕРБ ВОЗ в Республике Беларусь было выявлено 813 случаев заболевания с синдромом ОВП у детей до 15 лет. Ежегодно такие случаи выявлялись во всех 7 регионах страны, и показатель выявления полностью соответствовал критерию ВОЗ (не менее 1 случая на 100000 детей до 15 лет). В целом в масштабах страны средний показатель выявления заболеваний с синдромом ОВП среди детей до 15 лет за эти годы составил 2,7 на 100 000.
От всех детей с синдромом ОВП в соответствии с рекомендациями ВОЗ были собраны по 2 образца стула с интервалом в 24–48 часов и направлены на исследование в Национальный референс-центр по полиомиелиту. При проведении вирусологического исследования ПВ были изолированы от 47 (5,8%) детей, неполиомиелитные вирусы – от 45 (5,5%).
ОВП с выделением вакцинных ПВ. Поскольку живая оральная вакцина содержит вакцинные ПВ трех серотипов, из некоторых проб стула детей удавалось выделить ПВ двух и даже трех серотипов. В целом в течение всего периода наблюдения из 94 проб стула 47 детей было изолировано 119 ПВ, в том числе 27 (22,7%) ПВ1, 30 (33,6%) ПВ2 и 52 (43,7%) ПВ3. Как правило, в случае выделения ребенком ПВ вирус выделялся из обеих проб стула.
Проведенное молекулярное исследование всех 119 ПВ показало, что они имеют вакцинное происхождение. В основном вакцинные ПВ экскретировали дети в возрасте 0–2 лет. Из 47 детей, выделявших вакцинные ПВ, 41 (87,2%) относились к этой возрастной группе. Как известно, именно в этом возрасте дети получают основное количество (пять из шести) плановых прививок против полиомиелита, а выделение вакцинных ПВ в течение нескольких недель после применения живой оральной вакцины относится к обычным явлениям.
Частота изоляции вакцинных ПВ из проб стула детей с ОВП различалась при различных схемах иммунизации. В период 1996–2001 гг., когда для иммунизации применялась только оральная полиомиелитная вакцина, частота изоляции вакцинных ПВ составила 9,4% (23 из 243) и была существенно выше, чем в 2002–2013 гг. при применении комбинированной схемы иммунизации (начальная вакцинация с использованием инактивированной вакцины с последующим введением бустерных доз живой оральной вакцины), когда ПВ были изолированы от 24 из 570 детей (4,2%, р<0,05).
С учетом клинико-эпидемиологических данных и результатов изучения выделенных вирусов было установлено, что в 35 случаях ПВ не являлись этиологическими агентами паралича, 12 случаев были классифицированы как вакциноассоциированный паралитический полиомиелит (ВАПП). Подавляющее большинство, 11 из 12, случаев ВАПП было зарегистрировано в 1996–2001 гг. В расчете на число использованных доз ОПВ риск развития ВАПП в 1996–2001 гг. составлял 1 на 664 000 доз (1 на 811 000 доз – для реципиентов вакцины, 1 на 96 000 – для реципиентов первой дозы [11]) и заметно превышал показатели других стран: 1 случай на 3,3 млн доз (по результатам исследования в 8 странах в 1980–1984 гг.) [12], 1 случай на 2,6 млн доз и на 520 000 первых доз вакцины (США, 1973–1984 гг.) [13], 1 случай на 700 000 первых доз и на 6,9 млн последующих доз (США, 80-е гг.) [14], 1 случай на 2,39 млн первых доз и на 13,03 млн распределенных доз в Бразилии [15], 1 случай на 1,5–2,0 млн доз в Индии [16].
В такой ситуации переход на комбинированную схему иммунизации в Республике Беларусь был весьма оправдан. Начало применения комбинированной схемы было положено в 2000–2001 гг., когда в крупных городах республики инактивированная вакцина стала использоваться для первой прививки. С 2002 г. эта вакцина использовалась для первой прививки уже по всей стране, с 2004 г. – для 2 первых прививок, с 2007 г. – для трех первых прививок. За 12-летний период применения этой схемы риск развития ВАПП снизился в 23 раза (11 случаев ВАПП зарегистрировано в 1996–2001 гг., что в расчете на один год составляет 1,83 случая; 1 случай ВАПП зарегистрирован за период 2002–2013 гг., что в расчете на один год составляет 0,08 случая).
Единственный случай ВАПП, выявленный при применении комбинированной схемы иммунизации (2007 г., Гомельская область), был у ребенка в возрасте 3 лет с первичным В-клеточным иммунодефицитом (иммунодефицит диагностирован после развития ВАПП). Ребенок получил 5 прививок против полиомиелита (2 дозы инактивированной вакцины и 3 дозы живой оральной вакцины). ВАПП развился через 9 месяцев после получения последней дозы вакцины и через 10 дней после выписки из стационара, где ребенок находился по поводу пневмонии. Исследование проб, собранных на 5-й и 6-й день от начала паралича, показало присутствие в них вакцинного ПВ2. Выполненное с целью определения, является ли данный случай ВАПП контактным (во время последней госпитализации мальчик находился в палате с недавно привитым ОПВ ребенком), либо имела место длительная персистенция вируса в организме иммунодефицитного ребенка после введения оральной полиомиелитной вакцины, полногеномное секвенирование данного вируса позволило обнаружить 80 нуклеотидных замен, которые располагались на протяжении всего генома [17].
Уровень дивергенции вируса в области капсидного белка VP1 от его прародителя – штамма Себина серотипа 2 – составил 1,88%, что в соответствии с теорией молекулярных часов свидетельствует о его продолжительной (не менее 1 года) репликации в кишечнике ребенка. Таким образом, данные секверирования доказали, что данный случай ВАПП не являлся контактным, а был связан с длительной персистенцией вакцинного вируса Себина. Вероятнее всего, вирус присутствовал в организме ребенка со времени введения ему второй дозы ОПВ в возрасте 18 месяцев. Этот вирус стал первым ВРПВ, выявленным в Республике Беларусь, и входит в число нескольких десятков подобных ПВ от иммунодефицитных лиц, известных на сегодняшний день в мире. Полученные данные свидетельствуют о том, что для иммунодефицитных лиц риск развития ВАПП сохраняется и при применении комбинированной схемы вакцинации.
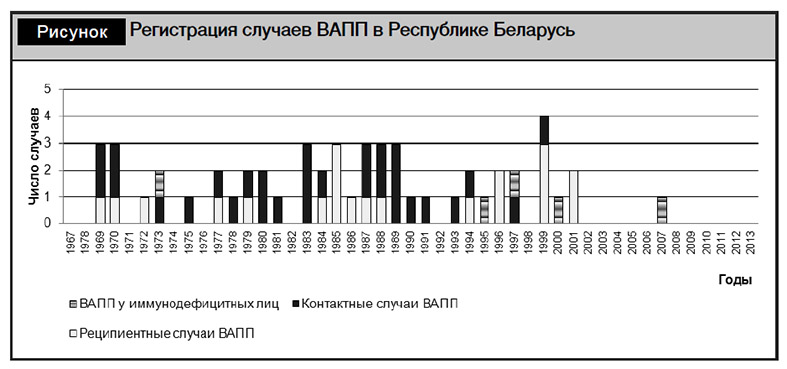
Следует отметить, что проведение надзора за полиомиелитом и регистрация случаев ВАПП в Беларуси начали осуществляться не с участия в программе ЕРБ ВОЗ по надзору за ОВП, а существенно раньше [17–19]. Первый случай ВАПП был зарегистрирован в 1969 г. Всего с 1969 г. по настоящее время в Республике Беларусь было выявлено 54 случая ВАПП (рисунок). В соответствии с общепринятой классификацией, 20 (37,0%) из них были классифицированы как реципиентные (развились после приема ОПВ), 29 (53,7%) – как контактные (развились в результате инфицирования вакцинными ПВ от недавно привитых лиц), 5 (9,3%) – как случаи ВАПП у иммунодефицитных лиц. Четыре из 5 случаев ВАПП у иммунодефицитных лиц были выявлены начиная с 1995 г. и позднее, что в первую очередь связано с возросшими возможностями иммунологического обследования в последние два десятилетия в сравнении с предыдущим периодом наблюдения.
ОВП с выделением неполиомиелитных вирусов. Из 45 случаев ОВП с выделением неполиомиелитных вирусов вирус был изолирован из обеих исследованных проб стула в 27 случаях, в 18 случаях только одна из исследованных проб содержала вирус.
Ежегодная частота изоляции неполиомиелитных вирусов в 1996–1999 гг. составляла от 10 до 18,5% [18] и была существенно более высокой, чем в 2000–2012 гг., когда она составляла от 0 до 8,7%.
В результате проведенного с помощью описанной в разделе «Материалы и методы» методологии исследования было идентифицировано 44 вируса, изолированных от 26 детей. Вирусы Коксаки были обнаружены в 12 пробах стула 7 детей (Коксаки В1 – 3 пробы, Коксаки В5 – 7, Коксаки В4 – 2). Вирусы Экхо обнаружены в 17 пробах стула 10 детей (Экхо 11 – 6 проб, Экхо 24 – 3, Экхо 7 – 2, Экхо 25 – 4, Экхо 6 – 2). От одного ребенка, обследованного только через 1,5 месяца после начала паралича, из первой пробы был изолирован вирус Коксаки В5, из второй – Экхо 14. Аденовирусы были обнаружены в 13 пробах стула 8 детей. В целом среди 44 идентифицированных изолятов вирусы Коксаки составили 29,5%, вирусы Экхо – 40,9%, аденовирусы – 29,5%. Среди вирусов Коксаки наиболее часто выделялся вирус серотипа В5, среди вирусов Экхо – серотипа 11.
Ввиду высокой частоты бессимптомного выделения кишечных вирусов из стула, их роль в этиологии спорадических случаев ОВП труднодоказуема. Во многих случаях обнаружение неполиомиелитного вируса в образце стула ребенка являлось «случайной» находкой, совпавшей по времени с возникновением паралича, обусловленного другой причиной. Зачастую неполиомиелитные вирусы присутствовали только в одной из двух исследованных проб стула; цитопатический эффект при первичном заражении культуры клеток развивался медленно (на 4–5 дней) и был слабовыраженным либо развивался только в слепом пассаже, что свидетельствует о низкой концентрации вируса в образце стула.
В нескольких случаях этиологическая роль неполиомиелитных энтеровирусов представлялась наиболее вероятной: в случае полиомиелитоподобного заболевания с незначительным остаточным параличом ноги и выделением вируса Коксаки В4 (1998 г.), в случае энцефалита с мозжечковой атаксией и выделением вируса Экхо 25 (2000 г.), в случае полинейропатии с нижним вялым парапарезом и выделением вируса Коксаки В5 (2012 г.). Во всех этих случаях развитию паралича способствовал выраженный общеинфекционный синдром (повышение температуры тела, выраженная интоксикация). В первом и втором случаях в сыворотках крови детей были выявлены нейтрализующие антитела к аутоштаммам в высоких титрах. В случае полинейропатии с выделением вируса Коксаки В5 у ребенка 3 лет аутоантитела исследованы не были. Этот случай совпал с высокой частотой обнаружения вируса Коксаки В5 в сточных водах в данном регионе. Выполненное секвенирование участка генома, кодирующего VP3/VP1/2A белки вируса Коксаки В5, выделенного от ребенка с синдромом ОВП, показало, что наиболее близкородственным ему (98% гомологии) является изолят Коксаки В5, выделенный в 2011 г. в Китае в провинции Henan во время вспышки вирусных энцефалитов.
Таким образом, проведенные исследования показали, что ни один случай полиомиелитоподобного заболевания у детей до 15 лет не был обусловлен диким ПВ. Среди 813 случаев ОВП, выявленных в период 1996–2013 гг. у детей до 15 лет, 12 были ВАПП, 801 – ОВП неполиомиелитной этиологии. Переход на комбинированную схему иммунизации против полиомиелита (начальная вакцинация с использованием инактивированной вакцины с последующим введением бустерных доз живой оральной вакцины) существенно снизил риск развития ВАПП. За 12 лет применения этой схемы (2002–2013) был выявлен единичный случай ВАПП у ребенка с иммунодефицитом. Только полный переход на применение инактивированный вакцины способен полностью исключить риск развития ВАПП, в том числе и у иммунодефицитных лиц.
Л И Т Е Р А Т У Р А
1. Progress towards global interruption of wild poliovirus transmission, January 2012 – March 2013 // Weekly epidemiological record. – 2013. – №18. – P.181–188
2. Иванова О.Е. // Журн. микробиол., эпидемиол. и иммунология. – 2011. – N3. – С.110–114.
3. WHO Country Office Tajikistan; WHO Regional Office for Europe; European Centre for Disease Prevention and Control / Outbreak of poliomyelitis in Tajikistan in 2010: risk for importation and impact on polio surveillance in Europe? // Euro Surveil. – 2010. – N29. – P.19558.
4. Kew O.M., Sutter R.W., de Gourille E.M. et al. // Annu. Rev. Microbiol. – 2005. – Vol.59. – P.587–635.
5. WHO. Laboratory surveillance for wild and vaccine-derived polioviruses, Jan. 2007 – June 2008// Weekly Epidemiol. Rec. – 2008. – Vol.83. – P.321–328.
6. WHO. Acute flaccid paralysis (AFP) surveillance: the surveillance strategy for poliomyelitis eradication // Weekly Epidemiol. Rec. – 1998. – Vol.73. – P.113–117.
7. Aylward R.B., Hull H.F., Cochi S.L. et al. // Bull. WHO. – 2000. – Vol.78, N3. – P.285–297.
8. Руководство по лабораторным исследованиям полиомиелита. – Женева: ВОЗ, 2005. – 112 с.
9. Balanant J., Guillot S., Candera A.F. et al. // Virology. – 1991. – Vol.184. – P.645–654.
10. Thompson, J.D., Higgins D.G., Gibson T.J. // Nucleic. Acids. Res. – 1994. – Vol.22, N22. – P.4673–4680.
11. Ермолович, М.А., СамойловичЕ.О., Фельдман Э.В. // Весцi НАН Беларусi (серыя медыка-бiялагiчных навук). – 2003. – №4. – С.95–101.
12. Esteves K. Safety of oral poliomyelitis vaccine: Results of a WHO enquiry // Bull. WHO. – 1988. – Vol.66, N6. – P.57–64.
13. Nkowane B.M., Wassilak S.G.F., Orenstein W.A. et al. // JAMA. – 1987. – Vol.257. – P.1335–1340.
14. Strebel P.M., Sutter R.W., Cochi S.L. et al. // Clin. Infect. Dis. – 1992. – Vol.14, N2. – P.568–579.
15. de Oliveira L.H., Struchier C.J. // Intern. J. Epidemiol. – 2000. – Vol.29, N4. – P.757–763.
16. Mittal S.K., Mathew J.L. // Indian J. Pediatr. – 2003. – Vol.70, N7. – P.573–577.
17. Yakovenko M.L., Korotkova E.A., Ivanova O.E. et al. // J. Virol. – 2009. – Vol.83, N7. – P.3402–3406.
18. ФельдманЭ.В., СамойловичЕ.О., ВотяковВ.И., ТитовЛ.П. // Весцi НАН Беларусi. Сер. мед.-бiял. навук. – 2003. – №4. – С.140–145.
19. Ермолович М.А., Фельдман Э.В., Самойлович Е.О. // Мед. новости. - 2003. – №12. – C.100–103.
20. Samoilovich E.O., Feldman E.V., Yermalovich M.A. et al. // Centr. Eur. J. Public Health. – 2003. – Vol.11, N4. – P.213–218.
21. СамойловичЕ.О., СвирчевскаяЕ.Ю., ЕрмоловичМ.А. и др. // Бел. мед. журн. – 2003. – №4. – С.92–95.
Медицинские новости. – 2013. – №5. – С. 71-74.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.