Uglova T.A.
Belarusian Research Center for Pediatric Oncology Hematology and Immunology, Borovlyani, Minsk region
Subcutaneous immunoglobulin as replacement therapy of children with primary immunodeficiencies
Резюме. Подкожное введение препаратов «Иммуноглобулин человека нормальный» при заместительной терапии у пациентов с первичными иммунодефицитами – эффективный, безопасный и хорошо переносимый метод терапии. Представлен анализ эффективности и безопасности 52-недельного применения препарата иммуноглобулина для подкожного введения «Гамманорм» в домашних условиях у 8 пациентов детского возраста с врожденным нарушением образования антител. Все пациенты предварительно получали в течение не менее 52 недель препараты иммуноглобулина для внутривенного введения. Медиана уровней IgG в сыворотке крови была выше в период применения Гамманорма (6,9 г/л) по сравнению с периодом применения иммуноглобулина для внутривенного введения (4,1 г/л). В период применения иммуноглобулина для подкожного введения ни у одного пациента не было тяжелых инфекций, частота инфекционных осложнений составила 2,1 эпизод/пациент/год. Профиль нежелательных явлений и реакций свидетельствует о хорошей толерантности и безопасности у детей препарата иммуноглобулина для подкожного введения «Гамманорм».
Ключевые слова: иммуноглобулин, подкожное введение, внутривенное введение, дети, первичный иммунодефицит, заместительная терапия.
Медицинские новости. – 2014. – №5. – С. 47–51.
Summary. Subcutaneous immunoglobulin infusions are effective, safe and well-tolerated in the treatment of primary immunodeficiencies. We investigated the efficacy and safety of home therapy with human immunoglobulin G preparation (Gammanorm) during subcutaneous infusions in 8 children with primary immunodeficiencies. All children had previously received intravenous immunoglobulins (no less than 52 weeks). Median serum IgG levels exceeded those during previous intravenous therapy (6.9 g/l and 4.1 g/l respectively). During the efficacy evaluation period none of the children had a serious bacterial infection, the mean overall infection rate/patient/year was 2.1. The adverse event profile confirmed the tolerance and safety of subcutaneous immunoglobulin therapy in children.
Keywords: immunoglobulin, subcutaneous, intravenous, children, primary immunodeficiency, replacement therapy
Meditsinskie novosti. – 2014. – N5. – P. 47–51.
Первичные иммунодефициты (ПИД) – гетерогенная генетически детерминированная группа нарушений одного или нескольких компонентов иммунной системы, которые могут манифестировать в различном возрасте [20]. Описано около 200 первичных иммунодефицитов, генетические дефекты идентифицированы более чем у 140. По данным ESID (Европейского общества по первичным иммунодефицитам), распространенность ПИД составляет 1 случай на 25 000–100 000 населения, а селективный дефицит IgА – 1 случай на 500–700 человек.
Более 50% в структуре ПИД приходится на ПИД с нарушением антителообразования (табл. 1), которые чаще диагностируются в детском возрасте [22]. Помимо частых тяжелых рецидивирующих инфекций респираторного и желудочно-кишечного трактов, обусловленных бактериальными или оппортунистическими инфекционными агентами, у пациентов с нарушением антителообразования отмечается повышенная частота аутоиммунных и лимфопролиферативных заболеваний [5, 7, 8, 16, 17], что связывают со снижением функции дендритных клеток [4, 19].
Таблица 1. Первичные иммунодефициты с нарушением продукции антител [2]
|
Нарушение
|
Мутация (ген)
|
Показания
к заместительной терапии
препаратами Ig
|
|
Агаммаглобулинемия
|
|
Х-сцепленная агаммаглобулинемия
|
Btk
|
да
|
|
Аутосомно-рецессивная
агаммаглобулинемия
|
IGHM, CD79A, CD79B, BLNK
|
да
|
|
Общая вариабельная иммунная недостаточность (ОВИН)
|
|
Индуцирующий ко-стимулирующий протеин
|
ICOS
|
да
|
|
Дефект CD19
|
CD19
|
да
|
|
Дефект СD20
|
СD20
|
да
|
|
Дефект TACI
|
TNFRSFI3B
|
да
|
|
Дефект BAFF - рецептора
|
TNFRSFI3C
|
да
|
|
Дефект CD 81
|
CD81
|
да
|
|
ОВИН
|
не известен
|
да
|
|
Другие ПИД с нарушением продукции антител
|
|
Селективный дефицит IgA
|
не известен
|
нет
|
|
Дефицит субклассов IgG
|
не известен
|
нет
|
|
Транзиторная гипогаммаглобулинемия раннего детского возраста
|
не известен
|
нет
|
|
Гипер IgМ синдром Х-сцепленный
|
CD40L
|
да
|
|
Гипер IgМ синдром, аутосомно-рецессивный
|
AID, UNG
|
да
|
|
Тяжелая комбинированная иммунная
недостаточность
|
различные
|
да
|
|
Синдром Вискотта – Олдрича
|
WASP
|
да
|
|
Атаксия-телеангиэктазия
|
АТМ на 11q22-q23
|
у пациентов с низким уровнем IgG
|
|
Ретикулярный дисгенез
|
AK2
|
у пациентов с низким уровнем IgG
|
|
Синдром Ди Джорджи
|
делеция 22q11.2/10p13
|
у пациентов с низким уровнем IgG
|
П р и м е ч а н и е : Btk – тирозин киназа Брутона; TACI – трансмембранный активатор и партнер кальциевого модулятора и лиганда циклофиллина; TNFRSF – рецепторы семейства фактора некроза опухолей; BAFF – фактор активации В-клеток; CD40L – лиганд CD40, AID – активация индуцированной цитидиндезаминазы; UNG – глюкозилаза урацил-ДНК; WASP – протеин синдрома Вискотта–Олдрича; ATM – ген «атаксия телеангиэктазия мутировал», АК2 – аденилкиназа 2.
Стандартная лечебная тактика у пациентов с врожденным нарушением антителообразования – пожизненная заместительная терапия препаратами «Иммуноглобулин человека нормальный», которые вводятся внутривенно или подкожно.
Внутривенное введение препаратов иммуноглобулина (Ig) у данной категории пациентов применяется с 80-х годов прошлого столетия в дозе 0,3–0,4 г/кг каждые 3–4 недели. Установлено, что 10-летняя выживаемость больных с ОВИН при регулярном внутривенном введении Ig в дозе 0,4 г/кг/мес. составляет 78% при 10-летней выживаемости в общей популяции 97% [11]. Задержка начала заместительной терапии приводит к увеличению заболеваемости бактериальными инфекциями. Так, эпизод пневмонии перед началом заместительной терапии приводит к 10-кратному увеличению риска пневмонии после терапии [9, 14]. При постановке диагноза в 5 и 15 лет и, следовательно, позднем начале заместительной терапии кумулятивный риск развития хронического бронхолегочного процесса составляет 0,17 и 0,87 соответственно [18].
Препараты «Иммуноглобулин человека нормальный» для внутривенного введения (ВВИГ) получают из сыворотки большого количества доноров, что обеспечивает разнообразие антител [13]. Совершенствование процессов очистки при производстве ВВИГ позволило улучшить переносимость препаратов, а процессы инактивации и удаления вирусов и прионов снижают вероятность передачи заболеваний. Однако на каждом этапе производственного процесса, особенно при его модернизации, а также при изменении условий упаковки и транспортировки существует вероятность изменения структуры белка и, следовательно, биологической активности препарата ВВИГ, что может привести к изменению эффективности и переносимости [15, 21]. Различные препараты ВВИГ различаются по своему составу, что также обусловливает их различную эффективность и переносимость. Поэтому каждый препарат ВВИГ следует расценивать как уникальный. Препараты иммуноглобулина для внутривенного введения не являются генерическими и не являются взаимозаменяемыми.
Применение препаратов ВВИГ может сопровождаться развитием системных нежелательных явлений. Частота легких и умеренных системных нежелательных явлений (озноб, головная боль, лихорадка, миалгии, экзема, петехии, крапивница, боль в спине, тошнота, алопеция, изменения артериального давления, диарея) на одну инфузию составляет 5–15% [6]. Наиболее часто они встречаются у пациентов с врожденными нарушениями антителообразования при первых введениях препарата, а также у пациентов при наличии исходного хронического инфекционного процесса, и могут развиваться спустя несколько суток после инфузии ВВИГ [3]. Серьезные нежелательные явления, включающие в себя острую почечную недостаточность, инсульт, инфаркт миокарда, венозную тромбоэмболию, окклюзию центральной вены сетчатки, гемолиз, анафилактический шок, асептический менингит, встречаются редко, но потенциально опасны для жизни. Как правило, они развиваются у пациентов, имеющих факторы риска или предрасполагающие сопутствующие состояния (низкий уровень IgA, положительные серологические воспалительные маркеры, воспалительные заболевания, заболевания почек, наличие мигрени в анамнезе, не I (0) группа крови и др.). Вследствие потенциальной опасности развития тяжелых системных нежелательных явлений препараты ВВИГ вводятся в условиях дневного стационара или в стационаре круглосуточного пребывания, что не только приводит к увеличению затрат на лечение данной категории пациентов (прямых медицинских, выплат из социальных фондов), но и осложняет качество жизни как самого пациента, так и его близких родственников. Кроме того, внутривенное введение препаратов иммуноглобулина может быть проблематичным у некоторых пациентов из-за плохого венозного доступа, особенно в детском возрасте.
Применение препаратов иммуноглобулина для подкожного введения (ПКИГ) позволяет преодолеть эти ограничения. Многочисленными исследованиями доказана одинаковая эффективность в предотвращении инфекций у пациентов с врожденным нарушением образования антител препаратов иммуноглобулина для подкожного и для внутривенного введения, так как подкожное введение позволяет поддерживать стабильные уровни иммуноглобулина в сыворотке крови пациента без «эффекта впадины» в конце интервала введения [1, 10, 12]. Кроме того, отсутствие необходимости каждые 3–4 недели посещать лечебное учреждение для проведения внутривенной инфузии существенно снижает риск инфицирования, что актуально для пациентов с дефектами иммунитета. Более высокая концентрация иммуноглобулина в препарате (16,5%) по сравнению с препаратами ВВИГ (5–10%) позволяет уменьшить время проведения инфузии и сократить объем вводимой жидкости.
Подкожное введение – это удобный и безопасный путь введения, позволяющий родителям пациента или ему самому после обучения проводить инъекции в домашних условиях в удобное для всех время, таким образом значительно улучшая качество жизни больного и всей его семьи.
В Республике Беларусь зарегистрирован и разрешен к применению у детей только один препарат «Иммуноглобулин человека нормальный» для подкожного введения – Гамманорм, производства «Octapharma AB» (Швеция). Это готовый к употреблению прозрачный или слегка опалесцирующий раствор, производится из пула плазмы не менее 1000 доноров и содержит широкий спектр антител против инфекционных агентов. Распределение подклассов IgG близко к таковым в плазме здорового человека: IgG1 – 59%, IgG2 – 36%, IgG3 – 4,9%, IgG4 – 0,5%, IgA – до 82,5 мкг/мл. 1 мл Гамманорма содержит 165 мг нормального человеческого иммуноглобулина, 20 мг глицина, 2,5 мг натрия (натрия ацетата, натрия хлорида), полисорбат 80, воду для инъекций
Нами пронализирована эффективность и переносимость подкожного введения препарата «Гамманорм» у пациентов детского возраста с врожденным нарушением антителообразования.
Обследовано 8 пациентов в возрасте 7–18 лет (медиана 12 лет) с врожденным нарушением образования антител, которые в течение 52 недель получали Гамманорм. До начала терапии Гамманормом все пациенты получали регулярную заместительную терапию препаратами иммуноглобулина для внутривенного введения (Октагам) не менее 1 года (52 недель) и имели стабильный уровень IgG в сыворотке крови не менее 3,5 г/л. Гамманорм вводился еженедельно в дозе 0,1 г/кг (0,4 г/кг/мес.). Первое введение препарата осуществлялось через 3–4 недели после внутривенного введения Октагама. После нескольких введений в условиях дневного стационара под наблюдением медицинского персонала (от 2 до 4 недель) родители и пациенты сами вводили Гамманорм с использованием портативного насоса в домашних условиях, фиксируя дозу, время введения и нежелательные реакции в «Дневнике пациента». Препарат вводился в один или несколько участков, объем не превышал 15 мл на участок у детей с весом до 40 кг, и 25 мл на участок с весом более 40 кг (рис. 1). Скорость введения препарата составляла 15–20 мл/час на каждом участке инъекции.
Уровень IgG в сыворотке крови определяли иммунотурбодиметрическим методом на 0 день (остаточный уровень) и через 4, 12, 24, 36 и 52 недели после начала терапии Гамманормом. Физикальное обследование с оценкой жизненно важных функций организма пациента проводилось в эти же сроки. Критериями эффективности являлись уровень IgG в сыворотке крови и частота инфекционных эпизодов, в том числе тяжелых, требующих госпитализации и длительного назначения антибактериальной терапии. Критерии переносимости – частота серьезных нежелательных явлений, частота и степень выраженности системных и местных нежелательных реакций.
Статистическая обработка материала проведена с применением методов описательной статистики.
Таблица 2. Характеристика пациентов (n = 8) с первичным иммунодефицитом с нарушением образования антител, получавших заместительную терапию препаратом «Гамманорм»
|
Пациенты
|
1-й
|
2-й
|
3-й
|
4-й
|
5-й
|
6-й
|
7-й
|
8-й
|
|
Диагноз
|
Х-АГ
|
АГ-Р
|
Х-АГ
|
Х-АГ
|
Х-АГ
|
Х-АГ
|
ОВИН
|
ОВИН
|
|
Возраст (лет)
|
12
|
8
|
14
|
12
|
7
|
10
|
16
|
17
|
|
Пол
|
м
|
ж
|
м
|
м
|
м
|
м
|
ж
|
ж
|
|
Заместительная терапия ВВИГ (Октагам) (длительность 52 недели)
|
|
Доза г/кг/мес.
|
0,3
|
0,34
|
0,31
|
0,2
|
0,3
|
0,3
|
0,35
|
0,3
|
|
Доза г/кг/нед.
|
0,07
|
0,085
|
0,085
|
0,05
|
0,06
|
0,08
|
0,08
|
0,07
|
|
Кратность введения (дни)
|
32
|
33
|
32
|
30
|
30
|
28
|
42
|
27
|
|
IgG в сыворотке крови, г/л (М±?)
|
4,8±0,7
|
4,2±0,9
|
4,4±0,7
|
4,5±0,6
|
4,05±0,4
|
4,2±0,5
|
3,5±0,4
|
4,1±0,6
|
|
Количество инфекционных эпизодов/тяжелых
|
4/0
|
4/0
|
10/2
|
8/0
|
11/2
|
10/1
|
4/0
|
5/0
|
|
Заместительная терапия ПКИГ (Гамманорм) (длительность 52 недели)
|
|
Доза г/кг/нед.
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
0,1
|
|
IgG в сыворотке крови г/л (М±?)
|
6,9±1,1
|
7,04±0,4
|
7,2±1,9
|
9,1±1,7
|
5,65±0,4
|
7,65±2,1
|
7,4±1,4
|
6,7±1,3
|
|
Количество инфекционных эпизодов/тяжелых
|
1/0
|
2/0
|
2/0
|
3/0
|
4/0
|
2/0
|
1/0
|
2/0
|
|
Кратность ведения (дни)
|
7
|
7
|
7
|
7
|
7
|
7
|
7
|
7
|
П р и м е ч а н и е : Х-АГ – Х-сцепленная агаммаглобулинемия, АГ-Р – врожденная агаммаглобулинемия с аутосомно-рецесcивным наследованием, ОВИН – общая вариабельная иммунная недостаточность.
У 6 из 8 получавших Гамманорм пациентов диагностирована врожденная агаммаглобулинемия, у 2 – ОВИН (табл. 2). Диагностика врожденной агаммаглобулинемии основывалась на выявлении снижения (не менее 2 раз) в сыворотке крови IgG менее 2 г/л, IgA и IgM менее 0,2 г/л, снижение циркулирующих В-лимфоцитов (CD19+) менее 2% по данным проточной цитофлюориметрии. У всех пациентов с Х-сцепленной агаммаглобулинемией (Х-АГ) обнаружена мутация в гене Btk. Два пациента с врожденной агаммаглобулинемией до начала заместительной терапии имели хроническое неспецифическое заболевание легких. Диагноз острой вариабельной иммунной недостаточности устанавливался при снижении уровня IgG более двух стандартных отклонений от возрастной нормы при нормальном или сниженном числе В-лимфоцитов, отсутствии антител к группам крови, снижении или отсутствии «изотип-переключенных В-лимфоцитов памяти» (CD19+IgM-IgD-CD27+).
Все пациенты раньше получали препараты иммуноглобулина для внутривенного введения с интервалом 28–42 дня, удлинение интервалов введения было связано, как правило, с семейными обстоятельствами. Средняя доза препаратов иммуноглобулина составила 0,07 г/кг в неделю. Уровень IgG в сыворотке крови при заместительной терапии препаратами иммуноглобулина для внутривенного введения (Октагам) колебался от 3 до 5,7 г/л (4,19±0,66 г/л). Через месяц после начала терапии Гамманормом уровень IgG в сыворотке крови больных детей составил 7,12±0,8 г/л с колебаниями от 5,37 до 8,6 г/л, через полгода регулярного введения ПКИГ уровень сывороточного IgG оставался стабильным (рис. 2).
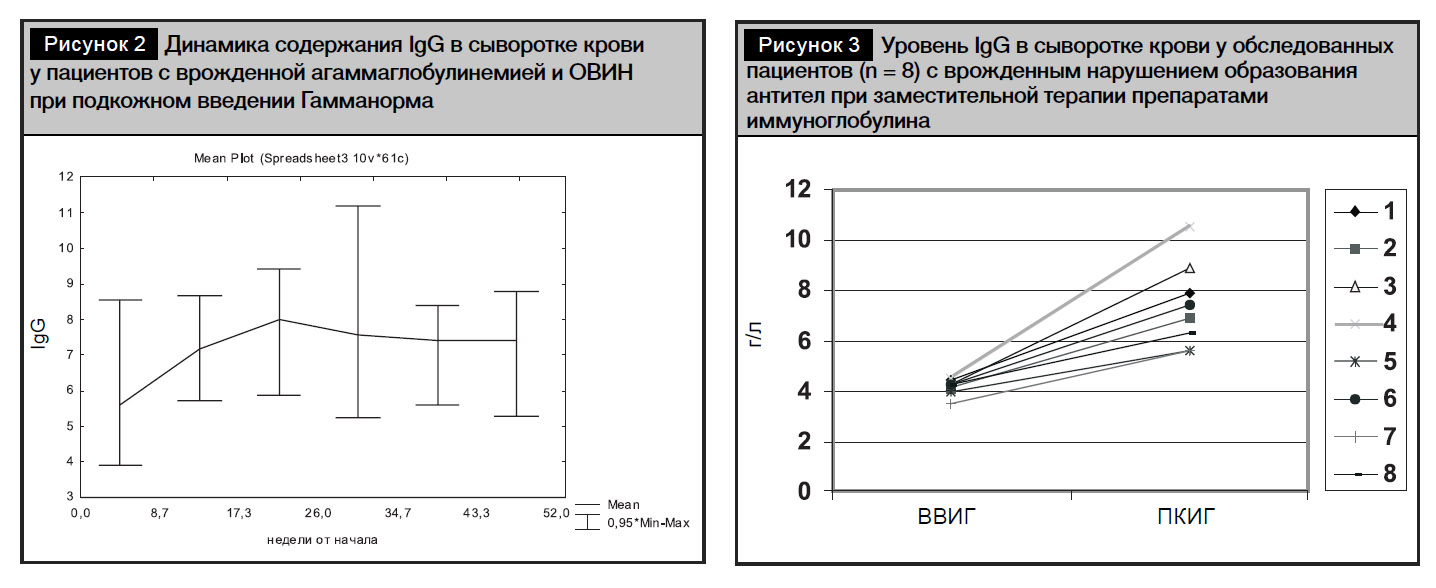
Нами не выявлено достоверных различий уровня IgG в сыворотке крови у пациентов с ПИД и нарушением образования антител при заместительной терапии Гамманормом в зависимости от возраста (р=0,786) и диагноза (р=0,823).
У всех пациентов уровень сывороточного IgG был выше при введении Гамманорма (Ме= 6,9 г/л) по сравнению с уровнями IgG на предыдущей терапии ВВИГ (Me= 4,2 г/л).
Индивидуальные уровни IgG в сыворотке крови у пациентов (n = 8) с врожденным нарушением образования антител после 52 недель заместительной терапии препаратами ВВИГ и ПКИГ представлены на рис. 3.
Более высокий уровень IgG в сыворотке крови у пациентов при применении Гамманорма по сравнению с уровнями Ig в течение предыдущей терапии препаратами ВВИГ можно объяснить регулярным введением препарата в домашних условиях, минимизацией влияния парамедицинских обстоятельств. Средняя месячная доза Гамманорма составила 140±25,8% (медиана 131%) среднемесячной дозы Октагама.
У всех пациентов, получавших Гамманорм, зафиксировано не менее 1 инфекционного эпизода, но ни один пациент не был госпитализирован в период наблюдения из-за тяжелого инфекционного процесса, в основном это были инфекции верхних дыхательных путей. Частота инфекционных эпизодов/пациент/год снизилась с 7,0 при применении ВВИГ до 2,1 при заместительной терапии ПКИГ. У одного пациента с хроническим бронхолегочным процессом отмечалась значительная положительная рентгенологическая динамика после трехмесячной заместительной терапии Гамманормом.
Нежелательные явления. В течение года не зарегистрировано как ни одного серьезного неблагоприятного события, так и ни одного системного нежелательного явления легкой и умеренной степени выраженности. Лишь у одного пациента с ОВИН нервозность, лабильность настроения в течение первых 4 недель заместительной терапии подкожным введением Гамманорма были расценены как вероятно связанные неблагоприятные события. Наиболее общими и частыми неблагоприятными явлениями были местная реакция на участках введения препарата, которая отмечалась у 7 из 8 пациентов. У всех больных реакция в области введения была умеренной интенсивности, сохранялась до 1 суток, не требовала медицинского вмешательства. Частота ее развития снижалась с течением времени: после 26 недель применения препарата практически отсутствовала.
В течение периода наблюдения (52 недели подкожного введения препарата «Гамманорм») не выявлено каких-либо клинически значимых изменений в биохимическом анализе крови, а также изменений жизненно важных функций организма пациентов.
Заключение. Подкожное введение препарата иммуноглобулина человека нормального (Гамманорма) для заместительной терапии у пациентов с ПИД в домашних условиях является безопасным и эффективным в отношении профилактики инфекционных осложнений и поддержания физиологического уровня IgG в сыворотке крови. Средние концентрации сывороточного IgG у пациентов увеличились в течение терапии ПКИГ по сравнению с уровнем IgG в период применения ВВИГ. Минимизация влияния парамедицинских обстоятельств на регулярность заместительной терапии, улучшение качества жизни пациента и его семьи, снижение частоты посещений лечебного учреждения – другие преимущества подкожного введения препаратов иммуноглобулина.
Л И Т Е Р А Т У Р А
1. Abrahamsen T.G., Sandersen H., Bustnes A. // Pediatrics. – 1996. – V.98. – P.1127–1131.
2. Al-Herz W., BousfihaA., Casanova J. // Front Immunol. – 2011. – V.2. – P.1–26.
3. Ballow M. // Immunol Res. – 2007. – V.38. – P.122–132.
4. Bayry J., Lacroix-Desmazes S., Kazatchkine M.D. et al. // Blood. – 2004. – V.104. – P.2441–2443.
5. Berger M. // Immunol. Allergy Clin. North. Am. – 2008. – V.28. – P.413–437.
6. Bonilla F.A. // J. Allergy Clin. Immunol. – 2008. – V.122. – P.1238–1239.
7. Buckley R.H. // N. Engl. J. Med. – 2000. – V.343. – P.1313–1324.
8. Chapel H., Geha R., Rosen F. // Clin. Exp. Immunol. – 2003. – V.132. – P.9–15.
9. Chapel H. // Curr. Opin. Allergy Clin. Immunol. – 2013. – V.13. – P.623–629.
10. Chapel H.M., Spickett G.P., Ericson D. at al. // J. Clin. Immunol. – 2000. – V.20. – P.94–100.
11. Cunningham-Rundles and Bodian // Clin. Immunol. – 1999. – V.92. – P.34–48.
12. Gardulf A., Nicolay U., Asensio O. et al. // J. Clin. Immunol. – 2006. –V.26. – Р.177–185.
13. Looney R.J., Huggins J. // Best. Pract. Res. Clin. Haematol. – 2006. – V.19. – P.3–25.
14. Lucas M. // J. Allergy Clin. Immunol. – 2010. – V.128. – P.1354–1360.
15. Martin T.D. // Int. Immunopharmacol. – 2006. – V.6. – P.517–522.
16. Ochs H.D., Smith C.I.E., Puck J.M. Primary immunodeficiency diseases: a molecular and genetic approach. – New York: Oxford University Press Inc, USA, 2007.
17. Park M.A., Li J.T., Hagan J.B. at al. // Lancet. – 2008. – V.372. – P.489–502.
18. Plebani A. // Clin. Immunol. – 2002. – V.104. – P.221–230.
19. Scott-Taylor T.H., Green M.R., Eren E., Webster A.D. // Clin. Exp. Immunol. – 2004. – V.138. – P.484.
20. Shehata N., Palda V., Bowen T. et al. // Transfus. Med. Rev. – 2010. – V.4. – P.28–50.
21. Siegel J. // Pharmacotherapy. – 2005. – V.25. – P.78–84.
22. Sorensen R.U., Moore C. // Pediatr. Clin. North Amer. – 2000. – P.47. – P.1225–1252.
Медицинские новости. – 2013. – №5. – С. 47-51.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.