Seliun Yu.A., Valentsiukevich A.V., Kaliadka M.G., Ostrovsky Yu.P.
Republican Scientific Practical Centre «Cardiology», Minsk, Belarus
Usage of prothrombin complex concentrate in differentiated therapy of hemostatic system disorders in heart transplantation
Резюме. Рассмотрен клинический случай коррекции нарушений системы гемостаза у пациента с терминальной сердечной недостаточностью во время операции ортотопической трансплантации сердца в Республиканском научно-практическом центре «Кардиология». Описаны преимущества использования концентрата протромбинового комплекса перед свежезамороженной плазмой. Показан алгоритм применения метода тромбоэластографии.
Ключевые слова: трансплантация сердца, концентрат протромбинового комплекса, Октаплекс®, тромбоэластография.
Медицинские новости. – 2013. – № 10. – С. 49–52.
Summary. This article was demonstrated a clinical case of the hemostatic system correction on patient with terminal heart failure during orthotopic heart transplantation in the Republican Scientific and Practical Center «Cardiology». The advantages of prothrombin complex concentrate compare to fresh frozen plasma were described. The algorithm of thrombelastography applying is introduced.
Keywords: Heart transplantation, prothrombin complex concentrate, Octaplex®, tromboelastography.
Meditsinskie novosti. – 2013. – N 10. – P. 49–52.
Трансплантация сердца является общепринятым радикальным методом лечения терминальной сердечной недостаточности (СН) [1]. Наиболее распространенными причинами терминальной СН у взрослых пациентов являются ишемическая болезнь сердца (ИБС) и кардиомиопатия [2]. Терминальная СН характеризуется необратимой тяжелой желудочковой дисфункцией, которая приводит к развитию низкого сердечного выброса (СВ) с недостаточной перфузией органов и тканей. На начальных стадиях СН ударный объем поддерживается за счет увеличения конечно-диастолического объема левого желудочка и длины миокардиальных волокон. В итоге это приводит к дилатации полостей сердца, повышению давления в левом желудочке и легочных венах, а затем к легочной гипертензии. Нарушается внутрисердечная гемодинамика, присоединяются различные виды аритмий. Развивается застой по малому и большому кругам крово-обращения. Это приводит к гипоперфузии всех органов и тканей, в том числе печени, что является одним из ведущих пусковых факторов дисбаланса свертывающей и противосвертывающей систем [3]. При этом в полостях сердца могут образовываться тромбы, которые представляют риск эмболических осложнений [4, 5]. Для профилактики таких осложнений назначают антитромботическую терапию [6]. Поскольку трансплантация сердца является экстренной операцией, коррекция нарушений гемостаза должна выполняться во время хирургического вмешательства.
Кроме предоперационных нарушений гемостаза возможно развитие гипокоагуляционного состояния интраоперационно.
Трансплантация – обширная длительная операция с большим запланированным объемом кровопотери и со сложными механизмами влияния на гемостаз. Причинами гипокоагуляционного кровотечения могут быть длительное искусственное кровообращение (ИК), дисфункция эндотелия, тромбоцитопения, тромбоцитопатия, применение гепарина, протамина, дефицит факторов в результате гемодилюции и повышенного потреб-ления, гипотермия, гиперфибринолиз, нерациональное использование вакуумных дренажей во время операции, длительный контакт крови с внешним воздухом и т.д. [7, 8]. При интраоперационном гипокоагуляционном состоянии может развиться определеный «порочный круг», когда продолжающееся кровотечение требует инфузионной и трансфузионной терапии, что, в свою очередь, усиливает гемодилюцию и способствует поддержанию коагулопатии, требует дополнительных трансфузий и увеличивает риск посттрансфузионных осложнений.
Коррекция системы гемостаза большими объемами препаратов крови противопоказана, так как происходит перегрузка объемом сердечно-сосудистой системы и развивается резкая декомпенсация кровообращения, что может привести к гибели пациента на операционном столе либо в раннем послеоперационном периоде.
Необходимо добавить, что трансфузии аллогенных препаратов крови связаны с различными рисками, специфическими именно для этого метода терапии.
При рассмотрении вопроса ведения периоперативного кровотечения следует оценивать не только риски, связанные с трансфузией свежезамороженной плазмы (СЗП), но и риски, связанные с трансфузией эритроцитарной массы и концентрата тромбоцитов, так как кровопотеря потребует восполнения и клеток крови. Несмотря на успехи трансфузиологии, переливания компонентов крови связаны с определенными рисками, как хорошо известными, так и пока малоизученными.
В качестве рисков, связанных с трансфузиями, обычно рассматривают риск заражения гемотрансмиссивными инфекциями (ВИЧ, гепатиты, малярия), трансфузионное острое повреждение легких (Transfusion related acute lung injury – ТRАLI), аллергические реакции, групповую несовместимость. При трансфузии эритроцитарной массы необходимо помнить о риске гемолиза. Оценка частоты TRALI достаточно противоречива – от минимальной (при рутинном гематологическом надзоре) до достаточно высокой (при специально спланированном исследовании). Разброс может составлять от 1:50 000 доз СЗП до 8% пациентов, получивших СЗП [9, 10].
В последние годы появились данные о роли аллогенных препаратов крови в возникновении различных малопатогенных инфекций. Доказано увеличение риска инфекционных осложнений при использовании более высокого триггерного уровня гемоглобина и, соответственно, при большем количестве перелитой эритроцитарной массы [11].
В 2009 г. в США были опубликованы результаты исследования, в котором сравнивались аллогенные препараты крови и аутокомпоненты [12]. Было показано, что использование аллогенных компонентов существенно увеличивает риск инфекционных осложнений и смертность [12]. Имеются указания о таких побочных эффектах трансфузии эритроцитарной массы, как сосудистый спазм, аритмия и др. [11]. Упоминается риск возникновения сепсиса, связанный с трансфузией концентрата тромбоцитов [13], и риск различных инфекционных осложнений, связанных с переливанием СЗП [14].
Современные методики ведения пациентов с кровопотерей подразумевают минимальное использование аллогенных препаратов крови. Одной из таких методик является максимально быстрое выявление нарушений гемостаза и быстрая коррекция этих нарушений. Это позволяет уменьшить кровопотерю и снизить необходимость в гемотрансфузиях. Единственным методом, позволяющим выявить различные расстройства гемостаза в течение 10–15 мин, в настоящее время является тромбоэластография (ТЭГ).
Основные параметры ТЭГ (рис. 1):
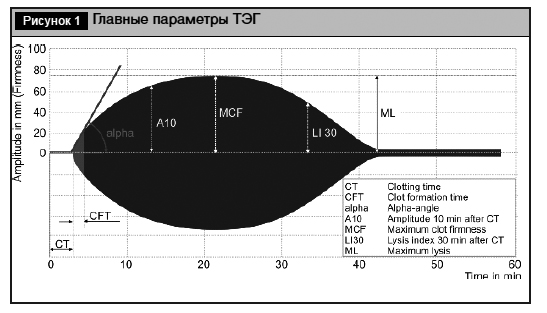
1) CT (clotting time) – время от начала исследования до начала образования сгустка, выраженное в секундах. Зависит от количества факторов и наличия ингибиторов свертывания крови;
2) CFT (clot formation time) – время от начала образования сгустка до плотности сгустка в 20 мм, выраженное в секундах. Отображает полимеризацию фибрина, а также стабилизацию сгустка тромбоцитами и фибринстабилизирующим фактором;
3) MCF (maximum clot firmness) – максимальная амплитуда плотности сгустка, выраженная в миллиметрах. Зависит от наличия субстрата сгустка (фибриногена, тромбоцитов);
4) Ах – значение амплитуды (или плотности сгустка), полученное в разные моменты времени (например, на 10 мин);
5) ML (maximum lysis) – уменьшение плотности сгустка относительно его максимальной плотности, выраженное в процентах. Зависит от активности фибринолитической системы.
Для дифференциальной диагностики основной патологии гемостаза используются пять тестов ROTEM анализа: INTEM (активация внутреннего пути свертывания крови, позволяет оценить факторы XII, XI, IX, VIII, X, V, II, I, тромбоциты, фибринолиз); EXTEM (активация внешнего пути свертывания крови, позволяет оценить факторы VII, X, V, II, I, тромбоциты, фибринолиз); FIBTEM (показывает изолированный вклад фибриногена в плотность сгустка, полностью исключает влияние тромбоцитов на сгусток, сравнивается с EXTEM); HEPTEM (сравнивается с INTEM, оценивается CT, показывает наличие свободного гепарина в крови при разнице в СТ НЕРТЕМ и СТ INTEM более 25%, а также используется во время искусственного кровообращения для ранней диагностики дефицита факторов свертывания, тромбоцитопении, гипофибриногенемии); APTEM (показывает наличие либо отсутствие гиперфибринолиза, сравнивается с EXTEM, оценивается ML) [15].
Этот метод дает возможность быстро выявить недостаток факторов внешнего и внутреннего пути гемостаза даже при циркулирующем гепарине в крови, недостаток тромбоцитов и фибриногена, выявить и корригировать гиперфибринолиз, дозу гепарина. ТЭГ позволяет незамедлительно начать терапию по восполнению факторов свертывания концентратом протромбинового комплекса (КПК), фибриногеном, криопреципитатом. Использование КПК, фибриногена, криопреципитата позволяет избежать дополнительных инфузий СЗП как за счет высокой концентрации активных субстанций в этих препаратах, так и за счет сокращения времени, необходимого для остановки кровотечения. Так, инфузия КПК требует примерно 15 мин после принятия решения, а инфузия СЗП в соответствующей дозе может занимать несколько часов, так как время необходимо для доставки, размораживания, проведения биологической пробы и собственно капельного введения. Методику, при которой используется КПК, фибриноген, криопреципитат, в зарубежной литературе называют «goal-oriented therapy», что можно перевести как «селективный подход» или «дифференцированная терапия».
В 2011 г. Американское общество анестезиологов опубликовало в своем журнале данные об использовании селективной коррекции гемостаза на основе данных ТЭГ («дифференцированной терапии») в кардиохирургии в сравнении с традиционной методикой, подразумевающей использование СЗП на основании традиционных тестов или эмпирически [16]. В результате достоверно уменьшилась частота трансфузий эритроцитарной массы (с 49,7 до 40%) и СЗП (с 19,4 до 1,1%), незначительно увеличилась частота использования концентрата тромбоцитов (с 10,1 до 13%), уменьшилось общее количество перелитых компонентов крови, частота массивных трансфузий (10 доз эритроцитарной массы на пациента) с 2,5 до 1,26%. Самый главный результат – уменьшилось количество незапланированных повторных операций (с 4,19 до 2,24%) [16].
В РНПЦ «Кардиология» в течение последних лет применяется алгоритм дифференциальной диагностики нарушений гемостаза у пациентов с терминальной СН. Алгоритм состоит из трех этапов, включающих следующие тесты: 1) ТЭГ (ROTEM, Pentapharm GmbH, Германия); 2) коагулограмма (автоматический анализатор гемостаза BCS (Siemens, США); 3) активированное время свертывания крови (АВСК) (ACT II Coagulation Timer, Medtronic, CША).
1-й этап – до ИК (до полной гепаринизации организма).
2-й этап – во время ИК; при этом обычные клоттинговые методы применять невозможно из-за большого количества циркулирующего гепарина; в данном случае помогают тесты тромбоэластограммы (ЕХТЕМ, HEPTEM FIBTEM), которые показывают состояние внешнего и внутреннего пути гемостаза, а также уровень фибриногена и тромбоцитов в крови.
3-й этап – после ИК (после нейтрализации гепарина протамином или после проведенного лечения).
На основе диагностики системы гемостаза при необходимости проводится лечение на каждом этапе.
Один из препаратов, входящий в алгоритм лечения системы гемостаза в нашем центре, – концентрат протромбинового комплекса (Октаплекс®). Октаплекс® содержит человеческие факторы свертывания II, VII, IX, X, протеины С, S. Основным показанием для его использования на 1-м этапе является инактивация действия непрямых антикоагулянтов. При этом Октаплекс® применяется при увеличении международного нормализованного отношения (МНО) в коагулограмме, повышении показателя СТ в тесте EXTEM ТЭГ. На 2-м и 3-м этапах – восполнение дефицита факторов свертывания. Коррекция дилюционной коагулопатии проводится по показателям ТЭГ при восстановленном уровне фибриногена, скорректированном гиперфибринолизе и инактивированном гепарине.
Клинический случай. Больной С., 1953 г. р., 17.04.2013 г. госпитализирован в РНПЦ «Кардиология» с диагнозом: «Ишемическая кардиомиопатия. Атеросклероз аорты, брахиоцефальных артерий, стенозирующий атеросклероз коронарных артерий. Полная блокада левой ножки пучка Гиса. Состояние после операции (от 02.07.2011 г.) аортокоронарного шунтирования, пластика митрального клапана на кольце, пластика трехстворчатого клапана по ДеВега, имплантация ресинхронизирующего устройства в режиме DDDR. Персистирующая форма фибрилляции предсердий. Тромб ушка левого предсердия. Сердечная недостаточность НIIA (NYHA III)». До операции пациент принимал варфарин по 3,75 мг в сутки. 23.04.2013 г. больному была выполнена ортотопическая трансплантация сердца по биатриальной методике. Непосредственно перед операцией был проведен лабораторный контроль системы гемостаза.
Коагулограмма 23.04.2015 г.: активированное частичное тромбопластиновое время (АЧТВ) – 46,6 с, протромбиновое время (ПВ) – 36,5 с, МНО – 3,21, тромбиновое время (ТВ) – 20,5 с, фибриноген – 3,6 г/л, антитромбин III (АТ III) – 102,6%.
АВСК 23.04.2013 г. – 103 с.
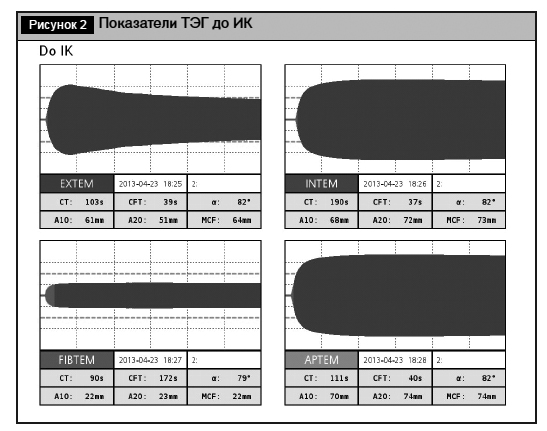
Исходно до полной гепаринизации организма выполнены 4 теста ТЭГ: EXTEM, INTEM, FIBTEM, APTEM (рис. 2). Показатель СТ в тесте ЕХТЕМ был равен 103 с (норма – 38–79 с), что свидетельствовало о дефиците факторов по внешнему пути свертывания крови. Имел место гиперфибринолиз, так как ML 60 в тесте ЕХТЕМ составил 42% (норма менее 15%), при этом ML 60 тесте АРТЕМ был 2%. С учетом этого в первичное заполнение физиологического контура ИК было добавлено 2 000 000 ед. апротинина.
Объем первичного заполнения физиологического контура составил 1970 мл.
Расчетная доза гепарина составила 30 000 МЕ болюсно и 7500 МЕ в первичное заполнение физиологического контура ИК. После введения гепарина АВСК составило 962 с. ИК проведено по стандартной методике нормотермической перфузии (36 °С). Время ИК составило 155 мин.
За 30 мин до окончания ИК согласно нашему алгоритму выполнены три теста ТЭГ – EXTEM, FIBTEM, HEPTEM (рис. 3). При этом было выявлено увеличение CT EXTEM до 131 с (норма 89 с при использовании апротинина), а также увеличение CT HEPTEM до 339 с (норма 240 с), что свидетельствовало о дефиците факторов свертывания крови как по внешнему пути, так и по внутреннему пути гемостаза. В тесте FIBTEM амплитуда плотности сгустка на 10-й минуте была уменьшена до 7 мм (при норме А10 FIBTEM 9–23 мм), что является показателем дефицита фибриногена.
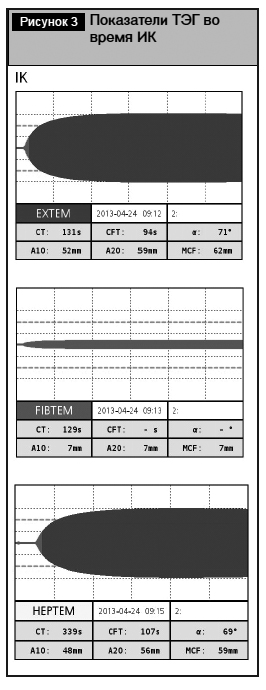
Необходимо отметить, что гиперфибринолиз по данным ТЭГ был инактивирован. В тесте EXTEM показатель ML 60 нормализовался, т.е. произошло его значительное уменьшение с 42 до 2%.
После отключения ИК терапия проводилась следующим образом: в первую очередь был инактивирован гепарин введением протамина сульфатом из расчета 1:1. Далее для коррекции гипофибриногенемии введено 8 доз криопреципитата из расчета 1 доза на 10 кг массы тела пациента. Последним этапом в лечении нарушения гемостаза с целью восполнения дефицита факторов сертывания крови был введен КПК (Октаплекс®) в общей дозе 2000 МЕ.
После окончания ИК и проведенной терапии был выполнен заключительный этап контроля системы гемостаза.
АВСК 24.04.2013 г. – 93 с.
Коагулограмма 24.04.2013 г.: АЧТВ – 45,5 с, ПВ – 20,9 с, МНО – 1,79, ТВ – 26,4 с, фибриноген – 3,0 г/л.
Проведены 4 теста ТЭГ – EXTEM, INTEM, FIBTEM, HEPTEM. После проведенной терапии показатели ТЭГ полностью отстроились (рис. 4).
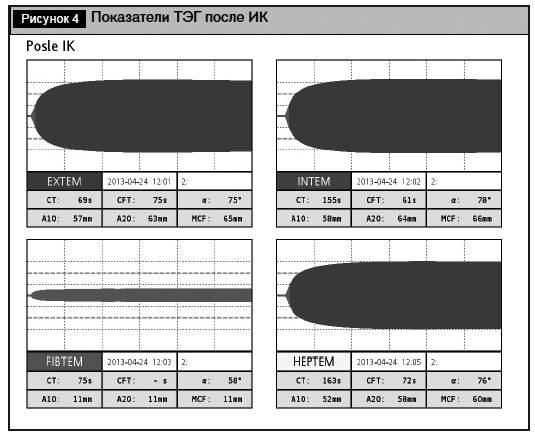
КПК (Октаплекс®) нормализовал показатели внешнего, внутреннего, общего пути гемостаза (СТ ЕХТЕМ стал 69 с; СТ INTEM – 155 с). Разница СТ INTEM и СТ НЕРТЕМ составила менее 25% (155 и 163 с), что свидетельствовало об адекватной нейтрализации гепарина. Уровень фибриногена нормализовался (амплитуда плотности сгустка на 10-й минуте в FIBTEM во время ИК с 7 мм возросла после лечения до 11 мм). Объем геморрагического отделяемого по дренажам за первые сутки после операции составил всего 450 мл.
В заключение следует отметить, что применение алгоритма дифференциальной диагностики между хирургическим и гипокоагуляционным кровотечением дало возможность модифицировать проводимую терапию.
Несмотря на наличие выраженной коагулопатии, в данном случае удалось полностью избежать введения СЗП.
Незначительный объем кровопотери в послеоперационном периоде позволил также избежать дополнительных трансфузий эритроцитарной массы.
Л И Т Е Р А Т У Р А
1. 2009 Focused Update: ACCF/AHA Guidelines for the Diagnosis and Management of Heart Failure in Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation.
2. Островский, Ю.П. Хирургия сердца: руководство / Ю.П. Островский. – М., 2007. – 517 с.
3. Stuklis, R.G. Novel approach to bleeding in patients undergoing cardiac surgery with liver dysfunction / R.G. Stuklis, D.F. O’Shaughnessy, S.K. Ohri // Eur. J. Cardiothorac. Surg. – 2001. – Vol. 1, N 9. – P. 219–220.
4. Atrial fibrillation management: a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation / R. Nieuwlaat [et al.] // Eur. Heart J. – 2005. – Vol. 26. – P. 2422–2434.
5. The Registry of the German Competence NETwork on Atrial Fibrillation: patient characteristics and initial management / M. Nabauer [et al.] // Europace. – 2009. – Vol. 11. – P. 423–434.
6. Национальные рекомендации по диагностике и лечению хронической сердечной недостаточности / В.Ю. Мареев [и др.] // Сердечная недостаточность. – 2010. – Т. 11, № 1 (57). – С. 1–62.
7. Bull, B.S. Postoperative bypass bleeding: a bypass-assotiated dilutional [BAD] coagulopathy? // B.S. Bull, K.L. Hay, P.C. Herrmann // Blood Cells Mole Dis. – 2009. – Vol. 43. – P. 256–259.
8. Plasma activity of individual coagulation factors, hemodilution and blood loss after cardiac surgery: a prospective observational study / L. Ternström [et al.] // Thrombosis Research. – 2010. – Vol. 126. – P. e128–133.
9. Transfusion-Related Acute Lung Injury (TRALI) [Electronic resource]. – Mode of access: http://www.transfusionmedicine.ca/articles/transfusion-related-acute-lung-injury-trali.
10. Transfusion-related Acute Lung Injury in the Critically Ill, Prospective Nested Case-Control Study / O. Gajic [et al.] // Am. J. Respir. Crit. Care Med. – 2007. – Vol.176. – P. 886–891.
11. Economic considerations on transfusion medicine and patient blood management / A. Hofmann [et al.] // Best Practice & Research Clinical Anaesthesiology. – 2013. – Vol. 27. – P. 59–68.
12. Hospital variation in transfusion and infection after cardiac surgery: a cohort study / M.A.M. Rogers [et al.] // BMC Med. – 2009. – Vol. 7. – P. 37.
13. Padmakumar, A.D. Review of current practice of blood and component transfusion: critical issues for the critically ill patient / A.D. Padmakumar, M.C. Bellamy // JICS. – 2011. – Vol. 12, N 2. – P. 134–139.
14. Transfusion of fresh frozen plasma in critically ill surgical patients is associated with an increased risk of infection / B. Sarani [et al.] // Crit. Care Med. – 2008. – Vol. 36. – P. 1114–1118.
15. Rotational Thromboelastometry (ROTEM)-Based Coagulation Management in Cardiac Surgery and Major Trauma / K.A. Tanaka [et al.] // Journal of Cardiothoracic and Vascular Anesthesia. – 2012. – Vol. 26, is. 6. – P. 1083–1093.
16. First-line therapy with coagulation factor concentrates combined with point-of-care coagulation testing is associated with decreased allogeneic blood transfusion in cardiovascular surgery: a retrospective, single-center cohort study / K. GÖrlinger [et al.] // Anesthesiology. – 2011. – Vol. 115. – P. 1179–1191.
Медицинские новости. – 2013. – №10. – С. 49-52.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.