Vashchula V.I., Viliukha A.I.
Belarusian Medical Academy of Post-Graduate Education, Minsk
Recurrent urinary tract infections in women:
three-months nitrofurantoin for recurrent prevention
Резюме. Пациентки с рецидивирующей инфекцией нижних мочевых путей после купирования обострения получали Фурамаг в дозе 50 мг по 1 капсуле 1 раз в день (на ночь) в течение 3 мес. (исследуемая группа – 50 женщин). Контрольная группа (40 пациенток) профилактического лечения не получала. Продолжительность наблюдения – 48 недель (1 год). За время проведения исследования случаев непереносимости Фурамага или побочных эффектов не отмечено. Полученные результаты свидетельствуют о снижении случаев лейкоцитурии, степени бактериурии и дизурии у пациенток экспериментальной группы по сравнению с контрольной с 8-й недели и до окончания наблюдения. Показано, что прием капсул Фурамага демонстрирует преимущества по предупреждению рецидива на всем протяжении периода наблюдения. Статистически значимые изменения в исследуемой группе за год наблюдений демонстрируют хороший результат по снижению Relative Risk: RR = 0,4000 [95% CI:0,2788–0,5740, Z = 4,973], p < 0,0001.
Ключевые слова: неосложненная инфекция мочевыводящих путей, цистит, профилактика, риск рецидивирования, фурамаг.
Медицинскиеновости. – 2013. – № 8. – С. 29–33.
Summary. The efficacy of Furamag for prophylaxis was assessed in 50 women with a history of uncomplicated recurrent urinary tract infections for a period of 48 weeks (1 year). Furamag was administered in 50 mg daily (in the evening) for 3 months. Control group without any treatment in 40 women with a history of recurrent UTIs. Furamag has been shown to be safe and well-tolerated in 3 months prophylaxis regimens and showed a decrease in leucocyturia, bacteriuria and disuria. In the Furamag group from week 8 to week 48 risk of recurrence was significantly lower – Relative Risk (RR) = 0.4000 [95% CI:0.2788–0.5740, Z = 4.973], p < 0.0001.
Keywords: uncomplicated recurrent urinary tract infections, cystitis, prophylaxis, Relative Risk, Furamag.
Meditsinskie novosti. – 2013. – N 8. – P. 29–33.
Cовременная концепция диагностики и лечения инфекции мочевыводящих путей (ИМП) основана на определении клинических критериев и возможных факторов риска, детекции патогена и его чувствительности к противомикробным препаратам, а также оценке факторов внешней среды [1, 4]. Исходя из новых взглядов на классификацию ИМП выделяют осложненную и неосложненную инфекцию мочевыводящих путей, согласно которой рецидивирующий цистит (CY-1) относится к минимальной степени тяжести. Экспертами также предложена новая современная формулировка диагноза: CY-1R: E. coli (a). Эта аббревиатура обозначает рецидивирующий (R) цистит (CY), степень тяжести 1, вызванный E. coli, чувствительной к большинству антибактериальных препаратов (a), доступных в стране проживания [3, 4, 7]. К рецидивирующей неосложненной инфекции нижних мочевых путей относятся случаи рецидивирующего цистита с двумя или более эпизодами ИМП в течение последних 6 месяцев, либо больше 3 эпизодов в течение последнего года.
Помимо изменений в классификации претерпели изменения и подходы к профилактике мочевой инфекции, которая особенно актуальна при неосложненной рецидивирующей ИМП. Основные направления профилактики ИМП в настоящее время следующие:
1. Применение противомикробных препаратов.
2. Применение фитопрепаратов.
3. Употребление экстракта клюквы (проантоцианидин А).
4. Иммунотерапия.
5. Применение пробиотиков в постменопаузальном периоде [7].
Применение противомикробных препаратов с целью профилактики рецидивирования ИМП у взрослых женщин имеет несколько стратегий. Основные рекомендации подразделяются на длительную, посткоитальную профилактику и интермиттирующее самолечение, которое неоднозначно оценивается многими специалистами-урологами.
Длительная профилактика имеет эффективность до 95% и основана на снижении микробной нагрузки в мочевых путях, за время которой происходит восстановление защитных механизмов слизистой урогенитального тракта.
Посткоитальная профилактика основана на применении противомикробных препаратов до или после полового акта, который является фактором риска рецидивирования. При установленном факте, что половой акт запускает обострение цистита, данная методика также достаточно эффективна.
Интермиттирующее самолечение предполагает использование препаратов самим пациентом и требует специального обучения больных по выбору схем лечения и адекватных доз [7].
Необходимость длительной противомикробной защиты мочевыводящих путей привела нас к выбору препарата нитрофуранового ряда исходя из полученных данных о высокой чувствительности к ним штаммов, вызывающих ИМП, и наличия устойчивых к нитрофуранам штаммов Oxalobacter formigenes(CC13)в кишечнике человека [2, 5].
В работе представлены результаты открытого проспективного исследования эффективности капсул фуразидина (Фурамаг 50 мг, АО «Олайнфарм», Латвия) для антимикробной профилактики рецидивирующих неосложненных инфекций нижних мочевых путей у женщин.
Цель исследования – изучение эффективности капсул фуразидина (Фурамаг 50 мг, АО «Олайнфарм», Латвия) для антимикробной профилактики рецидивирующих неосложненных инфекций нижних мочевых путей (N30.2) у женщин.
Материалы и методы
В открытое проспективное исследование были включены пациентки согласно следующим критериям:
– женщины в возрасте 18–65 лет, обратившиеся к врачу с жалобами на болезненное учащенное мочеиспускание (с обострением неосложненной инфекции нижних мочевых путей);
– обязательное наличие в анамнезе рецидивирующей неосложненной инфекции нижних мочевых путей (>2 эпизодов инфекции нижних мочевых путей в течение последних 6 месяцев, либо ?3 эпизодов в течение последнего года);
– положительный тест мочи, определяемый как больше/равно 103 КОЕ/мл в средней порции (или положительный нитритный тест + лейкоцитурия);
– отсутствие профилактического лечения рецидивирующей неосложненной инфекции нижних мочевых путей в течение последнего года.
Критерии исключения:
– клинические признаки инфекции верхних мочевых путей (боль в поясничной области, тошнота и рвота, лихорадка >38 градусов С, положительный симптом поколачивания);
– использование катетера;
– беременность, кормление грудью;
– интерстициальный цистит;
– постлучевой цистит;
– туберкулез органов мочеполовой системы;
– мочекаменная болезнь;
– сахарный диабет;
– иммунодефицитные состояния;
– опухоли мочеполовых органов;
– почечная недостаточность;
– аномалии мочевых путей;
– операции на мочеполовых органах;
– непереносимость нитрофуранов в анамнезе;
– сопутствующая антибактериальная терапия;
– нарушение биоценоза влагалища.
В исследуемую группу вошли 50 пациенток, а в контрольную группу – 40 женщин с рецидивирующей неосложненной ИМП. Пациентки распределены по двум группам методом адаптивной рандомизации.
После купирования обострения пациентки получали профилактическое лечение – Фурамаг 50 мг по 1 капсуле 1 раз в день (на ночь) в течение 3 мес. Контрольная группа профилактического лечения не получала. Контрольное наблюдение проводилось в сроки 4, 8, 12, 24 и 48 недель после включения в исследование.
При статистической обработке была проведена проверка нормальности распределения экспериментальной и контрольной группы по возрасту и результатам бактериологического исследования мочи с использованием критерия Колмогорова–Смирнова. Сравнение достоверности различия относительных величин проводили с определением доверительных границ относительных величин со степенью вероятности безошибочного прогноза (р = 95%). При сравнении числа рецидивов в исследуемой и контрольной группе рассчитывали показатель RR (Relative Risk), являющийся отношением пропорций случаев с положительным исходом в двух группах.
В простом сравнении между экспериментальной и контрольной группами:
– RR = 1 означает, что нет разницы в риске между двумя группами;
– RR <1 означает, что в экспериментальной группе событие развивается реже, чем в контрольной;
– RR >1 означает, что в экспериментальной группе событие развивается чаще, чем в контрольной [6].
Результаты и обсуждение
В исследуемой группе оказались 50 пациенток в возрасте от 19 до 65 лет, средний возраст 34 ? 9,5. Контрольную группу составили 40 женщин в возрасте 20–65 лет, средний возраст 33 плюс/минус 8,8.
Спектр микроорганизмов, выделенных при исследовании мочи на бактериологическом анализаторе «ABT-expression» («BioMйriux», Франция) в исследуемой группе представлен на рис. 1, в контрольной группе – на рис. 2.
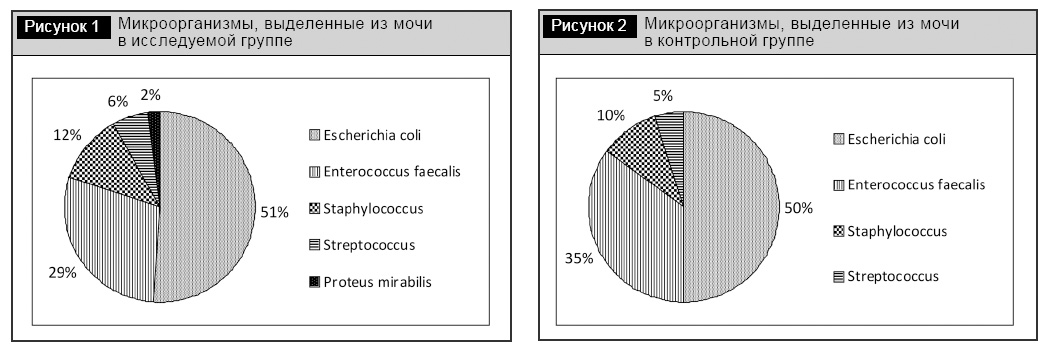
Чувствительность выделенных изолятов Escherichia coli к нитрофуранам по двум группам в исследовании составила 100%, а чувствительность к нитрофуранам выделенных изолятов Enterococcus faecalis – 88%.
При проверке однородности сравниваемых групп по возрасту лямбда = 0,21 меньше 1,358 равно лямбда(альфа), по спектру выделенных микроорганизмов – лямбда = 0,094 меньше 1,358 = лямбда(альфа), что позволяет утверждать, что исследуемая и контрольная группы не отличаются по возрасту и спектру выделенных микроорганизмов (р меньше 0,05).
При проведении статистического анализа по этапам проведения исследования были использованы данные по численности групп и числу рецидивов за указанные выше временные промежутки. Полученные результаты представлены в табл. 1.
Таблица1. Анализ случаев рецидивирования по временным промежуткам в ходе проведения исследования
|
Рецидив
|
4
|
0
|
2
|
5
|
8
|
|
Здоров
|
46
|
46
|
44
|
39
|
31
|
|
RI
|
0,021
|
0
|
0,042
|
0,05
|
0,063
|
|
Контрольная группа
|
|
Рецидив
|
8
|
4
|
6
|
15
|
5
|
|
Здоров
|
32
|
28
|
22
|
7
|
2
|
|
RI
|
0,01
|
0,021
|
0,014
|
0,017
|
0,1
|
|
P (RI)
|
0,87
|
0,99
|
0,76
|
0,76
|
0,74
|
|
Relative Risk (RR)
|
0,40
|
0,078
|
0,2029
|
0,1667
|
0,2872
|
|
P (RR)
|
0,1107
|
0,0834
|
0,041
|
0,0001
|
0,0016
|
П р и м е ч а н и е: Н – неделя.
Для анализа показателей с нарастающим итогом использовали данные, изменяющиеся от начала исследования (табл. 2).
Таблица 2. Анализ случаев рецидивирования от начала исследования до контрольных визитов в ходе проведения исследования
|
Исследуемая группа
|
Н0–Н4
|
Н0–Н8
|
Н0–Н12
|
Н0–Н24
|
Н0–Н48
|
|
Рецидив
|
4
|
4
|
6
|
11
|
19
|
|
Здоров
|
46
|
46
|
44
|
39
|
31
|
|
RI
|
0,021
|
0,041
|
0,042
|
0,045
|
0,052
|
|
Контрольная группа
|
|
Рецидив
|
8
|
12
|
18
|
33
|
38
|
|
Здоров
|
32
|
28
|
22
|
7
|
2
|
|
RI
|
0,01
|
0,014
|
0,0014
|
0,015
|
0,026
|
|
P (RI)
|
0,87
|
0,88
|
0,89
|
0,89
|
0,89
|
|
Relative Risk (RR)
|
0,40
|
0,2667
|
0,2667
|
0,2667
|
0,4
|
|
P (RR)
|
0,1107
|
0,0138
|
0,0017
|
< 0,0001
|
< 0,0001
|
На фоне приема Фурамага у пациенток исследуемой группы существенным образом изменялись жалобы (рис. 3).
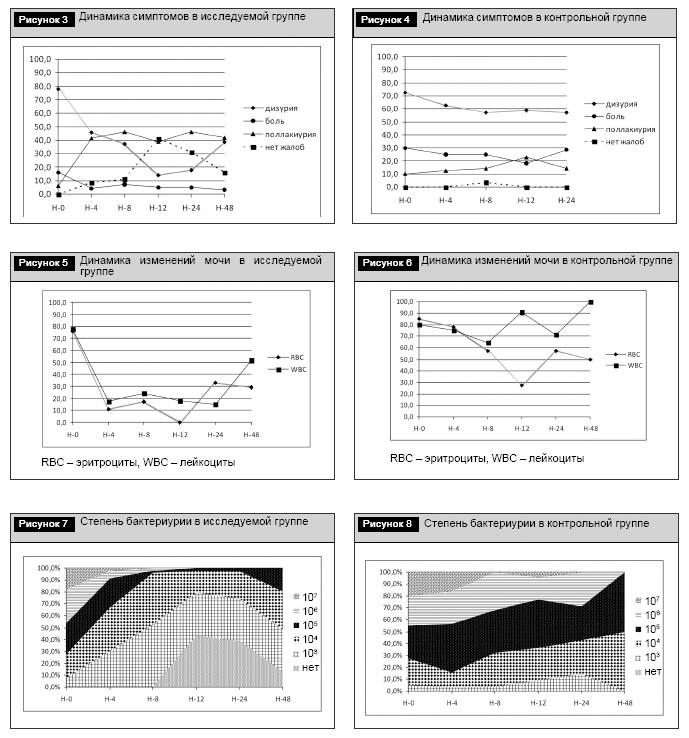
Прогрессивное уменьшение дизурии происходило на фоне постепенного увеличения числа пациенток без клинической симптоматики. Динамика роста числа женщин с поллакиурией объясняется тем, что при наличии дизурии вначале исчезала боль, а затем происходила нормализация числа мочеиспусканий.
Аналогичные изменения в контрольной группе следует рассматривать лишь до 24-й недели наблюдения, так как в периоде наблюдения Н24–Н48 в этой группе осталось всего 2 пациентки (рис. 4).
Таким образом, можно отметить разницу по снижению процента лиц с дизурией в исследуемой группе по сравнению с контрольной начиная с 8-й недели наблюдения (17 пациенток (37%) в исследуемой группе, в контрольной – 16 (57,1%)) и до 24-й недели (7 женщин (17,9%) в исследуемой группе, в контрольной – 13 (59,1%)).
Изменения мочи имели различия по лейкоцитурии на 12-й неделе наблюдения с преимуществом в исследуемой группе (рис. 5) по сравнению с контрольной (рис. 6).
К моменту окончания приема Фурамага (Н12) в исследуемой группе лейкоцитурия наблюдалась у 8 (18,2%) пациенток, в то время как в контрольной группе – у 20 (90,9%). Эта тенденция наблюдаема и до 24-й недели, где в исследуемой группе лейкоцитурия имела место у 6 (15,4%), а в контроле – у 5 (71,4%) женщин. На 48-й неделе объективная оценка невозможна из-за малого числа наблюдений в контрольной группе.
Динамика степени снижения микробной нагрузки также имела место на протяжении лечения и периода наблюдения с преимуществом у пациенток исследуемой группы (рис. 7 и 8).
Как видно из рис. 7 и 8, в исследуемой группе к 12-й неделе степень бактериурии менее 104 КОЕ/мл имели 35 (80%) пациенток, в то время как в контроле – лишь 2 (9%). Микроорганизмы не выделены в моче у 19 (43%) пациенток на 12-й неделе, у 15 (38%) – на 24-й неделе и у 4 (13%) женщин – на 48-й неделе в группе приема Фурамага. Аналогичных наблюдений в контрольной группе нет вообще.
За время проведения исследования пациентки не предъявляли жалоб на непереносимость препарата и не прекращали прием Фурамага из-за побочных эффектов.
Как видно из представленных данных, проблема рецидивирующей ИМП актуальна для женщин всех возрастных групп, но преимущественно – в молодом и среднем возрасте.
Полученные нами результаты наглядно демонстрируют высокую роль Escherichia coli в этиологии ИМП у женщин. В исследовании она выделена в 51% случаев в исследуемой группе и в 50% в контрольной. При рецидивирующей инфекции (а в исследование были отобраны пациентки именно с рецидивирующей инфекцией) достаточно велика этиологическая роль Enterococcus faecalis – 29% в исследуемой и 35% в контрольной группе. На протяжении длительного времени сохраняется высокая чувствительность возбудителей ИМП к нитрофуранам. По представленным данным чувствительность выделенных изолятов Escherichia coli к нитрофуранам по двум группам в исследовании составила 100%, а чувствительность к нитрофуранам выделенных изолятов Enterococcus faecalis – 88%.
Для снижения числа рецидивов ИМП и стойкой ремиссии требуется снижение микробной нагрузки и восстановление защитных механизмов мочевыводящих путей. Длительный прием противомикробных препаратов является необходимым лечебным мероприятием. Выбор противомикробного агента для длительного применения должен строиться с позиции минимального риска и максимального эффекта для пациента. С учетом выдвинутых требований препараты нитрофуранового ряда являются приоритетными из-за наличия устойчивых штаммов Oxalobacter formigenes в кишечнике человека и, соответственно, низком риске кишечной гипероксалурии, при которой увеличивается всасывание оксалата, что приводит, в конечном итоге, к мочекаменной болезни.
Прием капсул фуразидина (Фурамаг, АО «Олайнфарм», Латвия) по 50 мг (1 капсула 1 раз в день (на ночь) в течении 3 мес.) демонстрирует преимущества пациенток в достижении поставленной выше цели предупреждения рецидива вследствие реинфицирования или релапса ИМП на всем протяжении периода наблюдения от начала исследования до 48 недели (1 год). Статистические данные подтверждают этот вывод начиная с 8-й недели наблюдения, а изменения в исследуемой группе за год наблюдений демонстрируют превосходный результат по снижению RR: RR = 0,4000 [95% CI:0,2788–0,5740, Z = 4,973], p < 0,0001.
У пациенток, принимавших Фурамаг, происходило уменьшение дизурии на фоне постепенного увеличения числа женщин без клинической симптоматики. Динамика роста числа пациенток с поллакиурией объясняется тем, что при наличии дизурии вначале исчезала боль, а затем происходила нормализация числа мочеиспусканий.
В исследовании заметна разница по снижению процента больных с дизурией в исследуемой группе по сравнению с контрольной начиная с 8-й недели наблюдения (17 (37%) пациенток в исследуемой группе, в контрольной – 16 (57,1%)) и до 24-й недели (7 (17,9%) женщин в исследуемой группе, в контрольной – 13 (59,1%)).
На 12-й неделе наблюдения имеются также различия по лейкоцитурии с преимуществом в исследуемой группе по сравнению с контрольной. К моменту окончания приема Фурамага в исследуемой группе лейкоцитурия наблюдалась у 8 (18,2%) пациенток, в то время как в контрольной – у 20 (90,9%). Эта тенденция наблюдалась и до 24-й недели, где в исследуемой группе лейкоцитурия имела место у 6 (15,4%) пациенток, а в контроле – у 5 (71,4%).
Заметно различие в изучаемых группах по степени бактериурии. Менее 104 КОЕ/мл в моче имели 35 (80%) женщин в исследуемой группе, в то время как в контроле – лишь 2 (9%) пациентки. Микроорганизмы не выделены в моче у 19 (43%) женщин на 12-й неделе, у 15 (38%) – на 24-й неделе и у 4 (13%) – на 48-й неделе в группе приема Фурамага, при этом в контрольной группе аналогичных наблюдений нет вообще.
Таким образом, данные, полученные в результате проведенного исследования позволяют утверждать, что прием капсул фуразидина (Фурамаг, АО «Олайнфарм», Латвия) по 50 мг (1 капсула 1 раз в день (на ночь) в течение 3 мес.) эффективно снижает риск рецидивирования ИМП начиная со 2-го месяца наблюдения и в течение 12 месяцев, улучшает симптоматику заболевания, снижает число случаев лейкоцитурии и степень микробной нагрузки у женщин с рецидивирующей ИМП.
Л И Т Е Р А Т У Р А
1. Перепанова Т.С., Козлов Р.С., Дехнич А.В. и др. // Эксперим. и клин. урология. – 2012. – № 2. – C. 78–83.
2. Перепанова Т.С., Хазан П.Л. //Эффект. фармакотер. в урол. – 2007. – № 4. – С. 20–29.
3. Синякова Л.А., Косова И.В. // Фарматека. – 2008. – № 1. Спецвып.: Урология. – С. 17–21.
4.European Association of Urology: Guidelines, 2011 – Urological infections.
5. Lange J.N., Wood K.D., Wong H. et al. // Urology. – 2012. – Vol. 79, N 6. – P. 1286–1289.
6. Sheskin D.J. Handbook of parametric and nonparametric statistical procedures. – 3rd ed. – Boca Raton: Chapman & Hall/CRC, 2004. – 320 p.
7. Urogenital Infections / Kurt G. Naber et al., EAU, 2010. – 1182 c.
Статья размещена на сайте www.mednovosti.by (Архив МН) и может быть скопирована в формате Word.
Медицинские новости. – 2013. – №8. – С. 29-33.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.