Zariankina A.I.
Gomel State Medical University, Belarus
Allergy. Pseudo allergy. Dysbiosis
Резюме. В настоящее время практикующие врачи все чаще сталкиваются с аллергическими заболеваниями у детей. В статье изложены наиболее частые причины, механизмы развития и коррекция кожных проявлений аллергии у детей.
Ключевые слова: дети, аллергия, псевдоаллергия, глистные инвазии, дисбактериоз, Энтерожермина.
Summary. The given article presents different aspects of the problem of children’s allergy at present time,the most frequent causes, ways of progress and treatment of skin manifestations of children allergy.
Keywords: children, allergy, pseudo allergy, helminthes, dysbiosis, Enterogermina.
Аллергические заболевания (бронхиальная астма, поллинозы, крапивница, дерматиты, лекарственная и пищевая аллергии) широко распространены во всем мире. Аллергия преследует человечество с древнейших времен. На данный момент нет точных сведений о распространенности и географии аллергии у взрослых и детей. Хотя проведен ряд серьезных эпидемиологических исследований по распространенности аллергии у детей, истинное число больных не известно. Предположительно от 11 до 26 млн человек в Европе страдают пищевой аллергией. В мире насчитывается 6 659 040 000 человек, соответственно число больных пищевой аллергией составляет примерно 220–520 млн [23].
По данным Всемирной организации здравоохранения, каждый шестой житель Земли предрасположен или страдает какой-либо формой аллергии, и количество больных стремительно растет. Одной из причин этого считают широкое применение синтетических лекарственных препаратов, в первую очередь антибиотиков. Способствует распространению аллергических заболеваний бурное развитие химической промышленности и связанное с этим появление большого количества различных синтетических материалов, красителей, стиральных порошков и других разнообразных производственных и бытовых веществ, многие из которых могут быть аллергенами. Немаловажное значение в росте аллергических заболеваний имеет степень загрязнения окружающей среды обитания (воздуха и почвы) – экологическая обстановка в регионе проживания[1, 5, 14, 18, 23, 24].
Термин «аллергия» был введен австрийским педиатром К. Пирке в 1906 г. для обозначения необычной, измененной реакции некоторых детей на введение им с лечебной целью противодифтерийной сыворотки [7, 15].
Аллергические заболевания известны с древних времен. Древнегреческий врач Гиппократ (460–377 гг. до н.э.) описал случаи непереносимости некоторых пищевых продуктов, приводящие к желудочным расстройствам и крапивнице. Уже у древних римлян описана сенная лихорадка при контакте с лепестками роз. Гален подобную реакцию на цветы назвал идиопатией. В 1923 г. Cooke ввел понятие «атопия» («странная болезнь») для обозначения аллергических заболеваний у человека. В 1930 г. предложил первую клиническую классификацию аллергии, в которой различались реакции гиперчувствительности немедленного и замедленного типов. В 1963 г. исследователи Gell и Coombs разделили аллергические реакции гиперчувствительности немедленного типа на атопические, цитотоксические и иммунокомплексные [7, 15].
Дальнейшее изучение данной проблемы показало, что описанные механизмы по своей природе являются не аллергическими, а вполне естественными реакциями, ежедневно происходящими в человеческом организме и играющими чрезвычайно важную роль в осуществлении противомикробного иммунитета и поддержании антигенного гомеостаза, и только в отдельных случаях по указанным механизмам реализуются патологические реакции, сопровождающиеся самоповреждением [7].
В организме существуют защитные механизмы против чужеродных агентов.
На слизистых оболочках здорового человека функционирует несколько защитных барьеров [4], предотвращающих проникновение разнообразных антигенов во внутреннюю среду организма:
– в полости кишечника – пищеварительные ферменты и другие энзимы (в частности лизоцим), микроорганизмы (симбионты), осуществляющие расщеп-ление поступающих извне макромолекул, вследствие чего последние утрачивают антигенные свойства и не могут быть провокаторами аллергических реакций;
– на поверхности эпителия слизистых оболочек располагаются секреторные иммуноглобулины класса А (sIgA). Эти антитела (At) нейтрализуют разнообразные антигены (Ag), которые по каким-либо причинам не подверглись энзимному расщеплению в просвете кишечника. Образовавшиеся иммунные комплексы в дальнейшем удаляются из организма благодаря слущиванию эпителия слизистых оболочек и перистальтическим движениям кишечника;
– в самой слизистой оболочке находится третий барьер, образованный дендритными клетками, которые, переплетаясь своими длинными отростками, формируют своеобразную сетку, улавливающую антигены, которые не были нейтрализованы sIgA на поверхности слизистой оболочки. Дендритные клетки захватывают Ag, проникшие вглубь стенки, и переваривают их, расщепляя на множество мелких неопасных фрагментов, выделяя при этом один или несколько так называемых иммуногенных пептидов, которых впоследствии могут презентовать Т-хелперам для начала иммунной реакции;
– в подслизистом слое находится последний, четвертый защитный барьер, состоящий из иммуноглобулинов класса Е (IgE) и тучных клеток. Указанные At распознают проникшие Ag и обеспечивают дегрануляцию тучных клеток, что приводит к развитию выраженной экссудации и извержению Ag в полость кишки. Реакции с участием IgE являются экстренными и в норме происходят только при неотложных ситуациях, когда чрезвычайно высок риск контаминации внутренней среды организма [7].
У больных аллергией такие реакции становятся скорее закономерностью, чем исключением из правил, поскольку у них не происходит нейтрализации Ag на первых этапах защиты, т.е. имеет место снижение активности пищеварительных ферментов и/или нарушение иммунитета слизистых оболочек.
Механизм истинной аллергии
Аллергия – исключительно патологический процесс, протекающий по механизму атопии [2, 3, 7, 15].
В атопических реакциях различают три фазы: 1) иммунологическую; 2) патохимическую; 3) патофизиологическую.
Для правильной интерпретации понятия «аллергия» важно понимание сущности именно иммунологической фазы патологического процесса, при которой происходит распознавание и захват Ag факторами врожденного иммунитета (дендритными клетками, макрофагами), его расщепление и выделение так называемого иммуногенного пептида.
От качества обработки Ag клетками врожденного иммунитета зависит конечный результат – характер иммунного реагирования. В норме на неопасные Ag (пыльца растений, тополиный пух, пищевые продукты и др.) иммунной реакции не развивается. Если же относительно инертный Ag распознан, обработан неправильно и впоследствии презентирован Т-хелперам так же, как и компоненты болезнетворных микробов, на него может развиться бурная, но «бесполезная» иммунная реакция с массивным самоповреждением.
Кроме того, для обеспечения корректного распознавания Ag огромное значение имеют sIgA, которые должны обеспечивать нейтрализацию разно-образных чужеродных субстанций до момента их проникновения в глубокие слои слизистой оболочки, где выполняют защитную роль иммуноглобулины класса Е.
Механизм дегрануляции тучных клеток, опосредованный IgE (патохимическая фаза), является вполне физиологическим и чрезвычайно полезным для организма. Вовлечение IgE в защитную реакцию происходит при преодолении Ag первичных барьеров, сформированных sIgA и дендритными клетками, что сопряжено с высоким риском проникновения чужеродных субстанций во внутреннюю среду организма. Такая ситуация может сложиться как при недостаточности sIgA или снижении фагоцитарной активности антигенпрезентирующих клеток, так и при чрезвычайно высокой дозе Ag, когда вполне нормальное количество факторов иммунитета не в силах справиться с резко возрастающей антигенной нагрузкой. Поэтому специфические IgE, распознав Ag, обеспечивают дегрануляцию тучных клеток, что приводит к развитию интенсивной экссудативной реакции (патофизиологическая фаза), которая необходима для удаления патогена из организма [2, 3, 7, 13, 15].
Таким образом, аллергия – это высокоспецифический процесс. Поэтому для больных истинной аллергией характерна сенсибилизация преимущественно к какому-либо одному Ag. Если же пациент отмечает непереносимость многих пищевых продуктов, то речь идет о так называемой псевдоаллергии – неаллергической гиперчувствительности [3], которой свойственны аналогичные клинические проявления. Однако псевдоаллергические реакции протекают без иммунологической фазы [2] и поэтому, по сути, являются неспецифическими.
Несмотря на устоявшееся мнение, аллергия достаточно редко встречается в клинической практике. В основном клиницист имеет дело с разнообразными проявлениями псевдоаллергических реакций, являющихся клиническими аналогами аллергии, но требующих совсем другого подхода к лечению и профилактике.
Механизмы псевдоаллергии
Различают три типа псевдоаллергических реакций:
1. Реакции, связанные с нарушением обмена гистамина.
2. Реакции, обусловленные неадекватной активацией комплемента.
3. Реакции, вызванные нарушением метаболизма жирных кислот, в первую очередь арахидоновой кислоты и продуктов ее обмена.
Неадекватная активация комплемента. Механизм псевдоаллергии, связанный с неадекватной активацией комплемента, является следствием иммунодефицита – наследственного ангионевротического отека. У таких больных имеется дефицит С1-ингибитора, что приводит к чрезвычайно сильной активации каскада комплемента с высвобождением большого количества эндогенных гистаминолибераторов (например С3а- и С5а-фрагментов), а также кининовых молекул.
Проведение такой дифференциальной диагностики крайне важно, так как эти болезни требуют различных подходов к лечению и профилактике. Если в случае острого атопического ангионевротического отека следует вводить адреналин и глюкокортикоиды, то при дефиците С1-ингибитора эффективным окажется внутривенное введение ?-аминокапроновой кислоты, угнетающей чрезмерно активированную систему комплемента. В тяжелых случаях можно использовать вливание свежезамороженной плазмы, поскольку в препарате содержится нормальный уровень С1-ингибитора из крови доноров.
Нарушение обмена арахидоновой кислоты. При использовании нестероидных противовоспалительных препаратов (НПВП) возможно развитие псевдоаллергических реакций 3-го типа вследствие нарушения обмена арахидоновой кислоты. Блокада фермента простагландинсинтетазы под действием препаратов приводит к усиленному образованию лейкотриенов, вызывающих бронхоспазм, напоминающий клинику атопической бронхиальной астмы. Отмена НПВП полностью излечивает от этого варианта псевдоаллергии.
Нарушение обмена гистамина. Наиболее часто псевдоаллергические реакции связаны с тем или иным нарушением обмена гистамина.
В этой группе псевдоаллергий выделяют следующие варианты:
– повышенная гистаминолиберация (высвобождение гистамина);
– сниженная гистаминопексия (связывание гистамина);
– употребление продуктов, содержащих гистамин.
Повышенная гистаминолиберация свойственна детям первых лет жизни, к возрасту 3 лет полностью выздоравливают от 70 до 90% детей, ранее имевших проявления пищевой аллергии в виде атопического дерматита [1]. У взрослых и детей старшего возраста она является патологическим процессом и обусловлена нарушением пищеварения, нарушением микробиоценоза кишечника и/или снижением иммунитета слизистых оболочек, что создает условия для контакта необработанных Ag (гистаминолибераторов) с тучными клетками подслизистого слоя.
При лечении больных с данным типом псевдоаллергических реакций целесообразно назначение стабилизаторов мембран тучных клеток (Na кромогликат и др.), которые блокируют реакцию дегрануляции.
У таких пациентов развитие патохимической стадии псевдоаллергической реакции возможно при воздействии механических стимулов, например, при растяжении кишечной стенки поступившей пищей. Как правило, в данном случае пациент жалуется на непереносимость практически всех продуктов питания. Назначение дробного питания и сбалансированная медикаментозная коррекция (ферментные препараты, сорбенты, про-, эубиотики) способны существенно улучшить состояние пациента и расширить его пищевой рацион.
Антигистаминные препараты недостаточно эффективны, поскольку гистамин является лишь одним из многих биологически активных веществ, выделяющихся из гранул тучных клеток. Кроме того, блокада эффектов гистамина может только усиливать действие других биологически активных веществ, накопление которых зачастую еще более опасно для пациента.
Сниженная гистаминопексия – недостаточная активность белка гистаминопексина, связывающего свободный гистамин в сыворотке крови. Такие псевдоаллергические реакции развиваются, как правило, в условиях интоксикации организма (в развитии которой немаловажное значение имеют дисбактериоз кишечника, глистные и паразитарные заболевания кишечника), сопровождающейся снижением гистаминсвязывающей активности указанного белка, который вовлекается в процессы нейтрализации токсических продуктов.
Улучшить состояние можно за счет проведения дезинтоксикационных мер (энтеросорбция, парентеральная детоксикация), коррекции дисбиотических нарушений, дегельминтизация. В случае массивной псевдоаллергической реакции целесообразно внутривенное введение глюконата кальция на протяжении 3 суток, поскольку Са2+ усиливает функциональную активность гистаминопексина. Дальнейшее применение препаратов кальция противопоказано, так как такая терапия способствует усилению реакции дегрануляции тучных клеток.
Употребление продуктов, богатых гистамином. Псевдоаллергические реакции развиваются при употреблении продуктов, содержащих гистамин: ферментированные сыры, сырокопченые колбасы, клубника, томаты, квашеная капуста, шоколад, бобовые и др. Наиболее эффективна элиминационная диета, энтеросорбенты. В острый период таким больным целесообразно также назначать антигистаминные препараты коротким курсом [7, 15].
Глистные инвазии. Гельминты могут сами создавать проблемы со здоровьем и усугублять уже имеющуюся патологию. Глисты являются мощным фактором сенсибилизации организма за счет поступления в кровь продуктов их метаболизма. На фоне нематодозов усиливается атопический дерматит и ухудшается течение других аллергических заболеваний (в том числе бронхиальной астмы, поллинозов). Глистные инвазии могут быть причиной впервые возникшей аллергии, которая может носить как местный (инфильтраты, гранулемы, некрозы), так и общий характер (крапивница, отек Квинке, эозинофилия, бронхоспазм и пр.), особенно если она появилась в летне-осенний период. Аллергические реакции при гельминтозах протекают торпидно и почти резистентны к традиционной противоаллергической терапии. Эозинофилия в общем анализе крови является одновременно признаком и аллергии, и паразитарных заболеваний. В некоторых ситуациях гельминты приводят к значительному росту уровня общего IgE, что зачастую затрудняет диагностику [6, 8].
Гельминты вызывают дисбактериоз кишечника, угнетая нормальную кишечную микрофлору и ослабляя местный иммунитет ЖКТ. На фоне дисбактериоза усугубляются функциональные нарушения ЖКТ и аллергическая патология, развиваются вторичные (реактивные) изменения печени, желчевыводящих путей и поджелудочной железы [8].
Дисбактериоз
Пищеварительный тракт (равно как и кожа, дыхательные пути) является местом контакта между микробами (антигенами) и иммунной системой организма. В первое время организм ребенка учится бороться с неагрессивными микробами, населяющими кишечник, которые, однако, имеют много общего со многими опасными микробами.
Созревание иммунной системы происходит параллельно с формированием микрофлоры кишечника. Формирование микрофлоры кишечника заканчивается к 3–5 годам жизни. К этому времени (или немного позже) созревает и его иммунная система. В результате тесного сосуществования иммунной системы с микрофлорой кишечника в организме ребенка формируется стойкий иммунитет, способный справиться с возбудителями многих болезней. Кроме того, на протяжении всей жизни человека микрофлора кишечника поддерживает его иммунную систему в состоянии постоянной готовности [3, 7, 10, 11, 22].
Недавно ученными был описан удивительный факт: несмотря на свою значительную иммуногенность (способность вызвать развитие иммунной реакции) микробы кишечника практически не вызывают никаких видимых возмущений иммунной системы кишечника. Объяснить этот факт помогли тщательные микробиологические исследования микрофлоры кишечника и гистологический анализ тканей кишечника. Оказалось, что в процессе сосуществования ткани кишечника (в особенности слизистая оболочка) и контактирующие с ними бактерии обмениваются генетическим материалом и становятся «похожими» друг на друга. Поэтому иммунная система организма перестает распознавать бактерии кишечника как «чужеродные структуры». Этот поразительный процесс объяснил тот факт, что некоторые вирусы и бактерии, попадая в кишечник, атакуют не клетки нашего организма, а клетки бактерий («похожие» на эпителий кишечника), с которыми и выводятся из организма [17].
Кишечная микрофлора – один из основных факторов защиты кишечника от заселения его болезнетворными микробами (наряду с кислотностью желудка и перистальтикой кишечника). Происходит это благодаря трем основным механизмам: во-первых, нормальная микрофлора кишечника конкурирует с патогенными микробами за пищу и при этом выделяет ряд веществ, разрушающих болезне-творные микробы. Во-вторых, микрофлора кишечника стимулирует локальный иммунитет и делает оболочку кишечника непроницаемой для множества патогенных микробов, антигенов. В-третьих, микрофлора кишечника стимулирует общий иммунитет [9–11].
На данный момент не существует сомнений в том, что развитие многих аллергических заболеваний (особенно у детей) протекает на фоне изменения состава нормальной микрофлоры кишечника (т.е. на фоне дисбактериоза) [16, 20]. Такие заболевания, как атопический дерматит, экзема, крапивница, бронхиальная астма, пищевая аллергия, у детей протекают параллельно с дисбактериозом кишечника [9, 17].
Основным местом проникновения аллергенов в организм ребенка является слизистая оболочка кишечника. Поэтому нарушения пищеварения и защиты слизистой кишечника при дисбактериозе способствуют избыточному проникновению аллергенов в организм ребенка [16, 20, 21, 23] и формированию длительной и стойкой сенсибилизации, которая со временем переходит в то или иное аллергическое заболевание. Вот почему комплексное лечение аллергических заболеваний у детей обязательно включает коррекцию дисбактериоза кишечника, что защищает организм от проникновения антигена во внутреннюю среду организма, способствует восстановлению плотного соединения клеток эпителия, активирует выработку секреторного IgA, что необходимо для защиты от аллергических и псевдоаллергических реакций.
В 2001 г. на базе 4-й городской детской клинической больницы г. Минска сотрудниками БГМУ (Назаренко О.Н., Юрчик К.В., Бондарь Т.А., Загорский С.Э.) была проведена работа с целью оценки эффективности применения пробиотика «Энтерожермина» (смесь 4 антибиотикоустойчивых штаммов Bacillus clausii) у детей с кожными проявлениями аллергии разной степени тяжести [12]. Результаты работы представлены на рисунке.
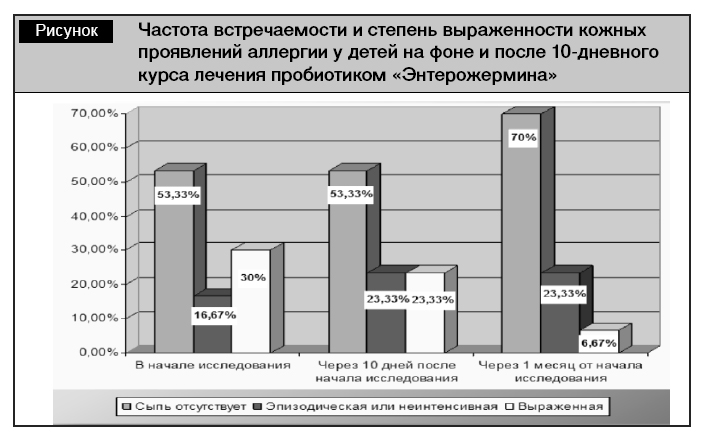
Применение Энтерожермины в течение 10 дней оказывает значительное улучшение состояния кожных покровов у детей, страдающих кожными проявлениями аллергии. Так, через месяц после 10-дневного курса лечения в 4 раза уменьшилось количество детей с тяжелыми проявлениями атопического дерматита, на 16,67% снизилась частота встречаемости кожных проявлений аллергии.
Смесь 4 антибиотикоустойчивых штаммов Bacillus clausii, являющихся составной субстанцией пробиотика «Энтерожермина», обладает важными свойствами для лечения дисбактериоза, имеет прямую антимикробную активность, продуцирует антибактериальную субстанцию семейства бактериоцинов, проявляя активность в отношении большинства грамположительных патогенов, в частности, Staphylococcus aureus, C. difficile, Enterococcus faecium, а также активируют иммунную систему человека, способствуют продукции витамина В2.
Использование пробиотика «Энтерожермина» позволяет решить важную для здоровья задачу – провести коррекцию дисбиоза, улучшив тем самым состояние кожных покровов у детей с атопическим дерматитом и иммунологический статус. Накопленный нами опыт применения данного препарата показывает высокую эффективность и безопасность его использования у детей различного возраста и позволяет рекомендовать более широкое использование этого пробиотика у детей с дисбактериозом и кожными проявлениями аллергии.
Таким образом, прежде чем лечить пациента с клиникой атопии, необходимо исключить дисбактериоз, хронические инфекции и инвазии организма, которые могут способствовать манифестации псевдоаллергии, так как дисбиоз кишечника, инфекции, простейшие (особенно лямблии) и гельминты вызывают в организме ряд изменений, создающих благоприятный фон для развития псевдоаллергии по всем известным механизмам [6–9, 20]. В таких случаях больший клинический эффект дадут рационально подобранные пробиотики, антигельминтные, антипротозойные, противогрибковые препараты, чем рутинное использование глюкокортикостероидных препаратов, создающих лишь эффект мнимого благополучия.
Учитывая, что наличие хронических полиинфекций в организме больных атопией зачастую является «маской» иммунодефицита, необходимо в план обследования детей с кожной формой аллергии включать иммунологическое обследование с консультацией иммунолога.
Л И Т Е Р А Т У Р А
1. Амиров, Н.Х. Региональные особенности аллергических заболеваний у детей / Н.Х. Амиров, В.Н. Цибулькина, Р.Ф. Хакимова // Казанский мед. журн. – 2004. – Т. 85, № 5. – С. 327–331.
2. Аллергология и иммунология: учеб. пособие / под ред. Н.Д. Чухриенко. – М., 2003. – 112 с.
3. Балаболкин, И.И. Современная концепция патогенеза и принципы терапии аллергических заболеваний у детей / И.И. Балаболкин // Педиатрия. – 2003. – № 4. – С. 52–57.
4. Дранник, Г.Н. Клиническая иммунология и аллергология / Г.Н. Дранник. – Одесса, 1999. – 603 с.
5. Дрынов, Г.И. Актуальные проблемы современной аллергологии / Г.И. Дрынов. – М., 2003. – 208 с.
6. Зайков, С.В. Гельминтозы и аллергические заболевания / С.В. Зайков // Клин. иммунология. Аллергология. Инфектология. – 2009. – № 3/2. – С. 24–35.
7. Казмирчук, В.Е. Аллергия и псевдоаллергия: пора не путать эти понятия / В.Е. Казмирчук // Клин. иммунология. Аллергология. Инфектология. – 2008. – № 3/1. – С. 6–11.
8. Копанев, Ю.А. Глистные инвазии у детей / Ю.А. Копанев // Практика педиатра. Паразитология. – 2006. – № 10. – С. 16–19.
9. Корниенко, Е.А. Актуальные вопросы коррекции кишечной микрофлоры у детей: учеб. пособие / Е.А. Корниенко. – М., 2006. – 48 с.
10. Михайлов, И.Б. Применение про- и пребиотиков при дисбиозе кишечника у детей: метод. особие / И.Б. Михайлов, Е.А. Корниенко. – СПб., 2004. – 23 с.
11. Назаренко, О.Н. Дисбактериоз кишечника у детей: факторы риска, особенности течения, современные подходы к диетической коррекции и применению пробиотиков: учеб.-метод. пособие / О.Н. Назаренко. – Минск, 2011. – 32 с.
12. Оценка эффективности применения пробиотика энтерожермины с целью коррекции дисбактериоза у детей / О.Н. Назаренко [и др.] // Мед. новости. – 2011. – № 2. – С. 98–100.
13. Патофизиология: учеб. пособие / П.Ф. Литвицкий [и др.]; под ред. П.Ф. Литвицкого. – М., 1995. – 752 с.
14. Ревякина, В.А. Эпидемиология аллергических заболеваний у детей и организация педиатрической аллергологической службы в России / В.А. Ревякина // Педиатрия. – 2003. – № 4. – С. 47–52.
15. Скепьян, Н.А. Аллергические болезни: дифференциальная диагностика, лечение / Н.А. Скепьян. – Минск, 2000. – 286 с.
16. Филатова, Т.А. Пищевая аллергия у детей: практические аспекты недостаточной эффективности диетотерапии / Т.А.Филатова // Педиатрия. – 2011. – Т. 90, № 6. – С. 64–70.
17. Хавкин, А.И. Функциональные нарушения пжелудочно-кишечного тракта у детей раннего возраста / А.И. Хавкин. – М., 2000. – 71 с.
18. Bjorksten, B. The environmental influence on childhood asthma / B. Bjorksten // Allergy. – 1999. – Vol. 54 (Suppl. 49). – P. 17–23.
19. Bjorksten, B. The intestinal microflora in allergic Estonian and Swedish 2-year-old children / B. Bjorksten, P. Naaber, E. Sepp, M. Mikelsaar // Clin. Exp. Allergy. – 1999. – Vol. 29. – P. 342–346.
20. Celic-Bilgili, S. The predictive value of specific immunoglobulin E levels in serum fov the outcome of oral food challenges / S. Celic-Bilgili, A. Mehl, A. Verstege // Clin. Exp. Allergy. – 2005. – Vol. 35. – P. 268–273.
21. Chandra, R.K. Food allergy and atopic disease: pathogenesis, prediction of high risk and prevention / R.K. Chandra, B. Gill, S. Kumari // Ann. Allergy. – 1993. – Vol. 71, N 6. – P. 495–502.
22. Upper respiratory tract infections in the first year of life and asthma in children up to the age of 7 years / S. Illi [et al.] // Am. J. Respir. Crit. Care Med. – 2000. – Vol. 161. – P. 707.
23. Reduced risk of hay fever and asthma among children of farmers / O.S. von Ehrenstein [et al.] // Clin. Exp. Allergy. – 2000. – Vol. 30, N 2. – P. 187–193.
24. World Allergy Organization (WAO). Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) Guidelines // Pediatr. Allergy Immunol. – 2010. – Vol. 21 (Suppl. 21). – P. 1–125.
Медицинские новости. – 2013. – №5. – С. 34–38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.