Chubarova A.S., Kurchenko V.P.
Belarusian State University, Minsk
Antioxidant activity characteristic of medication silymarin
in hepatoprotective drugs
Резюме. В нормально функционирующих клетках аэробных организмов уровень биорадикалов поддерживается на оптимальном уровне благодаря наличию сложной, многоуровневой системы антирадикальной защиты. Наиболее подвержена действию свободных радикалов печень, поскольку она играет главную роль в метаболизме чужеродных химических веществ. В связи с этим целью исследования было изучение и сравнение антиоксидантной активности силимаринов из гепатопротекторных лекарственных средств «Легалон», «Карсил», «Лепротек» и БАД «Расторопша экстракт» с водорастворимым аналогом витамина Е – тролоксом, а также оценка вклада в эффективность антиоксидантного действия силимарина отдельных флаволигнанов: силибинина, силикристина и силидианина. Показано, что в использованной модельной системе оценки антиоксидантной активности наиболее эффективными антиоксидантами выступили силидианин и силикристин, и они отвечают за проявление антиоксидантной активности силимарином. Анализ отдельных флаволигнанов в силимаринах из исследованных лекарственных средств и БАД выявил, что от их количества зависит степень проявления антиоксидантной активности силимарина.
Ключевые слова: силимарин, силибинин, силикристин, силидианин, антиоксидантная активность, тролокс, витамин Е, «Легалон», «Карсил», «Лепротек», БАД «Расторопша экстракт».
Summary. In normally functioning aerobic organisms’ cells bioradical’s level is maintained at an optimum level due to the presence of complex, multi-level anti-radical protection system. Most affected by free radicals is the liver, since it plays a major role in the metabolism of xenogenic chemicals. In this regard, the purpose of the research was to study and compare the antioxidant activity of silymarin from hepatoprotective drugs – «Legalon», «Carsil», «Leprotec» and dietary supplement «Rastoropshа extract» and a water soluble analog of vitamin E – trolox. As well as assessment of the individual flavolignans: silybinin, silychristin and silydianin contribution to the antioxidant efficiency of silymarin. It is shown that in the used model system the most effective antioxidants were silydianin and silychristin and they are responsible for the manifestation of the antioxidant activity of silymarin. Analysis of individual flavolignans antioxidant activity from investigated drugs and dietary supplement silymarin revealed that their composition responsible for the degree of antioxidant activity manifestation of silymarin.
Keywords: silymarin, silybinin, silychristin, silydianin, antioxidant activity, trolox, vitamin E, «Legalon», «Karsil», «Leprotek», BAS «Rastoropsha extract».
Возникновение и развитие многих патологических состояний связывают с повреждающим действием свободных радикалов на биомолекулы. У аэробных организмов – от простейших до млекопитающих – монооксид азота, анион-радикал кислорода, пероксид водорода и другие биорадикалы являются обычными метаболитами, образующимися в нормально функционирующих клетках. Существующие пути образования биорадикалов можно разделить на две группы: физиологически значимые пути и нефизиологические пути. В первом случае биорадикалы являются элементом той или иной функциональной системы организма, например неспецифического иммунитета или гуморальной сигнализации, и выполняют конкретную физиологическую функцию. Нефизиологическое образование биорадикалов часто представляет собой неферментативный процесс. Образующиеся в этих процессах биорадикалы в лучшем случае – малотоксичные побочные продукты метаболических и биоэнергетических процессов, в худшем – чрезвычайно опасные агенты, требующие детоксикации [1].
Наиболее подвержена действию свободных радикалов печень, поскольку она играет главную роль в метаболизме чужеродных химических веществ, в ходе которого образуются активные формы кислорода. При атаке гидроксильным радикалом ненасыщенных жирных кислот фосфолипидов мембран возникает цепная реакция перекисного окисления липидов и, как результат, повреждение мембран гепатоцитов. Гидроксильный радикал способен повреждать ультраструктуру ДНК, что может вести к гепатоканцерогенезу [2].
Печень, как орган, в котором происходит генерация большого количества свободных радикалов, обладает антиоксидантной системой защиты. Глутатионпероксидаза и каталаза обеспечивают разрушение перекиси водорода, супероксиддисмутаза обеспечивает интоксикацию супероксидного радикала, глутатионпероксидаза и глутатионтрансфераза участвуют в элиминации других кислородных радикалов. Ряд экзогенных веществ – ?-каротин, витамины А, Е, С, селен и силимарин – обладают антиоксидантными свойствами и способствуют работе эндогенной системе защиты от биорадикалов [2, 3].
В качестве лекарственной субстанции многих гепатопротекторных средств используется силимарин – экстракт из плодов расторопши пятнистой, в состав которого входят флаволигнаны: силибинин, силидианин и силикристин. Обнаружены две хеморасы этого лекарственного растения, в плодах которого доминирует силибинин или силидианин [4]. При производстве гепатопротекторных лекарственных средств на основе силимарина не контролируется хемораса, из которой его получают. В связи с этим существуют различия в биоэквивалентности этих лекарственных средств.
Цель исследования – изучение антиоксидантной активности субстанций силимарина из лекарственных средств «Легалон», «Карсил», «Лепротек» и БАД «Расторопша экстракт», сравнение их антиоксидантной активности с витамином Е в форме его водорастворимого аналога – тролокса, а также оценка вклада в эффективность антиоксидантного действия силимарина отдельных флаволигнанов: силибинина, силикристина и силидианина.
Материалы и методы
Экстракцию силимарина из лекарственных средств и БАД осуществляли по ранее описанной методике [5]. После удаления с таблеток и драже оболочек, их высушивания, измельчения проводили экстракцию силимарина 80%-ным этиловым спиртом в соотношении сухое вещество (г) : экстрагент (мл) – 1:7,5. Нерастворимые компоненты отделяли центрифугированием. Из полученных супернатантов готовили 5%-ные растворы, которые анализировали методом высокоэффективной жидкостной хроматографии для качественного и количественного определения отдельных флаволигнанов в полученных экстрактах. Анализ проводили на хроматографе «Agilent 1100» («Agilent Technologies», США), оборудованном диодно-матричным детектором. Колонка – «Диасфер С18» (250 ? 4,6 мм, размер частиц 5 мкм), температура колонки 40 °С. Подвижная фаза состояла из раствора фосфорной кислоты рН 2,3, и метанола. Режим подачи подвижной фазы – градиентная элюция. Регистрацию осуществляли при длине волны 288 нм. Скорость потока элюента составляла 1 мл/мин, объем пробы составлял 10 мкл.
Получение отдельных флаволигнанов – силикристина, силидианина и силибинина – в препаративных количествах для исследований механизма антиоксидантного действия проводили по ранее описанной методике [6].
Антирадикальную активность флаволигнанов и силимарина оценивали в модельной системе восстановления радикал-катиона АВТS?+ (2,2’-азино-бис(3-этил-2,3-дигидробензтиазолин-6-сульфокислота) согласно [7, 8]. АBТS-радикал, флаволигнаны и силимарин готовили в метаноле. В качестве стандартного антиоксиданта использовали тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновая кислота) – водорастворимый аналог витамина Е. После добавления к 1 мл раствора радикал-катионов АBТS?+ (А734 нм = 0,700 ± 0,050) 10 мкл тролокса или анализируемого антиоксиданта в конечной концентрации 0–15 мкмоль/л смесь тщательно перемешивали в течение 10 с и определяли оптическую плотность реакционной смеси на длине волны 734 нм. Антирадикальную активность выражали в процентах ингибирования АBТS+ по степени уменьшения концентрации его радикалов в системе под действием исследуемого соединения, который рассчитывали по формуле
% ингибирования = 100 ? (1–А2/А1),
где А1 – оптическая плотность раствора АBТS?+ на длине волны 734 нм без добавления исследуемого образца; А2 – оптическая плотность раствора АBТS?+после добавления исследуемого образца.
По калибровочной кривой было рассчитано уравнение линейной регрессии вида y = ax + b, которое использовали для дальнейших расчетов.
Приведенные в работе данные, полученные в результате трех независимых измерений, обрабатывали с использованием общепринятых методов вариационной статистики пакета «Анализ данных» программы Microsoft Office Excel 2003 (Microsoft Corporation) [9, 10]. Полученные данные приведены в виде М ± m, где М – среднее арифметическое, m – стандартная ошибка среднего. Различия между средними величинами в группах считали значимыми при р < 0,05.
Для оценки различий между малыми выборками использовали критерий U-критерий Манна–Уитни. Он позволяет выявлять различия между выборками, объемом от трех значений и не требует проверки на нормальность распределения [11].
Результаты и обсуждение
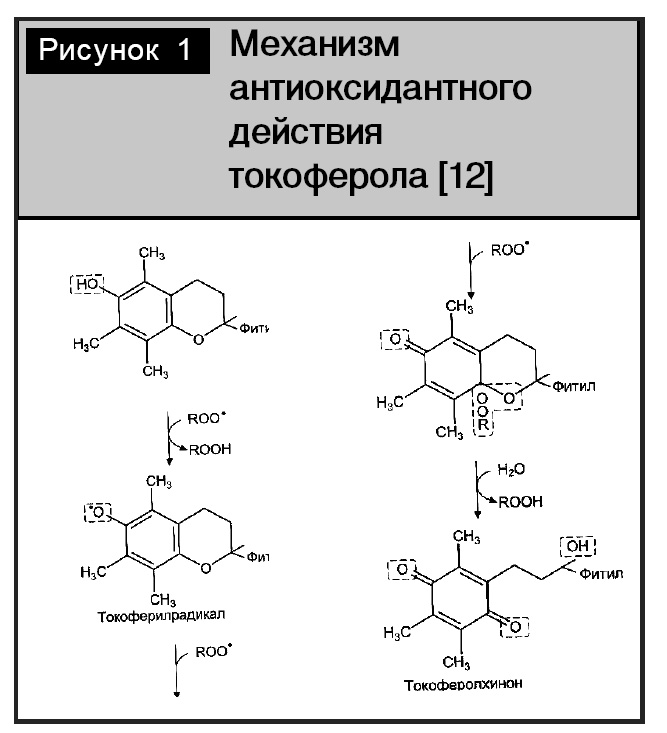
В качестве метода определения антиоксидантной активности исследуемых нами флаволигнанов была выбрана модель восстановления катион-радикала АВТS?+ (ТЕАС-метод). Этот метод широко используется для скрининга антиоксидантной активности биологически активных веществ различными научно-исследовательскими лабораториями. В такой модельной системе используют стандартный антиоксидант-сравнения – тролокс. По химической природе он представляет собой водорастворимый аналог витамина Е. Витамин Е – известный и широко применяемый антиоксидант. Его антиоксидантная активность доказана и хорошо изучена (рис. 1). Токоферолы оказывают антиоксидантное действие, при этом одна молекула витамина может обезвреживать два радикальных продукта за счет собственной окислительной модификации, превращаясь в нетоксичный токоферолхинон [12].
В качестве единицы измерения антиоксидантной активности силимаринов и флаволигнанов использовали величину IC50 – полуэффективная ингибирующая концентрация антиоксиданта, которая приводит к 50%-ному восстановлению катион-радикала АВТS?+. Чем меньше эта величина, тем эффективнее антиоксидант.
На рис. 2 представлены результаты измерения концентраций силимаринов из лекарственных средств, вызывающих 50%-ное восстановление катион-радикала АВТS?+.
Как видно из рис. 2, наилучшим антиоксидантом в этой системе выступил силимарин из лекарственного средства «Легалон». Его величина IC50 в 1,24 раза меньше, чем у стандартного антиоксиданта – тролокса, что свидетельствует о его высокой активности по сравнению с водорастворимым аналогом витамина Е. Силимарин из лекарственного средства «Карсил» обладал сравнимой антиоксидантной активностью с тролоксом. Силимарин из БАД «Расторопша экстракт» характеризовался наименьшей антиоксидантной активностью.
Следует отметить, что различия в антиоксидантных свойствах исследованных лекарственных средств могут быть связаны с особенностями состава флаволигнанов, входящих в их лекарственную субстанцию. В таблице представлены результаты анализа флаволигнанов в силимаринах из исследованных лекарственных средств и БАД
Таблица. Состав флаволигнанов в силимаринах из исследованных лекарственных средств и БАД (%)*
|
Лекарственное средство
|
Силидианин
|
Силибинин
|
Силикристин
|
|
Лепротек
|
5,93 ± 0,11
|
65,12 ± 1,36
|
28,95 ± 0,51
|
|
Карсил
|
13,65 ± 0,27
|
60,69 ± 1,24
|
25,66 ± 0,44
|
|
Легалон
|
16,71 ± 0,13
|
61,42 ± 0,96
|
21,87 ± 0,45
|
|
Расторопша экстракт (БАД)
|
8,62 ± 0,1
|
60,27 ± 1,47
|
31,11 ± 0,69
|
П р и м е ч а н и е: в таблице представлены значения относительного содержания флаволигнанов: силидианина, силибинина и силикристина; различия статистически достоверны при р < 0,05.
На основании приведенных данных можно сделать вывод о том, что соотношение индивидуальных флаволигнанов в проанализированных лекарственных средствах и БАД различается. Статистически достоверные различия обнаруживаются в составе силидианина. Содержание силибинина во всех исследованных лекарственных средствах и БАД было практически одинаковым (см. таблицу).
Чтобы доказать наличие связи между составом флаволигнанов в силимаринах из лекарственных средств и проявляемой ими антиоксидантной активностью, были исследованы активности индивидуальных флаволигнанов – силибинина, силикристина и силидианина – этим же ТЕАС-методом. Результаты представлены на рис. 3.
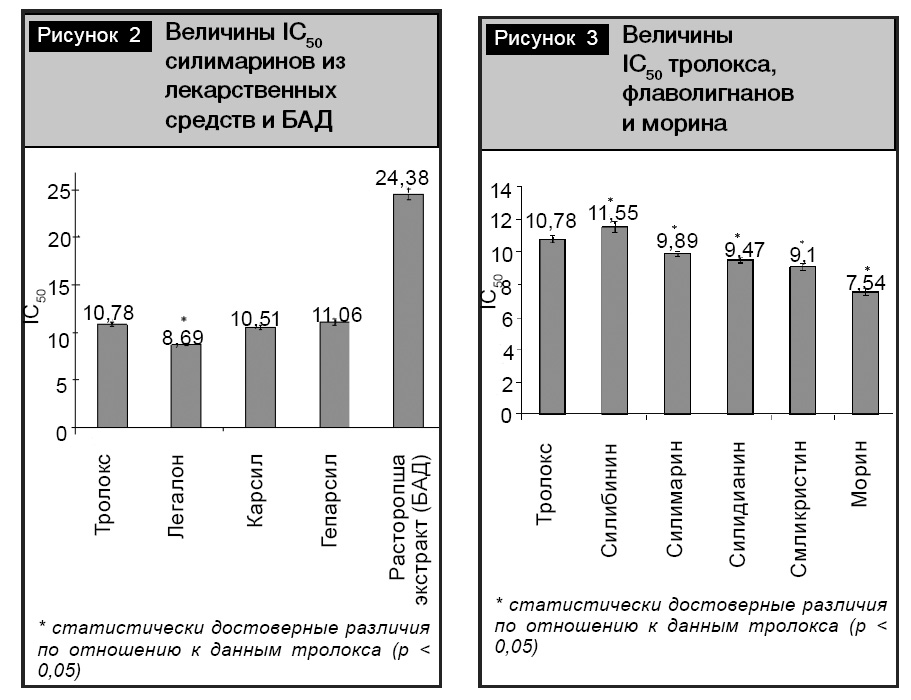
Как видно из рис. 3, наилучшими антиоксидантами являются силидианин и силикристин. Силибинин проявил минимальную антиоксидантную активность по сравнению с другими флаволигнанами и тролоксом. При сравнении количества силидианина в силимаринах из исследованных лекарственных средств была обнаружена связь между его количеством и проявляемой активностью силимарина в этой модельной системе. Таким образом, чем больше содержится силидианина в субстанции силимарина, тем выше его антиоксидантная активность.
Обнаруженные различия в составе флаволигнанов в силимаринах из лекарственных средств, а также проявляемой ими антиоксидантной активности в ТЕАС-методе являются причиной разной биоэквивалентности исследованных лекарственных средств, что может повлечь за собой различия в терапевтическом эффекте.
В состав «Легалона» – «эталонного» лекарственного средства из плодов расторопши пятнистой, входит до 16% силидианина, благодаря которому он проявил максимальную антиоксидантную активность среди всех исследованных лекарственных средств. Вероятно, именно состав компонентов силимарина и их соотношение в «Легалоне» определяет его фармацевтическую активность.
Таким образом, проведено исследование антиоксидантной активности силимаринов из лекарственных средств и индивидуальных флаволигнанов на модельной системе – ТЕАС-метод. Обнаружены различия в активности силимаринов из лекарственных средств, а также исследованных силибинина, силикристина и силидианина. Самой высокой антиоксидантной активностью обладал силимарин из лекарственного средства «Легалон», а среди флаволигнанов – силидианин. Выявлена взаимосвязь между компонентным составом силимаринов и проявляемой активностью: чем больше содержится силидианина, тем выше будет активность силимарина.
Л И Т Е Р А Т У Р А
1. Костюк, В.А. Биорадикалы и биоантиоксиданты / В.А. Костюк, А.И. Потапович. – Минск: БГУ, 2004. – 117 с.
2. Чиркин, А.А. Молекулярные механизмы повреждения печени / А.А. Чиркин // Иммунопатология, аллергология, инфектология. – 2000. – № 1. – С. 26–33.
3. Линевский, Ю.В. Возможности флавоноидных изомеров силимарина в лечении заболеваний печени / Ю.В. Линевский, К.Ю. Линевская, К.А. Воронин // Новости медицины и фармации. – 2009. – № 304. – С. 37–38.
4. Щекатихина (Чубарова), А.С. Гепатопротекторные свойства флаволигнанов / А.С. Щекатихина // Труды Белорус. гос. ун-та. Серия: Физиологические, биохимические и молекулярные основы функционирования биосистем. – Минск, 2009. – Т. 4, ч. 1. – С. 27–48.
5. Сокольская, Т.А. Создание лекарственных средств из плодов расторопши пятнистой (получение, стандартизация и контроль качества): дис. … д-ра фарм. наук: 15.00.02 / Т.А. Сокольская; Моск. мед. академ. им. И.М. Сеченова. – М., 2000. – 79 с.
6. Получение и характеристика фенилпропаноидных соединений из расторопши пятнистой и льна масличного / В.П. Курченко [и др.] // Труды Белорус. гос. ун-та. – Минск, 2010. – Т. 5, ч. 2. – С. 139–170.
7. Antioxidant activity applying an improved ABTS radical cation decolorization assay / R. Re [et al.] // Free Radical Biology and Medicine. – 1999. – Vol. 26, N 9/10. – P. 1231–1237.
8. Применение радикал-катионов АBТS + в оценке антирадикальной активности флаволноидов / И.Р. Ильясов [и др.] // Фармация. – 2008. – № 6. – С. 15–18.
9. Рокицкий П.Ф. Биологическая статистика / П.Ф. Рокицкий – Минск: Высш. школа. – 1967. – 272 с.
10. Лакин, Г.Ф. Биометрия: учеб. пособие для биол. спец. вузов / Г.Ф. Лакин. – 4-е изд., перераб. и доп. – Минск: Высш. шк., 1990. – 352 с.
11. Mann, H.B. On a test of whether one of two random variables is stochastically larger than the other / H.B. Mann, D.R. Whitney // Annals of Mathematical Statistics. – 1947. – N 18. – P. 50–60.
12. Биохимия: учебник для вузов / под ред. Е.С. Северина. – М.: ГЭОТАР-Медиа, 2003. – 779 с.
Медицинские новости. – 2013. – №3. – С. 64-66.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.