Prystrom A.M.1, Patseev S.V.2, Primakova A.M.2, Fomin O.Yu.2
1Belarusian Medical Academy of Post-Graduate Education, Minsk
21st City Clinical Hospital, Minsk, Belarus
The place of Nebivolol among ?-adrenergic blockers in the treatment of moderate arterial hypertension in pregnant women
Резюме. Приведена опубликованная информация по применению различных Β-адреноблокаторов в лечении артериальной гипертензии в период беременности. Обсуждаются преимущества и недостатки Β-адреноблокаторов по сравнению с другими антигипертензивными препаратами в лечении артериальной гипертензии у беременных женщин. Проанализирован опыт применения небиволола у 34 беременных с мягкой (умеренной) артериальной гипертензией. Показана возможность небиволола как в монотерапии, так и в комбинации с метилдопой и амлодипином, стабилизировать артериальное давление, а также устранять проявления нарушений плацентарного кровотока.
Ключевые слова: артериальная гипертензия, беременность, b-адреноблокаторы, небиволол.
Summary. In the article there is the published information on the usage of various Β-adrenergic blockers in the treatment of arterial hypertension during pregnancy. The advantages and disadvantages of Β-adrenergic blockers in comparison with other antihypertensive drugs for treatment of pregnant women with arterial hypertension are discussed. The experience of Nebivolol usage in 34 pregnant women with moderate arterial hypertension is analyzed. Nebivolol can be used as monotherapy and in combination with Methyldopa and Amlodipine to stabilize arterial pressure or to remove the manifestations of placental blood flow disorders.
Keywords: arterial hypertension, pregnancy, ?-adrenergic blockers, Nebivolol.
Гипертензивные нарушения в период беременности – основная причина материнской, фетальной и неонатальной заболеваемости и смертности. У женщин артериальная гипертензия (АГ) в период беременности увеличивает частоту преждевременных родов, отслойки нормально расположенной плаценты, цереброваскулярных осложнений, полиорганной недостаточности, развития ДВС-синдрома. Для плода наличие гипертензивных расстройств повышает риск развития внутриутробной задержки развития и внутриутробной гибели плода. Увеличивается частота неврологических и сердечно-сосудистых заболеваний у детей раннего возраста [28].
По оценкам разных авторов, частота АГ у беременных колеблется от 4 до 29%. Сегодня АГ у беременных – это каждая четвертая госпитализация; осложнения АГ – 20–30% случаев в структуре материнской смертности [30].
Медикаментозная терапия беременных с АГ вызывает разногласия, поскольку гипотензивная терапия оказывает неоднозначные эффекты на организм матери и плода: для женщины снижение артериального давления (АД) может приносить определенную выгоду, однако слишком низкое АД может ухудшать плацентарное кровообращение и тем самым нарушать развитие плода. Результаты некоторых исследований [22] с использованием нескольких классов антигипертензивных препаратов при мягкой (умеренной АГ) у беременных показали прямую линейную корреляцию между снижением среднего АД, вызванным лечением, и долей слишком маленьких для своего гестационного возраста детей, что не зависело от типа АГ, применяемого антигипертензивного препарата и продолжительности терапии.
Сегодня отсутствуют единые терапевтические подходы по вопросу начала терапии АГ. Одни авторы считают, что у беременных с мягкой (умеренной) АГ назначение антигипертензивных средств не требуется вообще, другие предлагают начинать антигипертензивную терапию у женщин с АГ во время беременности при уровне диастолического АД, устойчиво превышающем 90–100 мм рт. ст. [33].
В документе экспертов Европейского общества кардиологов, одобренном Европейским обществом акушеров-гинекологов и Европейской ассоциацией педиатров-кардиологов [29], только в случае развития гестационной гипертензии с протеинурией медикаментозная терапия рекомендуется при АД выше 140/90 мм рт. ст., а во всех остальных случаях – только при АД, превышающем 150/95 мм рт. ст.
Среди лекарственных препаратов в лечении АГ у беременных достаточно широкое применение находят Β-адреноблокаторы. Механизм их антигипертензивного действия обусловлен уменьшением сердечного выброса и частоты сердечных сокращений, в то время как общее периферическое сосудистое сопротивление (ОПСС) либо не меняется, либо возрастает [21]. С другой стороны, Β-адреноблокаторы, тормозя секрецию ренина и уменьшая высвобождение нор-адреналина из окончаний постганглионарных симпатических нервных волокон в результате блокады пресинаптических Β2-адренорецепторов, влияют на нейрогуморальные механизмы повышения АД [11]. Β-адреноблокаторам принадлежит приоритет в выборе антигипертензивного препарата у беременных с гиперкинетическим типом центральной гемодинамики [3].
Среди Β-адреноблокаторов у беременных могут применяться лабеталол, метопролол, пропранолол, небиволол, пиндолол, окспренолол, бетаксолол и некоторые другие.
В литературе имеются отдельные сообщения о том, что терапия лабеталолом ассоциировалась с рождением детей с низкой массой тела, что, однако, не было подтверждено в крупном исследовании, в котором терапию лабеталолом начинали на 6–13-й неделе беременности [31]. Поэтому на сегодняшний день считается, что лабеталол не оказывает влияния на внутриутробный рост плода в отличие от некоторых других Β-адреноблокаторов. В исследовании G. Bott-Kanner и соавт. [17] при применении у беременных с мягкой (умеренной) АГ пиндолола в суточной дозе 10–30 мг отмечалось эффективное снижение АД, увеличение маточно-плацентарного кровотока и даже (в среднем по сравнению с данными контрольной группы) массы тела новорожденных. Окс-пренолол в суточной дозе 40–160 мг не оказывал отрицательного действия на плод [26]. Данные метаанализов [21] также показали безопасность препарата для матери и плода. А.Н. Стрижаков и соавт. [14] сообщили об успешном использовании у беременных с АГ бетаксолола.
Выбор гипотензивного препарата широко варьируется в зависимости от географии и национальных особенностей. Так, экспертами Рабочей группы по высокому АД при беременности Национального института здоровья США и Национального института сердца, легких и крови США рекомендуется использовать препараты длительного действия, плавно снижающие АД, поскольку было отмечено, что колебания АД в течение суток, что происходит при назначении препаратов короткого действия, ухудшают фетоплацентарный кровоток. В качестве альтернативы метилдопы предлагается использовать лабеталол [36], в то время как австралийские эксперты из Β-адреноблокаторов рекомендуют использовать окспренолол и пиндолол [19]. Согласно рекомендациям ВОЗ [41], беременным для длительной терапии АГ следует использовать блокаторы Β-адренорецепторов, в частности окс-пренолол, пиндолол, атенолол (однако прием последнего ассоциируется с задержкой внутриутробного развития плода (ЗВРП)). Экспертами Европейского общества кардиологов в рекомендациях по ведению беременных с сердечно-сосудистыми заболеваниями (2003 г.) отмечается возможность безопасного применения на поздних сроках беременности атенолола, метопролола, пиндолола и окспренолола [38]. В то же время позиция экспертов Европейского общества артериальной гипертензии и Европейского общества кардиологов в рекомендациях по ведению АГ на протяжении последних лет претерпела изменения. Так, если в 2003 г. [27] применение Β-адреноблокаторов считалось возможным при мягкой (умеренной АГ), то в рекомендациях 2007 г. [37] в лечении АГ у беременных из Β-адреноблокаторов упоминается только лабеталол.
По эффективности и безопасности Β-адреноблокаторов при АГ у беременных женщин было проведено два больших метаанализа [16, 32]. Первый включил 40 исследований (3797 женщин), в которых сравнивались различные антигипертензивные препараты (в том числе и Β-адреноблокаторы) друг с другом или с плацебо. Результатом этих исследований явилось отчетливое снижение риска развития тяжелой АГ при лечении мягкой (умеренной) АГ. Однако антигипертензивная терапия при этом не отразилась на развитии осложнений АГ у матери и перинатальной смертности.
Результаты сравнительных исследований Β-адреноблокаторов с другими антигипертензивными препаратами противоречивы. Так, по итогам метаанализа 11 клинических исследований [15], включавших 787 женщин, в которых проводилось сравнение Β-адреноблокаторов с метилдопой, терапия Β-адреноблокаторами снижала частоту госпитализаций женщин. В редких случаях применение Β-адреноблокаторов приводило к брадикардии у плода. В целом же было показано, что Β-адреноблокаторы по сравнению с метилдопой одинаковы как по эффективности, так и по безопасности с точки зрения исходов для матери (развития тяжелой АГ и ее осложнений) и плода (перинатальной смертности) [15, 24, 32]. Информации по долгосрочному безопасному применению Β-адреноблокаторов очень мало. И хотя в целом Β-адреноблокаторы при беременности считаются эффективными и безопасными, сведений об их преимуществах перед метилдопой на данный момент не получено.
Основные противопоказания для назначения Β-адреноблокаторов: гиперчувствительность, кардиогенный шок, отек легких, брадикардия, атриовентрикулярная блокада II–III степени, декомпенсированная хроническая сердечная недостаточность, обструктивные заболевания дыхательных путей [7].
При передозировке Β-адрено-блокаторов наблюдаются патологическая брадикардия и блокада проводимости импульсов, бронхоспазм и т.д. Известно также, что препараты этой группы могут повышать сократительную способность матки, приводя к угрозе невынашивания плода, и нарушать постнатальную адаптацию новорожденного.
Вопрос безопасного для плода применения Β-адреноблокаторов беременными женщинами по-прежнему остается недостаточно изученным. Известно, что препараты проникают через плаценту. В ряде клинических исследований при назначении Β-адреноблокаторов указывается на формирование ЗВРП. Существует мнение, что Β-адреноблокаторы, в особенности атенолол, назначенные в ранние сроки беременности (в первом и в начале второго триместра) в связи с повышением ОПСС могут вызывать снижение массы новорожденного и плаценты, а также ЗВРП [11, 31].
В исследованиях с применением атенолола было обнаружено снижение массы новорожденного и плаценты, что было связано с выявленным повышением сопротивления в сосудах плода (пупочной артерии и аорте). Так, в одном небольшом исследовании [20] применение атенолола по сравнению с плацебо сопровождалось значительным увеличением риска рождения маловесных к сроку гестации новорожденных (отношение шансов 17,3; 95%-ный доверительный интервал 3,8–77,9). В других работах с использованием атенолола было обнаружено увеличение частоты преждевременных родов и снижение массы тела новорожденного и плаценты [18, 23], что было связано с выявленным повышением сопротивления в сосудах плода (пупочной артерии и аорте) [35].
В клиническом исследовании S. Bay-liss и соавт. [16] было показано, что если лечение атенололом начиналось в I триместре беременности, то наблюдалось замедление роста плода и уменьшение массы тела новорожденных на 139–512 г, при начале терапии препаратами со II три-местра этого нежелательного действия не обнаруживалось. В качестве препарата сравнения применяли нифедипин, прием которого с I триместра беременности не приводил к уменьшению массы тела новорожденных. По данным J.G. Ray и соавт. [39], атенолол по сравнению с нифедипином и метилдопой увеличивал число неблагоприятных исходов у новорожденных, причем этот нежелательный эффект не был зарегистрирован в исследованиях с применением пиндолола, окспренолола и лабетолола. В то же время по данным Российского многоцентрового эпидемиологического исследования «Лечебно-диагностическая тактика ведения беременных с артериальной гипертензией в России» (ДИАЛОГ) [13] атенолол является самым назначаемым Β-адреноблокатором у беременных с АГ. Хотя необходимо отметить, что только длительное применение атенолола сопровождается указанными побочными эффектами, тогда как его использование в течение короткого периода времени на поздних сроках относительно безопасно.
Применение атенолола, особенно с I триместра беременности, ассоциировалось с достоверно более высокой частотой развития фетоплацентарной недостаточности (ФПН), рождения детей с меньшей массой тела, повышения активности ренинангиотензиновой системы, снижения уровня важнейшего гормона беременности – прогестерона, а также гиперинсулинемии и тенденции к увеличению частоты развития гестационного сахарного диабета (ГСД). Кроме того, применение атенолола в суточной дозе 50 мг и более (в среднем 56,5 ± 13,1 мг/сут) ассоциировано с высокой частотой развития ФПН и более низкой (p < 0,05) массой тела новорожденных [10, 12].
В то же время в работе L.А. Magee и соавт. [31] было высказано предположение, что применение всех традиционных Β-адреноблокаторов (пропранолол, атенолол, метопролол и др.) во время беременности повышает риск рождения ребенка с недостаточной для данного гестационного срока массой тела. В 2000 г. P. von Dadelszen и соавт. был проведен метаанализ [25] ряда клинических исследований с применением Β-адреноблокаторов и сделаны выводы, что ЗВРП была обусловлена не столько эффектом Β-адреноблокаторов, сколько снижением АД в результате антигипертензивной терапии любым препаратом. Все антигипертензивные препараты одинаково снижали риск развития тяжелой АГ в 2 раза по сравнению с плацебо. При сравнении различных антигипертензивных средств между собой каких-либо преимуществ по влиянию на конечные точки (развитие тяжелой АГ, материнская и перинатальная смертность) не было выявлено.
Применение Β-адреноблокаторов начиная со II–III триместра считается безопасным и может использоваться вплоть до родоразрешения (Β-адреноблокаторы отменяются за 48–72 ч в связи с опасностью развития у плода и новорожденного таких побочных эффектов, как брадикардия, гипотензия, гипогликемия и угнетение дыхания [6]). В то же время их назначение, в особенности атенолола, в I триместре беременности считается неоправданным из-за опасения развития ЗВРП.
В связи с появлением сообщений о снижении массы новорожденного и плаценты, связанном с повышением ОПСС при назначении Β-адреноблокаторов в ранние сроки беременности [18, 23], препараты с вазодилатирующими свойствами могут оказаться наиболее востребованными в антигипертензивной терапии у беременных, поскольку не обладают подобными эффектами. Так, в работах О.Н. Ткачевой и А.В. Барабашкиной [1, 4] не было отмечено неблагоприятного влияния небиволола в суточной дозе 5 мг на плод, а также на состояние здоровья, рост и развитие детей в течение их первых 18 месяцев жизни.
Тем не менее применение Β-адреноблокаторов в Республике Беларусь в основном ограничивается метопрололом. Ряд Β-адреноблокаторов (лабеталол, пиндолол, окспренолол) в настоящее время не имеют регистрации и поэтому не могут быть использованы.
Цель исследования – анализ эффективности, безопасности и переносимости применения Β-адреноблокатора с вазодилатирующей активностью – небиволола – у беременных с мягкой (умеренной) АГ.
Материалы и методы
Под наблюдением находились 34 беременных женщины с АГ, которые проходили стационарное лечение в 1-й городской клинической больницы г. Минска. Верификация диагноза АГ проводилась в соответствии с общепринятыми рекомендациями [37]. АГ у беременных определялась как повышение АД >140/90 мм рт. ст. при двух и более последовательных измерениях с интервалом >4 ч в любом сроке беременности и в течение 6 недель после родов [38].
13 женщинам был выставлен диагноз гестационной гипертензии (ГГ), который определялся как АГ без протеинурии и отеков, впервые возникающая после 20-й недели беременности и исчезающая в течение 6 недель после родоразрешения, и согласно МКБ-10 соответствовал рубрике О13 (вызванная беременностью гипертензия без значительной протеинурии). У 21 женщины имела место эссенциальная АГ, которая выставлялась в случае, если повышение АД до 140/90 мм рт. ст. и более определялось до беременности или диагностировалось в течение первой половины гестации и сохранялось более 6 недель после родов и классифицировалась по МКБ-10 как О10 (подрубрика О10.0 – существовавшая ранее эссенциальная гипертензия, осложняющая беременность, роды и послеродовый период) [9]. По уровню повышения АД у всех женщин систолическое АД (САД) было в диапазоне 140–160 мм рт. ст., а диастолическое АД (ДАД) – 90–110 мм рт. ст., что согласно рекомендациям экспертов Европейского общества кардиологов [29] классифицировалось как мягкая (умеренная) АГ. У 4 беременных женщин имелся сахарный диабет (СД) 2-го типа, а в 6 случаях был выставлен диагноз ГСД.
Критерии включения в исследование: существовавшая до беременности АГ либо появление АГ в любом сроке беременности, возраст от 18 до 45 лет. Критерии исключения: симптоматическая АГ, «гипертензия белого халата», онкологические заболевания; болезни крови, врожденные и приобретенные пороки сердца со значимыми нарушениями гемодинамики, острые воспалительные и/или обострения хронических заболеваний почек, печени, щитовидной железы, психические расстройства, злоупотреб-ление алкоголем и наркотиками, отказ от участия в исследовании.
Средний возраст женщин составил 29,68 ± 5,93 года. Масса тела – 90 (76; 109) кг, от 61 до 144 кг. Срок беременности – 31 (27; 36) неделя, от 21 до 38 недель.
Наряду со стандартным клинико-инструментальным обследованием всем пациенткам выполнялась кардиотокография, которая представляет собой одновременную регистрацию ЧСС плода, двигательной активности плода и тонуса матки, а также проводилось ультразвуковое исследование состояния плода с доплерометрией на аппарате «Sonoline G60s». При проведении доплерометрии регистрировалась скорость тока крови в течение сердечного цикла в виде двухфазной кривой с максимальным уровнем в систолу – максимальная систолическая скорость и минимальным в диастолу – конечная диастолическая скорость. Проводилось определение кровотока в маточных (правой и левой), спиральных артерий беременной, в аорте, средней мозговой и артерии пуповины плода по общепринятой методике [8]. При оценке состояния кровотока определялось соотношение между скоростями кровотока в различные фазы сердечного цикла [34], проводился расчет общепринятых критериев (индекс резистентности, пульсовой индекс, систоло-диастолическое отношение).
Критерием нарушения кровотока служило повышение периферического сосудистого сопротивления, а в мозговых сосудах – снижение соответствующих значений более чем на 2 сигмальных отклонения по сравнению с нормой [40]. Нарушения гемодинамики в системе «мать – плацента – плод» оценивали согласно классификации А.Н. Стрижакова и соавт. [14] с выделением следующих степеней: IA – изолированное нарушение маточно-плацентарного кровотока; IБ – изолированное нарушение фетоплацентарного кровотока; II – нарушение маточно-плацентарного и фетоплацентарного кровотока, не достигающее критических изменений; III – декомпенсированное нарушение с централизацией кровотока.
Для оценки безопасности и переносимости проводимой терапии анализировались гестационные осложнения, такие как преждевременные роды, частота выявления нарушений плацентарного кровотока (ПК), частота сердцебиения плода.
Все пациентки в течение II–III триместров беременности с антигипертензивной целью получали Β-адреноблокатор с вазодилатирующей активностью – небиволол 1 раз в сутки в среднесуточной дозе 5 мг. 25 женщинам терапия небивололом была назначена впервые, 9 беременных принимали небиволол до госпитализации в среднем в течение 10 недель (от 2 до 17 недель) и продолжили его прием в стационаре.
Дополнительно с антигипертензивной целью 14 женщин получали метилдопу в дозе 750–1500 мг/сут (8 беременных) либо амлодипин в дозе 10 мг/сут (6 женщин). 10 беременных с целью улучшения ПК принимали дипиридамол в дозе 75 мг/сут. В 17 случаях проводилась инфузионная терапия актовегином, солкосерилом, аминофиллином, пентоксифиллином, калия оротатом.
Статистический анализ был выполнен при помощи компьютерного пакета программы Statistica 6.0. Достоверность различий между количественными переменными оценивалась двухвыборочным тестом Стьюдента (при нормальном распределении величин) либо тестом Манна–Уитни (при напараметрическом распределении). При обработке качественных признаков рассчитывались критерий ?2 с поправкой Йейтса на непрерывность, либо двухсторонний вариант точного критерия Фишера.
Результаты и обсуждение
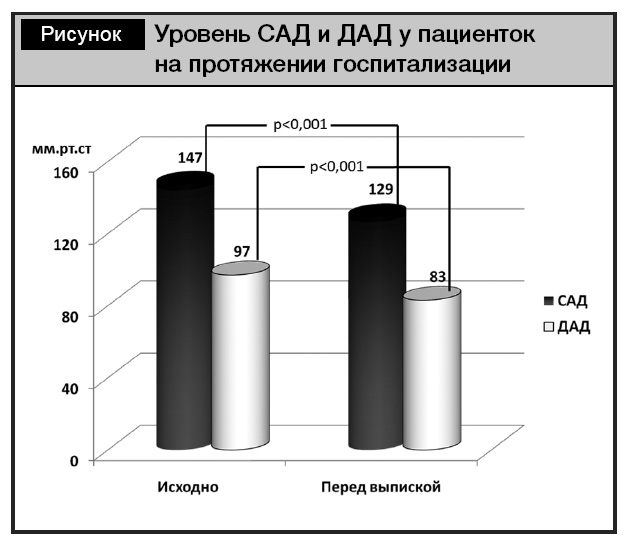
Все беременные были госпитализированы в стационар по причине дестабилизации АД. При поступлении уровень САД у беременных составлял 146,62 ± 6,71 мм рт. ст., а ДАД – 97,21 ± 6,29 мм рт. ст., при выписке АД снизилось (p < 0,001) до значений САД 128,53 ± 8,21 мм рт. ст. и ДАД 82,5 ± 6,06 мм рт. ст. 20 пациенток получали небиволол в дозе 5 мг/сут в монотерапии, в 14 случаях дополнительно использовались метилдопа в дозе 750–1500 мг/сут либо амлодипин в дозе 10 мг/сут. Причем в подгруппе беременных с ГГ только в двух случаях дополнительно использовался амлодипин, у 11 женщин монотерапии небивололом было достаточно для контроля АД. Комбинация небиволола с другими антигипертензивными препаратами была использована в 80% случаев сахарного диабета (как СД 2-го типа, так и ГСД). Применяемая лекарственная терапия привела к адекватному контролю АД (см. рисунок).
Уровень АД был стабилизирован в диапазоне САД 120–140 мм рт. ст. и ДАД 80–90 мм рт. ст. у всех пациенток. В одном случае было проведено родоразрешение в срок (38–39 недель), еще одна беременная была родоразрешена досрочно (в 34 недели) по причине декомпенсации ФПН. Все остальные женщины были выписаны из стационара с улучшением.
У трех беременных отмечался синдром ЗВРП 1-й степени, в том числе у двух женщин с СД. Во всех трех случаях проявления синдрома ЗВРП сохранились при выписке.
При проведении доплерометрии нарушения ПК различной степени были выявлены у 8 женщин: у шести – изолированное нарушение маточно-плацентарного кровотока (IA степень), у одной – изолированное нарушение фетоплацентарного кровотока (IБ степень) и еще у одной – нарушение маточно-плацентарного и фетоплацентарного кровотока (II степень). Проводимая за период госпитализации терапия позволила у 6 женщин устранить признаки нарушений ПК (p = 0,04), у одной беременной нарушение маточно-плацентарного кровотока сохранилось на момент выписки, а женщина с нарушением ПК II степени была досрочно родоразрешена.
Наличие АГ сопровождалось несколько более высокой (p > 0,05) частотой выявления нарушений ПК: 6 случаев (29%), в том числе оба случая необратимого нарушения ПК по сравнению с 2 (15%) при ГГ. Среди пациенток с ГГ только у одной был СД, в то время как при АГ – 9 случаев (p = 0,03).
Среди 10 беременных с СД у трех отмечалось нарушение ПК: в одном случае транзиторное изолированное нарушение IA степени, еще в одном – транзиторное изолированное нарушение IБ степени и у одной беременной – нарушение II степени, что потребовало досрочного родоразрешения.
У женщин в возрасте до 30 лет только в двух случаях (11%) было выявлено транзиторное нарушение ПК (1 – IA степени и 1 – IБ степени), в то время как в возрасте 30 лет и старше – у 6 (38%), р = 0,07, в том числе оба случая сохранившегося нарушенного ПК. Все 3 случая синдрома ЗВРП были выявлены в возрасте до 30 лет.
Длительное (от 2 до 17 недель) применение в 9 случаях небиволола не приводило к увеличению частоты выявления нарушений ПК по сравнению с женщинами, начавшими принимать небиволол в стационаре (33 и 25% соответственно, р > 0,05). При этом необходимо отметить, что 6 беременных принимали вместе с небивололом другие антигипертензивные препараты, и частота СД была аналогичной (33 и 40% соответственно, р > 0,05). Синдром ЗВРП при длительном применении небиволола был отмечен только у одной женщины (11%), тогда как два других были выявлены у беременных, не принимавших данный Β-адреноблокатор (8%), р > 0,05.
Монотерапия небивололом во всех четырех случаях позволила восстановить нарушенный ПК, в то время как при комбинации небиволола с другими антигипертензивными препаратами в двух из 4 случаев нарушение ПК сохранилось, что обусловлено наличием более высокого уровня АД, требующего комбинированной антигипертензивной терапии.
У одной женщины с ГГ, принимавшей небиволол с 29-й недели беременности, при госпитализации на 34-й неделе беременности по данным кардиотокографии была выявлена брадикардия плода, что было вызвано изменениями в плацентарной системе вследствие перенесенной ранее инфекции и не потребовало отмены небиволола. При динамическом наблюдении брадикардия у плода не выявлялась. Лечение пациентки было продолжено.
Каких-либо проявлений, связанных с плохой переносимостью терапии небивололом, в процессе наблюдения не было отмечено.
Таким образом, результаты проведенного исследования позволяют говорить о высокой эффективности, высокой безопасности и хорошей переносимости небиволола у беременных с мягкой (умеренной) АГ.
Монотерапия небивололом в дозе 5 мг/сут у женщин в 59% случаев позволяет стабилизировать АД, в 41% случаев необходима комбинация с другими антигипертензивными препаратами (метилдопа, амлодипин).
Нарушение ПК I–II степени было выявлено в 24% случаев беременных с мягкой (умеренной) АГ. Тенденция к росту числа нарушений ПК отмечалась у пациенток с СД, в возрасте старше 30 лет, а также при эссенциальной АГ, что, возможно, связано с большей длительностью повышения АД по сравнению с ГГ.
Монотерапия небивололом в дозе 5 мг/сут или его комбинацией с метилдопой либо амлодипином направлена не только на стабилизацию АД, но и на снижение частоты нарушений ПК. Длительная терапия небивололом (от 2 до 17 недель) не приводит к повышению частоты нарушений ПК, а также не повышает риск развития синдрома ЗВРП.
Л И Т Е Р А Т У Р А
1. Антигипертензивная терапия бета-блокаторами при артериальной гипертонии беременных: за и против / О.Н. Ткачева [и др.] // Кардиоваскуляр. терапия и профилактика. – 2003. – № 6. – С. 77–83.
2. Барабашкина, А.В. Лечение артериальной гипертонии беременных / А.В. Барабашкина, А.Л. Верткин, О.Н. Ткачева // Вопр. гинекологии, акушерства и перинатологии. – 2004. – Т. 3, № 4. – С. 51–56.
3. Белокрицкая, Т.Е. Дифференцированный подход к лечению артериальной гипертензии у беременных / Т.Е. Белокрицкая, А.П. Филев, В.С. Баркан // Рос. кардиол. журн. – 2006. – № 2. – С. 18–22.
4. Влияние небиволола на состояние сердечно-сосудистой системы и почек у женщин с артериальной гипертонией в период беременности и после родов / О.Н. Ткачева [и др.] // Терапевт. архив. – 2006. – № 10. – С. 56–61.
5. Дифференцированный подход к выбору терапии и акушерской тактики у беременных с артериальной гипертензией / А.Н. Стрижаков [и др.] // Вопр. гинекологии, акушерства и перинатологии. – 2004. – № 1. – С. 7–15.
6. Информация о лекарственных средствах для специалистов здравоохранения. Вып. 2: Лекарственные средства, действующие на сердечно-сосудистую систему. USP DI: пер. с англ. / под ред. М.Д. Машковского. – Рус. изд. – М.: РЦ «Фармединфо», 1997. – 388 с.
7. Лекарственные средства в Беларуси: Справочник Видаль. – М.: АстраФармСервис, 2007. – 976 с.
8. Медведев, М.В. Доплеровское исследование маточно-плацентарного и плодового кровотока // Клиническое руководство по ультразвуковой диагностике / под ред. В.В. Митькова, М.В. Медведева. – М.: Видар, 1996. – Т. 2. – С. 256–279.
9. Международная классификация болезней и проблем, связанных со здоровьем: МКБ-10. В 3 т. – Минск: ИнтерДайджест, 2000.
10. Мрочек, А.Г. Насколько оправдано применение атенолола в лечении артериальной гипертензии у беременных? / А.Г. Мрочек, А.М. Пристром // Кардио-логия в Беларуси. – 2009. – № 1 (02). – С. 46–55.
11. Основы клинической фармакологии и рациональной фармакотерапии / под ред. Ю.Б. Белоусова, М.В. Леоновой. – М.: Бионика, 2002. – 358 с.
12. Пристром, А.М. Все ли ?-адреноблокаторы одинаковы в лечении артериальной гипертензии у беременных? / А.М. Пристром // Пробл.здоровья и экологии. – 2008. – № 4. – С. 7–12.
13. Разгуляева, Н.Ф. Лечебно-диагностическая тактика и фармакоэпидемиология антигипертензивных лекарственных средств при артериальной гипертензии у беременных: автореф. дис. … канд. мед. наук / Н.Ф. Разгуляева. – М., 2007. – 26 с.
14. Стрижаков, А.Н. Ультразвуковая диагностика в акушерской практике / А.Н. Стрижаков, А.Т. Бунин, М.В. Медведев. – М.: Медицина, 1990. – 180 с.
15. A comparison of no medication versus methyldopa or labetalol in chronic hypertension during pregnancy / B.M. Sibai [et al.] // Am. J. Obstet. Gynecol. – 1990. – Vol. 162. – P. 960–967.
16. Antihypertensive drugs in pregnancy and fetal growth: evidence for «pharmacological programming» in the first trimester? / H. Bayliss [et al.] // Hypertens Pregnancy. – 2002. – Vol. 21. – P. 161–174.
17. Antihypertensive therapy in the management of hypertension in pregnancy – a clinical double-blind study of pindolol / G. Bott-Kanner G. [et al.] // Clin Exp Hypertension Pregnancy. – 1992. – Vol. 11. – P. 207–220.
18. Atenolol and fetal growth in pregnancies complicated by hypertension / C. Lydakis [et al.] // Am. J. Hypertens. – 1999. – Vol. 12. – P. 541–547.
19. Australasian Society for the Study of Hypertension in Pregnancy: The detection, investigation and management of hypertension in pregnancy: full consensus statement / M.A. Brown [et al.] // Am. J. Gynecol. – 2000. – Vol. 40. –P. 139–155.
20. Butters, L. Atenolol in essential hypertension during pregnancy / L. Butters, S. Kennedy, P.C. Rubin // Br. Med. J. – 1990. – Vol. 301. – P. 587–589.
21. Collins, R. Pharmacological prevention and treatment of hypertensive disorders in pregnancy / R. Collins, H.C.S. Wallenburg // Effective Care in Pregnancy and Childbirth / I. Chalmers, M. Enkin, M.J.N.C. Keirse (eds.). – Oxford: University Press, 1989. – P. 512–533.
22. De Swiet, M. Maternal blood pressure and birth weight [editorial] / M. De Swiet // Lancet. – 2000. – Vol. 355. – P. 81–82.
23. Effect of atenolol on birthweight / G.Y. Lip [et al.] // Am. J. Cardiol. – 1997. – Vol. 79. – P. 1436–1438.
24. Effects of methyldopa on uteroplacental and fetal hemodynamics in pregnancy-induced hypertension / S. Montan [et al.] // Am. J. Obstet. Gynecol. – 1993. – Vol. 168. – P. 152–156.
25. Fall in mean arterial pressure and fetal growth restriction in pregnancy hypertension: a meta-analysis / P. von Dadelszen [et al.] // Lancet. – 2000. – Vol. 355. – P. 87–92.
26. Gallery, E.D.M. Antihypertensive treatment in pregnancy: analysis of different responses to oxprenolol and methyldopa / E.D.M. Gallery, M. Ross, A.Z. Gyцry // Br. Med. J. – 1985. – Vol. 291. – P. 563–566.
27. Guidelines Committee. 2003 European Society of Hypertension – European Society of Cardiology guidelines for the management of arterial hypertension // J. Hypertens. – 2003. – Vol. 21, N 6. – P. 1011–1053.
28. Guidelines for the prevention of cardiovascular disease in women. AHA / L. Mosca [et al.] // Circulation. – 2011. – Vol. 123. – P. 1243–1262.
29. Guidelines on the management of cardiovascular diseases during pregnancy / V. Regitz-Zagrosek [et al.] // Eur. Heart J. – 2011. – doi:10.1093/eurheartj/ehr218.
30. James, P.R. Management of hypertension before, during, and after pregnancy / P.R. James, C. Nelson-Piercy // Heart. – 2004. – Vol. 90. – P. 1499–1504.
31. Magee, L.A. Fortnightly review: management of hypertension in pregnancy / L.A. Magee, M.P. Ornstein, P. von Dadelszen // BMJ. – 1999. – Vol. 318, Is. 7194. – P. 1332–1336.
32. Magee, L.A. Oral beta-blockers for mild to moderate hypertension during pregnancy (Cochrane Review) / L.A. Magee, L. Duley // Cochrane Database Syst. Rev. – 2003. – Is. 3. – CD002863.
33. Magee, L.A. The safety of antihypertensives for treatment of pregnancy hypertension / L.A. Magee, S. Abdullah // Expert. Opin. Drug. Saf. – 2004. – Vol. 3, N 1. – P. 25–38.
34. Neilson, J.P.Doppler ultrasound for fetal assessment in high risk pregnancies (Cochrane Review) / J.P. Neilson, Z. Alfirevic // Cochrane Database Syst. Rev. – 2000. – Is. 2. – CD000073.
35. Prevention of preeclampsia: a randomized trial of atenolol in hyperdynamic patients before onset of hypertension / T.R. Easterling [et al.] // Obstet. Gynecol. – 1999. – Vol. 93. – P. 725–733.
36. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy / R.W. Gifford [et al.] // Am. J. Obstet. Gynecol. – 2000. – Vol. 183, N 1. – P. 1–22.
37. The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension and of the European Society of Cardiology / G. Mancia [et al.] // Eur. Heart J. – 2007. – Vol. 28. – P. 1462–1536.
38. The Task Force on the Management of Cardiovascular Diseases During Pregnancy on the European Society of Cardiology. Expert consensus document on management of cardiovascular diseases during pregnancy // Eur. Heart J. – 2003. – Vol. 24. – P. 761–781.
39. Use of antihypertensive medications in pregnancy and the risk of adverse perinatal outcomes: McMaster outcome study of hypertension in pregnancy 2 (MOS HIP 2) / J.G. Ray [et al.] // BMC Pregnancy Childbirth. – 2001. – N 1. – P. 6.
40. Uterine blood flow velocimetry and placental changes in hypertensive and normotensive pregnancies with growth-retarded fetuses: a pilot study / G.P. Bulfamante [et al.] // J. Maternal. Fetal. Invest. – 1993. – Vol. 3, N 4. – P. 239–243.
41. World Health Organization – International Society of Hypertension 1999 Guidelines for the Management of Hypertension // High Blood Press. – 1999. – Vol. 8. – P. 1–43.
Медицинские новости. – 2013. – №2. – С. 70-75.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.