Ponomarev V.V., Khomichenko T.V., Krukova O.V.
Belarusian Medical Academy of Post-Graduate Education, Minsk, City Clinical Hospital №5, Minsk, Belarus
Mildronatum effectiveness in patients with chronic vascular cerebral failure
Резюме. Представлены результаты клинического и параклинического (УЗИ, КТ, МРТ) обследования 30 пациентов с I–II стадией дисциркуляторной энцефалопатии и их динамика в процессе лечения милдронатом. Обсуждаются клинические и нейропсихологические проявления заболевания, механизмы их формирования, а также результаты комплексной терапии. Отмечена хорошая переносимость милдроната.
Ключевые слова: хроническая сосудистая мозговая недостаточность, дисциркуляторная энцефалопатия, милдронат.
Summary. There are the results of clinical and paraclinical (ultrasound, CT, MRI) examination of 30 patients with the 1–2 stages of discirculatory encephalopathy and their dynamics during the treatment with mildronatum. The clinical and neuropsychological manifestations of disease, the mechanisms of their formation, and the results of complex therapy are discussed. There was noted a good tolerability of mildronatum.
Keywords: chronic vascular cerebral failure, discirculatory encephalopathy, mildronatum.
Хроническая сосудистая мозговая недостаточность (ХСМН) – состояние, проявляющееся постепенным прогрессирующим или ступенеобразным многоочаговым расстройством функций головного мозга, обусловленное недостаточностью мозгового кровообращения [1]. Этот термин устойчиво используется в клинической практике отечественными врачами разных специальностей, несмотря на то что в МКБ-10 данная патология не включена. ХСМН относится к числу возрастозависимых заболеваний, так как данная патология чаще развивается у лиц старше 50 лет при наличии одного либо нескольких факторов риска развития сосудистой патологии мозга в различных сочетаниях. С учетом отчетливой тенденции к увеличению средней продолжительности жизни и постарению населения в развитых странах Европы, в том числе в Беларуси, проблема ХСМН становится особенно актуальной для современной медицины [2–8].
К настоящему времени сформировано представление о многофакторном механизме развития ХСМН. Ведущими этиологическими причинами формирования этой патологии являются артериальная гипертензия, облитерирующий атеросклероз вне- или внутримозговых артерий и сахарный диабет. В зависимости от преобладания ведущей причины выделяют гипертензивную, атеросклеротическую, диабетическую либо смешанную ХСМН. В последнем случае обычно имеет место сочетание нескольких этиологических факторов ХСМН, однако при этом вклад каждого из них сложно оценить [2–4]. Патогенез заболевания обусловлен недостаточностью мозгового кровообращения и хронической ишемии головного мозга развивающейся в силу множества механизмов. К числу наиболее важных из них относят стойкое повышение тонуса мозговых сосудов, выходящих за рамки компенсаторных возможностей мозга; морфологические изменения сосудистой стенки, приводящие к ее ригидности; недостаточность коллатерального кровообращения; ухудшение реологических свойств крови; ухудшение системной гемодинамики [3–6].
В отечественной литературе выделяют следующие клинические формы ХСМН: начальные проявления цереброваскулярной недостаточности и дисциркуляторную энцефалопатию (ДЭП). В зависимости от выраженности основных клинических симптомов выделяют три стадии ДЭП. Клиническая картина ХСМН характеризуется постоянными либо приступообразными головными болями, чаще давящего или пульсирующего характера, системным или несистемным головокружением, неустойчивостью при ходьбе, шумом в голове, снижением зрения и слуха, приступами внезапного падения, когнитивными нарушениями (ослаблением памяти и внимания), эмоционально-волевыми расстройствами (раздражительностью, слабостью, утомляемостью, снижением настроения). На II и III стадиях ДЭП у пациентов появляются очаговые неврологические синдромы: псевдобульбарный, экстрапирамидный, вестибулярно-мозжечковый, пирамидный, нарушаются высшие корковые функции (речь, письмо, чтение, счет, праксис). Классическим течением ХСМН является ее ремиттирующий характер (в более чем 75% случаев), когда у пациентов чередуются периоды относительной стабильности и декомпенсации. Диагностика заболевания основана на анализе когнитивных, эмоционально-аффективных и очаговых неврологических проявлений, которые должны быть связаны с нарушениями гемодинамики и подтверждены результатами ультразвуковой доплерографии (УЗИ экстра- и интракраниальных сосудов), а также нейровизуализацией головного мозга при помощи КТ или МРТ [5, 6].
Терапевтическая тактика при ХСМН включает этиологическое, патогенетическое и симптоматическое лечение. Важное значение имеет коррекция всех возможных факторов риска, в первую очередь поддержание адекватного уровня систолического артериального давления на уровне 135–150 мм рт. ст. [5]. Медикаментозное лечение ХСМН включает антиагреганты (аспирин, курантил, плавикс), вазоактивные средства (кавинтон, трентал, сермион), ноотропы (ноофен, ноотропил), антиоксиданты и антигипоксанты (мексидол, актовегин, эмоксипин). Среди большого количества препаратов, защищающих головной мозг при ХСМН от повреждающего действия ишемии и обладающих антигипоксантным эффектом, внимание специалистов привлек милдронат, хорошо известный на фармацевтическом рынке Республики Беларусь и длительно успешно применяющийся при различной патологии внутренних органов и нервной системы (ишемическая болезнь сердца, сахарный диабет, черепно-мозговая травма, рассеянный склероз и др.) [7].
Милдронат – структурный аналог гамма-бутиробетаина и предшественник карнитина. Механизм действия препарата связан со снижением уровня карнитина и предотвращением транспорта длинноцепочечечных жирных кислот в митохондрии. При ишемии головного мозга препарат предупреждает нарушение транспорта АТФ и активирует гликолиз. Так как милдронат ограничивает транспорт через мембраны митохондрий только длинноцепочечных жирных кислот, в то время как короткоцепочечные могут свободно проникать в митохондрии и окисляться там, при этом не происходит накопления недоокисленных жирных кислот внутри митохондрий. Это означает, что милдронат не оказывает токсического действия на дыхание митохондрий [7].
Кроме того, в эксперименте было доказано, что при ХСМН милдронат оказывает селективное действие на ишемизированную зону головного мозга, противодействуя эффекту обкрадывания, что является негативной стороной применения большинства вазоактивных средств при этой патологии [3]. Ранее проведенными клиническими исследованиями было показано, что милдронат – эффективное средство терапии у пациентов с ДЭП [3–7]. Милдронат (Гриндекс, Латвия) выпускают в ампулах по 5 мл и в капсулах по 250 и 500 мг. Стандартная доза милдроната составляет 1000 мг/сут. Длительность курса лечения подбирают индивидуально.
Цель исследования – оценка эффективности влияния милдроната на основные клинические проявления ХСМН, его переносимости и безопасности.
Материалы и методы
С апреля по июль 2012 г. на базе II неврологического отделения 5-й клинической больницы г. Минска проведено параллельное открытое клиническое исследование у 60 пациентов с ХСМН, которые были разделены на две группы (основную и контрольную). Рандомизацию по группам провели методом случайной выборки. В основную группу вошли 30 пациентов с I–II стадией ДЭП (18 женщин и 12 мужчин, средний возраст составил 75,6 ± 1,1 года), диагноз у которых был вынесен в соответствии с классификацией сосудистых заболеваний головного мозга (Гусев Е.И., 1992). Преобладали пациенты (25 человек) с длительным течением заболевания (свыше 10 лет). Этиологическими причинами ДЭП в 10 случаях была артериальная гипертензия, у 6 пациентов – сахарный диабет 2-го типа, в 18 наблюдениях наблюдали смешанный характер заболевания (гипертензивный и атеросклеротический). В четырех случаях в анамнезе отмечали перенесенные инфаркты мозга в каротидном или вертебробазилярном бассейне с легкой резидуальной неврологической симптоматикой. Критерием включения пациентов в исследование было наличие неврологических и нейропсихологических нарушений, соответствующих I–II стадии ДЭП, которые были подтверждены инструментальными и лабораторными данными. Критерии исключения: возраст 85 лет и старше; декомпенсация сопутствующих соматических заболеваний; наличие стойкого неврологического дефицита; выраженные когнитивные нарушения сосудистого или иного происхождения; наличие индивидуальной переносимости препарата.
Все пациенты основной группы получали милдронат по 1000 мг (2 ампулы) внутривенно ежедневно в течение 8–10 дней, затем по 500 мг внутрь два раза в сутки (утром и вечером) в течение 30 дней. В комплекс лечения включали также гипотензивные и сахароснижающие средства (по показаниям), антиагреганты (аспирин, кардиомагнил). Исключали прием вазоактивных средств, других антигипоксантов или ноотропов.
Контрольную группу составили 30 больных ДЭП, сопоставимых с основной группой по тяжести клинических проявлений, возрасту, полу, стадиям заболевания, которые получали только базисную терапию.
Дизайн исследования включал стандартный соматический и традиционный неврологический осмотр. С целью оценки когнитивных нарушений проводили общепринятые нейропсихологические тесты: Краткую шкалу оценки психического статуса (MMSE), методику Мюнстенберга и тест «10 слов». При методике Мюнстенберга высчитывали показатель успешности «А», который максимально может быть равен 1, а его снижение указывает на ослабление внимания. Нейропсихологическое тестирование проводили до начала терапии, через 10 и 30 дней лечения.
Объективизацию хронических нарушений мозгового кровообращения у 28 пациентов основной группы провели с помощью УЗИ на аппарате «Intra-View» (Израиль). Исследовали линейную скорость кровотока в каротидном, вертебробазилярном бассейне и по артериям основания мозга. Вычисляли индекс циркуляторного сопротивления (ИЦС), пульсационный индекс (ПИ) и коэффициент асимметрии. В комплекс обследования всем пациентам включали магнитно-резонансную томографию (МРТ) головного мозга на аппарате «Vista Polaris» (США) с напряжением магнитного поля 1 Тесла или компьютерную томографию (КТ) на аппарате «Simmens Somatom» (Германия). Клинические проявления заболевания, результаты нейропсихологического тестирования и УЗИ брахиоцефальных сосудов оценивали до назначения терапии (при их поступлении в стационар), спустя 8–10 дней (на момент их выписки) и через 30 дней лечения при амбулаторном осмотре.
Переносимость, побочные реакции, осложнения милдроната и его эффективность регистрировали при помощи анкет. Результаты лечения по количественным оценочным шкалам обработаны с помощью программ Exсel и Statistica-6.0. Рассчитывали среднее арифметическое и стандартное отклонения. Степень достоверности определяли с помощью t-критерия Стьюдента. За уровень статистической достоверности принимали результаты при p < 0,05.
Результаты и обсуждение
До лечения у больных основной и контрольной группы в клинической картине преобладали жалобы на частые давящие головные боли в области затылка и/или висков, головокружение несистемного характера с нарушением равновесия, шум и звон в голове, снижение памяти и внимания, повышенную тревожность, раздражительность, плаксивость, нарушение сна, подавленность настроения. Часто (у 22 человек) отмечали эмоциональную лабильность с быстрой сменой настроения. В неврологическом статусе у всех пациентов выявляли негрубую симптоматику: легкие псевдобульбарные симптомы (Маринеску–Радовичи, хоботковый), шаткость при ходьбе и неустойчивость в позе Ромберга, асимметрию глубоких рефлексов, легкую замедленность движений. У подавляющего числа больных (24 человека) находили изменения корково-подкоркового типа в их когнитивном статусе. Так, выполняя тест MMSE пациенты набрали 24,1 ± 0,6 балла, что типично для легких когнитивных нарушений. При тесте «10 слов» больные после предъявления вспоминали только 5,0 ± 0,3 слов, что отражало ослабление кратковременной памяти. Показатель успешности выполнения теста Мюнстенберга составлял 0,4 ± 0,04, характерное для умеренного снижения внимания.
Проведение УЗИ брахиоцефальных артерий до назначения лечения у всех пациентов основной группы показало высокий ИЦС (>0,8) и ПИ >1,2; отмечали снижение эластичности сосудистой стенки и диффузное снижение скорости кровотока по исследуемым бассейнам различной степени выраженности (<45 см/с). У 18 пациентов наблюдали гипертонус и асимметрию кровотока по внутренней сонной, среднемозговой и заднемозговой артериям более 40%. По результатам КТ (МРТ) головного мозга у 4 больных основной группы выявлены кистозно-атрофические изменения в различных отделах мозга. В остальных наблюдениях отмечено умеренное расширение кортикальных борозд и желудочков мозга, а также снижение плотности белого вещества в перивентрикулярных областях (лейкоареоз).
Спустя 8–10 дней лечения 22 пациента основной группы отметили улучшение в своем состоянии, что чаще проявлялось уменьшением шума в голове, головокружения и нарушения равновесия. Кроме того, субъективно обследуемые отметили улучшения памяти и эмоционального состояния, однако по нашим данным динамика показателей теста MMSE, теста «10 слов» и методики Мюнстенберга оказалась недостоверной (рис. 1–3).
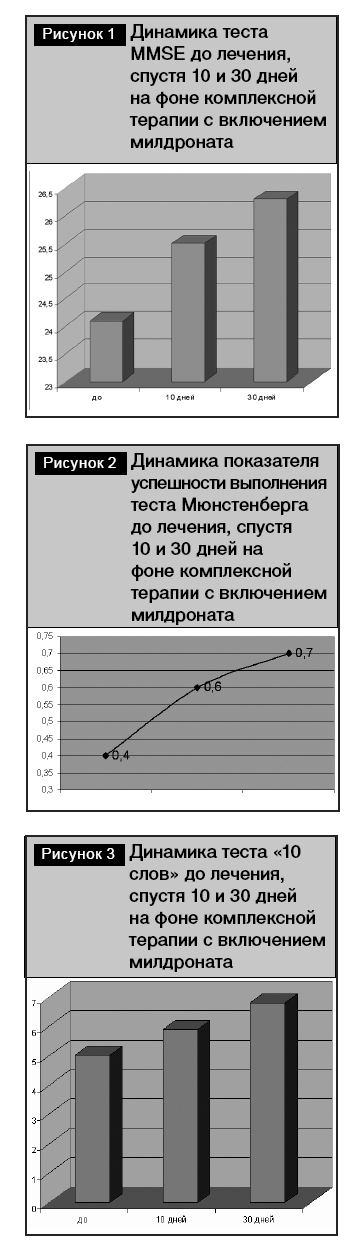
При повторном обследовании через 30 дней на фоне проводимой терапии улучшение отметили уже 28 пациентов, что касалось как их общего, так и психологического состояния. При этом нами отмечена достоверная положительная динамика при нейропсихологическом тестировании. Так, показатель теста MMSE увеличился до 26,3 ± 0,6 баллов (p < 0,05, рис. 1). Улучшилась память при проведении теста «10 слов» до 6,8 ± 0,3 слов (p < 0,05, рис. 3). Возрос показатель успешности при выполнении методики Мюнстенберга до 0,7 ± 0,04 (p < 0,05, рис. 2), что подтверждало улучшение внимания у пациентов основной группы.
При проведении УЗИ брахиоцефальных артерий в динамике у 20 больных обнаружили увеличение скорости кровотока по исследуемым бассейнам на 10–12%, уменьшение асимметрии, снижение ИЦС. У остальных пациентов значимых изменений мозгового кровотока не отмечали, что, вероятно, связано с недостаточной чувствительностью использованной методики, которая позволяет оценивать состояние только крупных магистральных артерий шеи.
Все больные продемонстрировали приверженность к назначенному лечению и закончили его согласно выбранному плану терапии. Из них 9 пациентов оценили результаты проводимого лечения как удовлетворительные, а 21 – как хорошие. Побочных эффектов милдроната, в том числе усиления болей в области сердца, конечностей или отрицательной динамики при ЭКГ, характерных для развития синдрома «обкрадывания», в основной группе не наблюдали.
В контрольной группе большинство пациентов также отмечали клиническое улучшение в состоянии, которое соответствовало показателям основной группы, однако их динамика была менее выраженной и стойкой.
Результаты завершенного исследования показали, что клинические проявления ДЭП обладают широким полиморфизмом симптомов и различаются в зависимости от стадии заболевания. На I стадии ДЭП субъективные нарушения пациентов преобладают над объективными данными. Однако при прогрессировании процесса на первый план выходят нейропсихологические и очаговые неврологические симптомы [1, 2]. В нашей работе объектом исследования были пациенты с I и II стадией ДЭП. Мы сознательно остановили свой выбор на этой категории больных в связи с тем, что они не имеют стойких, необратимых нарушений церебральных функций и еще имеют резерв нейропластичности, достаточный для терапевтического воздействия. Полученные результаты показали, что у большей части обследованных пациентов в клинической картине наряду с нарушениями равновесия преобладали легкие и умеренные когнитивные расстройства, не достигающие степени деменции. Об этом свидетельствовали выявленные нарушения при выполнении всех нейропсихологических тестов. Причем сочетание ослабления внимания и снижение кратковременной памяти указывало на то, что эти расстройства носили корково-подкорковый характер. Наличие у большинства пациентов нескольких факторов риска ХСМН, результаты УЗИ экстракраниальных сосудов и лейкоареоз при проведении КТ (МРТ) головного мозга подтверждали, что основной патогенетической причиной развития этой патологии является микроангиопатия.
Проведенные нами исследования подтвердили мнение большинства оте-чественных исследователей [1–6] о том, что значительная часть практикующих врачей часто некорректно используют термин ДЭП. Зачастую диагноз ДЭП в повседневной практике устанавливается исключительно по принципу наличия жалоб неврологического профиля у пожилых пациентов. В связи с этим считаем важным подчеркнуть, что наличие церебральных жалоб у лиц пожилого и старческого возраста не является доказательством сосудистой природы выявляемых неврологических симптомов. Под «маской» ДЭП в нашей стране нередко протекают болезнь Альцгеймера, опухоли головного мозга, хронические инфекции ЦНС и субдуральные травматические гематомы, требующие иных способов лечения. Необходимое условие для диагностики ДЭП – выявление причинно-следственной связи между клиническими симптомами и сосудистым поражением головного мозга, что нашло отражение в принятых в настоящее время диагностических критериях заболевания [4]:
1. Наличие клинических, анамнестических и инструментальных признаков поражения головного мозга.
2. Наличие клинических, анамнестических и инструментальных признаков хронической церебральной дисциркуляции.
3. Наличие причинно-следственной связи между нарушениями гемодинамики и развитием клинической, нейропсихологической и психиатрической симптоматики.
4. Клинические и параклинические признаки прогрессирования сосудистой мозговой недостаточности.
Наиболее важным доказательством наличия ХСМН в настоящее время считают методы нейровизуализация (КТ и МРТ головного мозга). Однако основные нарушения, определяемые с их помощью (церебральная атрофия и лейкоареоз), развиваются и при других патологических состояниях (дегенеративных, демиелинизирующих и др.), а также могут соответствовать возрастной норме [1]. Другой основной метод диагностики ДЭП – УЗИ брахиоцефальных сосудов, который может выявить компенсированный и клинически не значимый дефицит кровотока. Но с другой стороны, четких корреляций между клиническими и доплеровскими нарушениями часто не наблюдается. Таким образом, инструментальные характеристики состояния головного мозга и церебральных сосудов не могут во всех случаях служить достоверными критериями для диагностики ДЭП и особенно для определения ее стадий [1–3]. Указанные обстоятельства убеждают нас в необходимости комплексной клинической и параклинической оценки всех проявлений заболевания, которые необходимы для улучшения качества диагностики данной патологии.
Оценка эффективности назначенной нами комплексной терапии с включением инъекционной и капсулированной форм милдроната проведена на основании общего клинического впечатления раздельно врачом и пациентом во время заключительного визита. Мы обратили внимание, что в подавляющем числе случаев мнения врача и пациента в отношении результатов лечения совпадали, причем преобладала (в 21 случае) их «хорошая» оценка. На фоне терапии милдронатом наиболее выраженная положительная динамика была выявлена по улучшению нейропсихологических показателей, таких как кратковременная память и внимание. По-видимому, на фоне применения милдроната в силу наличия у него нейропротективного эффекта улучшается функция нейронов головного мозга. Однако, по нашим данным, достоверные позитивные нейропсхологические сдвиги достигаются только к 30–40-му дню терапии, что следует учитывать при выборе длительности курса лечения милдронатом. Кроме того, мы, как и другие исследователи [3, 6, 7], отметили хорошую переносимость препарата и в силу этого высокую приверженность пациентов к назначенному им лечению.
Таким образом, позитивное клиническое и фармакологическое влияние милдроната позволяет рекомендовать его в качестве препарата выбора патогенетической терапии ДЭП. С учетом достаточной эффективности и отсутствия побочных эффектов препарат заслуживает широкого применения в амбулаторных и стационарных условиях лечебно-профилактических учреждений.
Л И Т Е Р А Т У Р А
1. Болезни нервной системы / Под ред. Н.Н. Яхно. – М., 2005. – Т. 1. – С. 275–284.
2. Гусев В.И., Скворцова В.И. Ишемия головного мозга. – М., 2001. – 328 с.
3. Дамулин И.В., Коберская Н.Н., Антоненко Л.М. // Неврол. журн. – 2006. – № 1. – С. 45–49.
4. Захаров В.В. // Междунар. неврол. журн. – 2009. – № 5. – С. 51–55.
5. Крылова В.Ю., Насонова Т.И., Турчина Н.С. // Междунар. неврол. журн. – 2007. – № 3. – С. 31–35.
6. Локшина А.Б., Захаров В.В. // Неврол. журн. – 2006. – Прилож. 1. – С. 57–63.
7. Мурашко Н.К. // Междунар. неврол. журн. – 2012. – № 4. – С. 111–120.
8. Суслина З.А., Максимова М.Ю., Федорова Т.Н. // Неврол. журн. – 2007. – № 4. – С. 4–8.
Медицинские новости. – 2013. – №1. – С. 51-54.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.