SalivonchykD.P.
Gomel State Medical University, Belarus
Advantages of Preduktal MR in treatment of patients with coronary heart disease (DHC)
Резюме: Преимущество использования антиангинального препарата Предуктал MR заключается в улучшении энергетических возможностей кардиомиоцита вне зависимости от факторов, вызывающих ишемию, поэтому он является необходимым компонентом терапии ИБС. Выраженность антиангинального и антиишемического эффекта не уступает бета-блокаторам, нитратам, антагонистам кальция, кроме того, Предуктал MR при длительном лечении позволяет не только снизить частоту ангинозных приступов и количество потребляемого нитроглицерина, но и снизить частоту госпитализаций и увеличить выживаемость пациентов с ИБС, тем самым обеспечивая должный экономический эффект.
Ключевые слова: Предуктал MR, антиангиальный эффект, ишемическая болезнь сердца.
Abstract:The advantage of usinganti-anginaldrugPreductalMRis the improvement of the energycapacity of cardiomyocytesregardless ofthe factors causingischemia,therefore, it is an essentialcomponent oftherapy for coronary artery disease.The magnitude of antianginal and antiischemiceffectsis comparable with beta-blockers,nitrates,calcium antagonists. In addition,long-term treatment withPreductal?MR allows not only toreduce the frequency ofanginalattacks andnitroglycerinintake, but also to decrease the incidence of hospitalizationsand to increasesurvival in patients withcoronary artery disease, thereby providinga propereconomic impact.
Keywords:Preductal MR, antianginal effect, coronary artery disease.
Заболеваемость и смертность от сердечно-сосудистой патологии по-прежнему занимают лидирующее положение, составляя до 50–55% всех причин, приведших к фатальным исходам [5]. В этой печальной статистике основной патологией является ишемическая болезнь сердца (ИБС), причем львиная доля принадлежит инфаркту миокарда (ИМ) [4, 5]. В?эру доказательной медицины наука пробует расставить точки и запятые в лечении различных нозологий, поэтому нам также важно остановиться на определенных цифрах и проанализировать основные патогенетические механизмы развития ишемии. Патогенетической основой стенокардии является стенозированная коронарная артерия (КА), поврежденная атеросклеротическим процессом, местное воспаление, активация эндотелиальных факторов, нарушение в системе гемостаза либо рецидивирующая острая ишемия миокарда, возникающая в тех же зонах, где развились некротические изменения вследствие уже перенесенного ИМ [6].
ИБС является одним из самых распространенных заболеваний в странах Европы и США, определяя 2–5% патологии у лиц в возрасте до 55 лет, 10–20% – до 74 лет и до 50%?– у лиц старше 75?лет. Непрямые потери государства по причине ИБС составляют миллиарды долларов, унесенные жизни оценить невозможно [30].
Лишь небольшая часть пациентов госпитализируется с острой кардиальной патологией, включая острый коронарный синдром (ОКC). Однако именно этой категории пациентов представлены страницы авторитетных журналов, именно они имеют максимальный риск фатального прогноза, именно под них создается высокотехнологичное оборудование, позволяющее войти в стенозированную КА, восстановить ее просвет и спасти жизнь пациенту [5, 6]. Остальному большинству ранняя инвазивная стратегия может принести улучшение качества жизни (КЖ) на срок до 5 лет, что продемонстрировано в достаточно большом количестве рандомизированных многоцентровых исследований [6]. Анализ исходов при инвазивной стратегии неутешителен: в течение 5 лет наблюдения в повторных эндоваскулярных вмешательствах нуждаются 51,7% пациентов. Следующее за этим снижение КЖ при высоких затратах на лечение снижает мотивацию пациента и доверие к врачу [1].
Выбор оптимального метода лечения ИБС. В 68% случаев ИМ развивается у лиц со стенозом коронарных сосудов менее 50%, в 18%?– со стенозом от 50 до 70% и только 14%?– со стенозом от 70% и выше, когда у большинства пациентов появляется клиника стабильной стенокардии напряжения (ССН) или, как предвестник ИМ, нестабильной стенокардии (НС) [30]. То есть большинство наших пациентов (68%) не имеют гемодинамически значимых стенозов – основного показания к оперативному вмешательству, но потенциально неблагоприятных по риску жизненно опасных коронарных осложнений.
Таким образом, стенозы КА – это не катастрофа, а причина снижения КЖ, толерантности к физической нагрузке. Большее значение имеет характеристика атероматозных бляшек, нежели уровень и степень стенозирования артерий сердца, поскольку их состояние определяет прогноз жизни для больных с ИБС. Впечатляющими оказались результаты исследования COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation), выполненного в 1999–2004 гг. на 2287 больных со ССН, доказанной ишемией миокарда, леченных либо с помощью чрескожного коронарного вмешательства (ЧКВ) либо медикаментозно. У?всех пациентов был выраженный стеноз (>70%) проксимального сегмента эпикардиальной КА и ишемия миокарда при неинвазивном нагрузочном тестировании или на ЭКГ покоя, также со стенозом 80% и выше. Хотя через год после реваскуляризации миокарда количество приступов стенокардии было несколько меньше, чем у леченных медикаментозно, через 5 лет наблюдения в этом плане разницы между пациентами не было. Также не было разницы между группами по влиянию на смертность и развитие нефатальных ИМ [9]. Показано, что ЧКВ существенно не влияет на риск возникновения опасных для жизни коронарных катастроф и смертности у большинства пациентов, за исключением больных в раннем постинфарктном периоде [39]. В частности, в субанализе датского исследования DANAMI (DANish Acute Myocardial Infarction study), включившем 1008 больных, которым вследствие ОИМ сразу же был проведен тромболизис, но оставалась симптоматическая или асимптоматическая ишемия миокарда, показано, что инвазивное вмешательство на коронарных сосудах снизило риск возникновения повторных ИМ и госпитализаций по поводу эпизодов НС, что не подтверждено у лиц со ССН [18, 26, 31].
Важно понимать, что реваскуляризация и медикаментозная терапия – это не конкурирующие технологии, а взаимодополняющие методы лечения, причем базисным из них является последняя.
Современные реалии защиты кардиомиоцита (КМЦ) от ишемического повреждения. При ИБС традиционно назначаются гемодинамические антиангинальные и антиишемические средства, такие как бета-aдреноблокаторы, ивабрадин, антагонисты кальция и нитраты. Использование антиангинальных препаратов гемодинамического действия основано на том, что согласно общепринятой точке зрения, миокардиальная ишемия?– это следствие дисбаланса между доставкой О2 к КМЦ и их потребностью в О2. Поэтому важное значение приобретает уменьшение просвета КА, снижение доставки О2 за счет атеросклеротического повреждения и сужения последней и повышения числа сердечных сокращений. Это ведет к увеличению потребления О2, доставка которого ограничена вследствие стеноза коронарных сосудов, снижению коронарного резерва и кровоснабжения самих КМЦ за счет укорочения диастолы [1].
Среди гемодинамических препаратов по доказательной базе выделяется ивабрадин (Кораксан, Les Laboratoires Servier, Франция), доказавший снижение риска развития инфаркта миокарда на 73% у пациентов с ССН (независимо от перенесенного ИМ), а также ?-aдреноблокаторы, которые повышают выживаемость пациентов с ИМ в анамнезе [1, 17].
Однако ИБС – это более обширный процесс, чем простой дисбаланс между снабжением миокарда О2 и потребностью в нем. Одним из ключевых факторов развития ишемии является нарушение энергетического метаболизма в КМЦ вследствие дисбаланса между окислением глюкозы и свободных жирных кислот, что приводит к сокращению выработки ATФ, ацидозу клетки и перегрузке ее кальцием, нарушению гомеостаза клетки. Современные научные воззрения на патогенез ИБС и метаболические нарушения в миокарде, возникающие при ишемии, требуют сосредоточиться в не меньшей мере на процессах, протекающих в КМЦ, чем на процессах в области КА, и выбрать стратегию лечения, сразу нацеленную на защиту КМЦ от ишемического повреждения. Это обеспечивает эффективное лечение ИБС независимо от механизма, способствующего его возникновению. Поступающий к миокарду О2 нужен исключительно для создания энергетического субстрата (АТФ), необходимого для полноценной работы, именно для предупреждения его дефицита в условиях ишемии. Такой подход к терапии пациента наиболее трудоемок и более эффективен [1].
Под метаболической цитопротекцией в кардиологии подразумевается улучшение энергетического метаболизма КМЦ путем фармакологического управления в нем процессами образования и переноса энергии, реализуемого на уровне самого кардиомиоцита?– без влияния на перфузию сердечной мышцы (величина коронарного кровотока) и на гемодинамические условия ее функционирования (ЧСС, пред- и постнагрузку). Несмотря на очевидную привлекательность подобного рода подхода и значительный суммарный объем экспериментальных данных, свидетельствующих в пользу целесообразности применения в кардиологической клинике тех или иных из многочисленных метаболических средств, почти для всех из них отсутствуют надлежащие доказательства их клинической эффективности у пациентов с сердечно-сосудистыми заболеваниями. Единственным антиангинальным препаратом, реально улучшающим состояние клеточного гомеостаза и увеличивающим выработку АТФ (на 33%) в условиях хронической ишемии, является ингибитор 3-кетоацил КоА-тиолазы (3-КАТ) триметазидин (Предуктал?MR, Les Laboratoires Servier, Франция). Механизм действия Предуктала?MR основан на ингибировании окисления жирных кислот (ЖК) при повышении интенсивности более результативного для жизни клетки энергообеспечения?– окисления глюкозы [8]. Предуктал MR остается единственным зарегистрированным в Европе антиангинальным препаратом с метаболическим механизмом действия, результаты клинических исследований которого позволили экспертам Европейского общества кардиологов официально рекомендовать его в качестве препарата для лечения пациентов со ССН [18].
Для четкого понимания механизма терапевтического действия Предуктала MR при ИБС следует коротко остановиться на ключевых звеньях энергетического метаболизма миокарда в норме и в условиях его ишемии/реперфузии.
Энергетический метаболизм миокарда в норме. Необходимое для нормального функционирования кардиомиоцитов количество АТФ (в миокарде сердца человека?– в сутки около 30 кг) образуется в их митохондриях в результате последовательной цепи химических превращений с потреблением О2 (цикл трикарбоновых кислот или Кребса, а затем окислительное фосфорилирование), исходным субстратом для которых является ацетил-коэнзим?А (ацетил СоА). Последний окисляется в цикле Кребса до СО2 с образованием АТФ и восстановленной формы никотинамид-аденин-динуклеотида (NADH), который, попадая в сложную полиферментную цепь переноса электронов, локализованную во внутренней мембране митохондрий, окисляется с образованием в итоге воды и главной доли всей синтезируемой АТФ.
Необходимое количество исходного субстрата для вышеуказанной цепи реакций – ацетилСоА – образуется в основном в результате параллельного функционирования двух различных биохимических путей, для одного из которых исходным субстратом являются свободные жирные кислоты (СЖК), а для другого – глюкоза (рис. 1) [32].
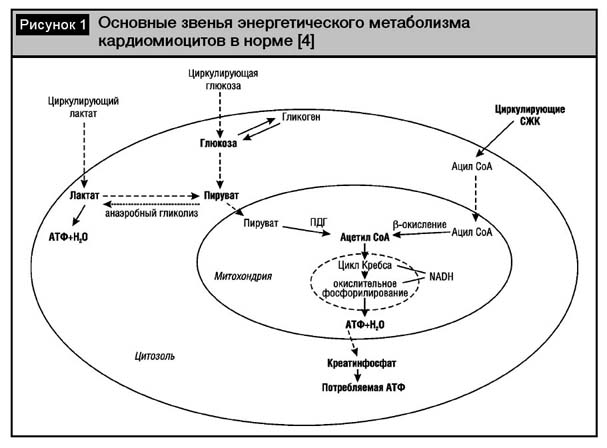
Захватываемые из кровотока СЖК активируются (этерифицируются) энзиматическим путем с образованием длинноцепочечных молекул ацил-коэнзима А (ацилСоА). Последние затем в последовательной цепи реакций (так называемый карнитин-челночный механизм с участием 3?ферментов, локализующихся в области наружной и внешней мембран митохондрий) транспортируются внутрь митохондрий, где в другой цепи реакций (так называемого бета-окисления, представляющего собой заключительный этап метаболизма жирных кислот (ЖК)) расщепляются до ацетил СоА. В?нормальных условиях промежуточные продукты метаболизма СЖК (а именно, образующийся в процессе транспорта ацилСоАацилкарнитин, а также сам ацилСоА) не накапливаются в митохондриальном матриксе, поскольку с адекватной скоростью подвергаются биохимическому превращению [3, 25].
Глюкоза, поступающая в клетку из кровотока, либо образующаяся в результате расщепления гликогена (полимер, состоящий из многих молекул глюкозы, депонированный в клетке в виде гранул), подвергается последовательной энзиматической трансформации с образованием в итоге пировиноградной кислоты (пирувата). В отличие от метаболизма СЖК, в обязательном порядке требующего О2, метаболизм глюкозы предусматривает два пути образования АТФ – с участием О2 (аэробный гликолиз) и без его участия (анаэробный гликолиз). Аэробный гликолиз осуществляется после транспортирования молекул пирувата в митохондрию путем его необратимого превращения (декарбоксилирования) с помощью пируватдегидрогенезы (ПДГ) в тот же ацетилСоА, с последующим вступлением последнего в цикл трикарбоновых кислот и далее – в процессы окислительного фосфорилирования. Анаэробный гликолиз (играющий важную биологическую роль при развитии ишемии) подразумевает превращение пирувата без участия О2 в цитозоле кардиомиоцита (то есть вне митохондрий) под влиянием лактатдегидрогеназы (ЛДГ) в молочную кислоту (лактат), в результате чего образуется относительно небольшое количество АТФ и вода [25, 29]. Данная реакция является обратимой, причем в норме (то есть при отсутствии дефицита поступления в миокард О2) осуществляется превращение лактата под влиянием той же ЛДГ в пируват, в результате которого молочная кислота выступает дополнительным субстратом для образования энергии в аэробном пути превращения глюкозы. При этом, соответственно, происходит активный захват кардиомиоцитами лактата из кровотока. Схема образования энергии в КМЦ представлена на рис. 1.
В нормальных условиях доминирующим путем образования энергии в КМЦ является метаболизм СЖК, обеспечивающий синтез 60–80% всего АТФ. Глюкозозависимый путь синтеза энергии обеспечивает образование 20–40 % АТФ, в том числе анаэробный гликолиз не более 2?%. Окисление глюкозы представляет собой более экономичный, по сравнению с окислением СЖК, способ образования энергии в миокарде, поскольку для синтеза аналогичного количества молекул АТФ требуется, по различным данным, на 10–30?% меньше О2 [7, 29, 35].
Поскольку для синтеза необходимого для нормальной жизнедеятельности клетки количества молекул АТФ должно образовываться соответствующее количество ацетилСоА, то подавление активности любого из двух вышеописанных путей его образования сопровождается компенсаторной активацией (по принципу реципрокного взаимодействия) другого пути.
Образовавшийся в митохондриях АТФ транспортируется в цитозоль клетки для реализации энергозависимых функций последней– сокращения и расслабления (требующих более 70% всех АТФ), синтеза протеинов и небелковых структур, работы энзимов и ионных насосов [21]. Поскольку внутренняя мембрана митохондрий непроницаема для молекул АТФ, из митохондрий энергия транспортируется наружу в виде креатинфосфата– посредством короткого цикла биохимических превращений, обеспечиваемых специальной (так называемой креатинкиназной) ферментной системой. Поддержание стабильной концентрации АТФ в условиях его постоянного активного потребления клеткой обеспечивается путем его перманентного рефосфорилирования за счет креатининфосфата. Поэтому поддержание стабильного соотношения креатининфосфат/АТФ отражает адекватность энергетического метаболизма клетки [40].
Изменения энергетического метаболизма миокарда в условиях ишемии и реперфузии. Ишемия миокарда характеризуется нарастающими и взаимосвязанными изменениями со стороны каждого из двух описанных биохимических путей энергообразования. Эти изменения запускают, в свою очередь, в КМЦ каскад неблагоприятных, с точки зрения их нормального функционирования и выживания, сдвигов на молекулярном уровне.
При возникновении умеренной ишемии миокарда (отвечает ограничению в экспериментальных условиях коронарной перфузии на 30–60%) немедленно увеличиваются захват клетками из крови глюкозы и ее образование из гликогена. При этом резко возрастает скорость реакции превращения пирувата в лактат (рис. 2). Усиление анаэробно-гликолитического пути продукции АТФ позволяет частично компенсировать дефицит энергообразования в условиях недостаточного поступления О2, что, однако, сопряжено с неблагоприятными существенными «издержками» для клеточного гомеостаза. Накапливающаяся в клетке и не потребляемая (из-за сдвига обратимой реакции пируват–лактат в сторону образования последнего) молочная кислота обусловливает закисление внутриклеточной среды в виде избытка водородных ионов, что влечет за собой избыток в клетке ионов Na+бета-окисления, в то время как процессы окислительного фосфорилирования, требующие наибольшего количества О2, замедляются. Снижается потребление NADH и ацетилСоА, в результате чего их концентрация в митохондриях возрастает. Оба этих метаболита стимулируют специфическую протеинкиназу – ингибитор ПДГ, которая фосфорилирует и тем самым угнетает активность последней, в результате чего ограничивается скорость превращения пирувата в ацетилСоА [25, 29, 37]., а затем Са2+. Последнее сопряжено с нарушением сокращения и расслабления миофибрилл («ишемическая контрактура») и возрастанием электрической нестабильности (аритмогенной активности) кардиомиоцитов ишемизированной зоны. Для нормализации работы ионных насосов (являющихся АТФ-зависимыми) потребляется значительная часть АТФ, идущей на обеспечение работы сократительных белков, что увеличивает потребность в энергообразовании, которая заведомо не может быть удовлетворена в условиях несоответствия доставки О2 и его потребления. Кроме того, избыток Са2+ в цитозоле клетки, активируя фосфолипазы, выступает как один из триггерных факторов повреждения мембран КМЦ. Несмотря на интенсивное расщепление гликогена и увеличение захвата глюкозы клетками миокарда, наряду с увеличением анаэробного гликолиза наблюдается уменьшение окисления глюкозы. Это происходит потому, что в условиях умеренно выраженной ишемии, несмотря на уменьшение захвата СЖК миокардом, в митохондриях сохраняется относительно высокая скорость их
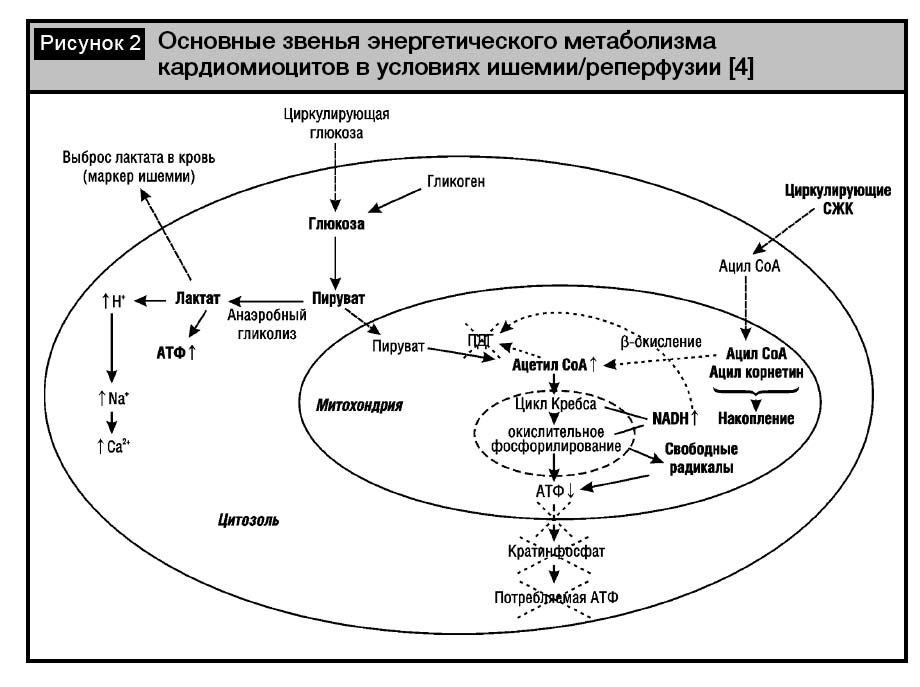
Таким образом, при умеренно выраженной ишемии миокарда (преходящие эпизоды которой, в целом, характеризуют пациентов со ССН) наблюдается своеобразный парадокс: несмотря на дисбаланс между потребностью в О2 и его доставкой, в кардиомиоцитах продолжает доминировать более кислородоемкий путь их энергообеспечения. К?вышеизложенному следует добавить, что при ишемии, в результате нарушения процессов окислительного фосфорилирования в виде «разобщения» дыхательной цепи переноса электронов в митохондриях, помимо снижения продукции АТФ, существенно возрастает образование количества свободнорадикальных форм О2. Последние, поступая в цитозоль, «запускают» процессы перекисного окисления липидов с соответственным повреждением мембран, нарушением работы ионных насосов и ферментных систем– включая угнетение митохондриальной креатининкиназы, обеспечивающей транспорт произведенной АТФ в цитозоль [3].
При дальнейшем усугублении ишемии блокируется бета-окисление ЖК, а затем (в фазе, предшествующей необратимому повреждению и некрозу клетки)– и анаэробный гликолиз, что означает исчерпание резервов энергообразования [1].
Механизм действия Предуктала?MR при ИБС
Предуктал MR избирательно ингибирует (путем влияния на фермент 3-кетоацил-коэнзимАтиолазу) последний этап 4-ступенчатой цепи реакций бета?окисления ЖК [25]. Вследствие этого возрастает «вклад» аэробного пути преобразования глюкозы в синтез АТФ. Поскольку окисление глюкозы требует меньше молекул О2, чем окисление СЖК, создаются предпосылки для возрастания энергетической устойчивости клетки к условиям ишемии [29]. Одновременно, вследствие активации под влиянием Предуктала MR биохимического превращения пирувата, предотвращается превращение последнего в лактат, в результате чего уменьшается концентрация ионов Н+²+ в цитозоле с последующим угнетением патогенных эффектов, свойственных ишемии и реперфузионному повреждению кардиомиоцитов. В?условиях экспериментального моделирования ишемии и реперфузионного повреждения Предуктал?MR уменьшал внутриклеточный ацидоз и накопление внутри клетки ионов Na+ и Са²+, удлинял период до появления контрактуры и улучшал сократительную функцию ишемизированного миокарда, сокращал период исчезновения и уменьшал выраженность постишемической дисфункции ЛЖ, способствовал улучшению окислительного фосфорилирования, сохранению внутриклеточного пула АТФ и креатинфосфата, ускоряя ресинтез последнего [16]. в клетке и пердотвращается избыточное накопление ионов Са
Наблюдающееся на фоне назначения Предуктала?MR улучшение процессов окислительного фосфорилирования влечет за собой уменьшение продукции митохондриями свободных радикалов. В?условиях ишемии и реперфузии Предуктал?MR ускоряет метаболизм (а?следовательно, стимулирует синтез) фосфолипидов [38], в результате возрастает потребление активированных длинноцепочечных форм ЖК (используемых в качестве субстрата для образования мембранных фосфолипидов), и поэтому накопления их в клетке не происходит [33].
Таким образом, Предуктал MR корригирует метаболические нарушения при ишемии, увеличивает выработку АТФ на 33%, поддерживая жизнеспособность кардиомиоцитов и их сократимость в условиях ишемии, уменьшает ацидоз клетки и перегрузку ее кальцием. Предуктал MR – единственный антиангинальный препарат, обеспечивающий защиту от ишемии на уровне кардиомиоцитов, независимо от факторов, вызывающих ишемию. Поэтому целесообразно включать Предуктал MR в схему лечения пациентов с ИБС как можно раньше и длительно.
Клиническая эффективность Предуктала MR была продемонстрирована в многоцентровых рандомизированных исследованиях, проведенных по правилам доказательной медицины. В международном двойном слепом рандомизированном плацебо-контролируемом исследовании Sellier P. было показано, что даже при минимальных плазменных концентрациях (в конце интервала дозирования) Предуктал МR обладает выраженным антиангинальным и антиишемическим эффектом. При проведении теста с физической нагрузкой Предуктал MR увеличивает время до развития депрессии сегмента ST +?47,9 с (p=0,005) и снижает количество приступов стенокардии на 50% [36].
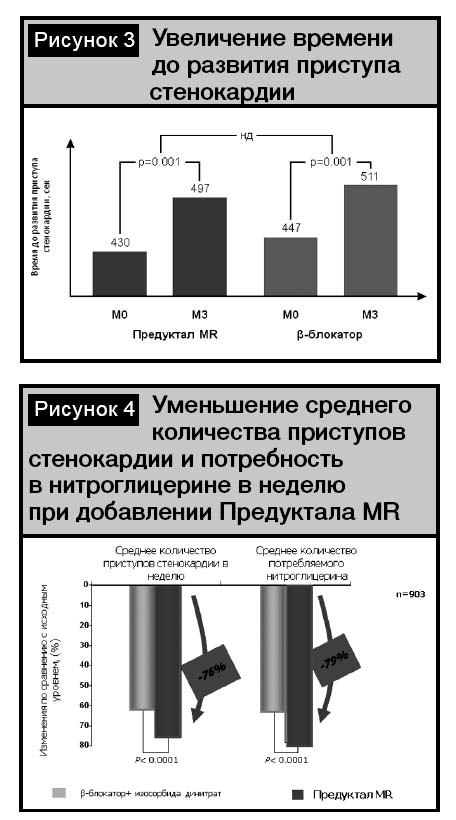
В сравнительном многоцентровом двойном слепом исследовании Detry J.M. было продемонстрировано, что препарат с метаболическим механизмом действия Предуктал?MR не уступает гемодинамическому препарату из группы бета-блокаторов по антиишемическому и антиангинальному эффекту (рис. 3) [14].
Эффективность комбинированного использования с другими препаратами. При ССН эффективность Предуктала MR в комбинации с гемодинамическими препаратами подтверждена в ряде открытых и плацебо-контролируемых исследований, в том числе когда лечение гемодинамическими антиангинальными препаратами (бета-адреноблокаторами) неэффективно (ПАРАЛЛЕЛЬ).
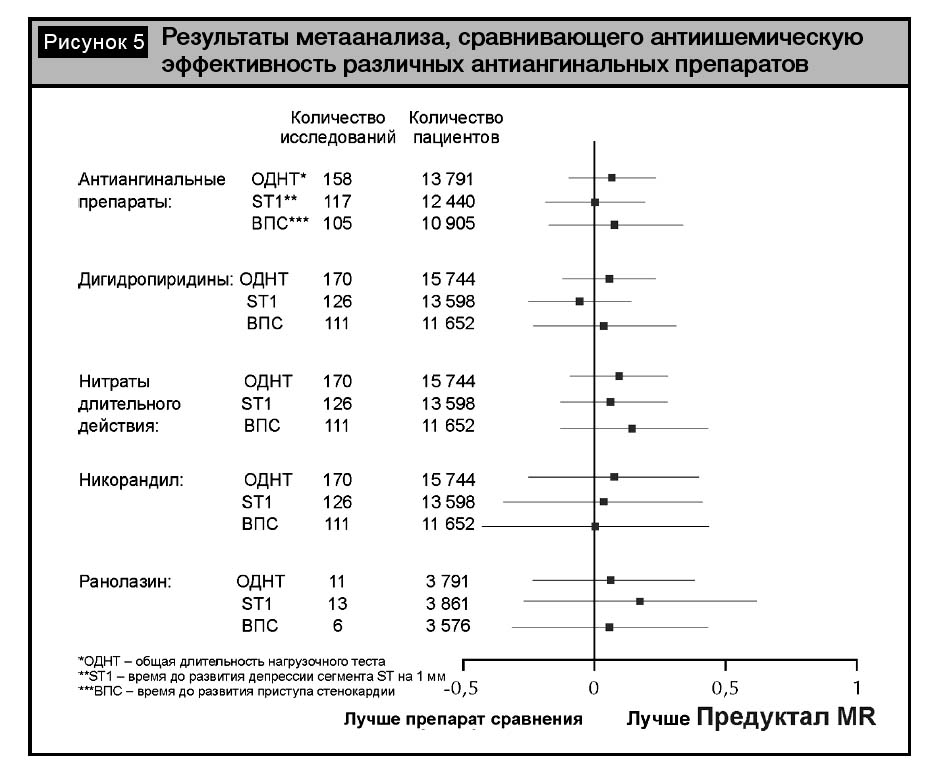
В исследование ПАРАЛЛЕЛЬ было включено 903 пациента со стабильной стенокардией. Сравнивалась выраженность антиангинального эффекта добавления к терапии бета-адреноблокаторами Предуктала MR или изосорбида динитрата (ISDN). Показано, что добавление метаболического цитопротектора Предуктала MR к бета-адреноблокатору достоверно более значимо увеличивало антиангинальный эффект, чем использование длительно действующего нитрата (p меньше 0,0001). Предуктал?MR уменьшал частоту ангинозных приступов в среднем на 76%, потребность в нитроглицерине – на 79%, увеличивая толерантность пациентов к физической нагрузке (рис. 4) [20]. Терапия Предукталом?МR привела к улучшению функционального класса стенокардии у вдвое большего числа пациентов, чем терапия ISDN. Благодаря метаболическому механизму действия Предуктал MR за счет комплементарности и синергичности обеспечивает высокий антиангинальный и антиишемический эффект при комбинации с гемодинамическими препаратами.
Для критической оценки результатов клинических исследований и выявления самых достоверных фактов создана специальная независимая международная организация исследователей – Кокрановская рабочая группа. Для оценки эффективности Предуктала MR Кокрановская рабочая группа провела метаанализ, объединяющий результаты всех клинических исследований, соответствующих самым строгим критериям качества: рандомизированные двойные слепые в сравнении с референтным препаратом (плацебо или другое активное лечение). Данный метаанализ включил в себя результаты 22 исследований, проведенных с применением Предуктала МR в промежутке между 1967 и 2008?гг. и включивших 2700 пациентов со стенокардией [11, 13]. Было продемонстрировано, что Предуктал МR значительно сокращает количество приступов стенокардии, повышает переносимость физической нагрузки и увеличивает время до депрессии сегмента ST на 1 мм, в сравнении с плацебо, на 34 секунды. Кроме того, анализ данных, касающихся переносимости препарата показал, что он не вызвал более неблагоприятных нежелательных явлений, чем в группе плацебо.
В новый метаанализ (Danchin N., 2011) были включены результаты 218 рандомизированных, слепых контролируемых исследований, оценивавших эффективность Предуктала MR по сравнению с другими антиангинальными препаратами (не пульс-урежающими) или с плацебо. В исследование было включено 19208 пациентов со стабильной стенокардией. В?метаанализе подтверждена высокая антиангинальная и антиишемическая эффективность Предуктала?MR: значительно повысилась общая длительность нагрузочного теста (+46?с), время до развития депрессии до 1 мм сегмента ST (+55 с), время до развития приступа (+54 с) (рис. 5). Выявлена тенденция к превосходящему эффекту Предуктала MR (+7 секунд – общая продолжительность нагрузочного теста, +8 секунд до времени развития приступа стенокардии) по сравнению с группой всех остальных антиангинальных препаратов [12].
Важно, что перевод пациентов со стенокардией с генериков триметазидина на оригинальный Предуктал MR, без изменения базовой терапии, значительно улучшает их клиническое состояние: количество приступов стенокардии уменьшается на 78%, количество принятых таблеток нитроглицерина – на 75% [22].
Эффективность действия препарата Предуктала MR у пациентов с ИБС и сахарным диабетом (СД) 2 типа
Крупное проспективное исследование DIETRIC с участием 580 пациентов с ИБС и СД 2 типа, показало, что Предуктал MR у этой категории пациентов снижает количество приступов стенокардии и существенно увеличивает переносимость физической нагрузки. На фоне лечения данным антиангинальным препаратом на протяжении 6 месяцев частота приступов стенокардии в неделю значительно снизилась: с 2,5 до 0,7 (р<0,001). Также значительно уменьшилось среднее потребление нитроглицерина: с 2,8 до 0,9 (р<0,001). Результаты теста с физической нагрузкой подтвердили значимую положительную динамику в отношении всех эргометрических параметров: например, общая продолжительность нагрузочного теста увеличилась на 50 с [34].
Эффективность Предуктала MR у пожилых пациентов
Многоцентровое обсервационное исследование TIGER продемонстрировало высокую антиангинальную эффективность и хорошую переносимость Предуктала?MR у пожилых пациентов в возрасте от 65 до 86 лет [27]. По истечении 12 недель лечения среднее количество приступов стенокардии в неделю уменьшилось с 5,5 до 2,2, среднее потребление нитратов короткого действия в неделю сократилось с 4,3 до 1,4 (р<0,001 для обоих параметров), продолжительность физической нагрузки значительно повысилась – до 52 с (р<0,001), время до депрессии сегмента ST на 1?мм увеличилось с 358 до 399 с (р<0,001).
Эффективность Предуктала MR в условиях острой ишемии
При необходимости проведения коронарного шунтирования Предуктал MR назначался за 3 недели перед хирургическим вмешательством. Концентрация тропонина Т и плазменный уровень креатинкиназы-МВ измерялись с целью оценки поражения миокарда до проведения операции и через 12, 24 и 48 часов после операции. Предуктал MR снизил концентрацию тропонина?Т и креатинкиназы-МВ после завершения операции и в каждый определенный момент времени. Результаты показали, что послеоперационная концентрация всех этих маркёров повреждения миокарда была значительно ниже в группе пациентов, принимавших Предуктал MR, по сравнению с контрольной группой (р<0,05) [19, 32]. При проведении коронарной ангиопластики внутрикоронарное введение Предуктала MR препятствует и заметно сокращает признаки ишемии на ЭКГ и снижает болевую симптоматику при стенокардии [10, 23, 28].
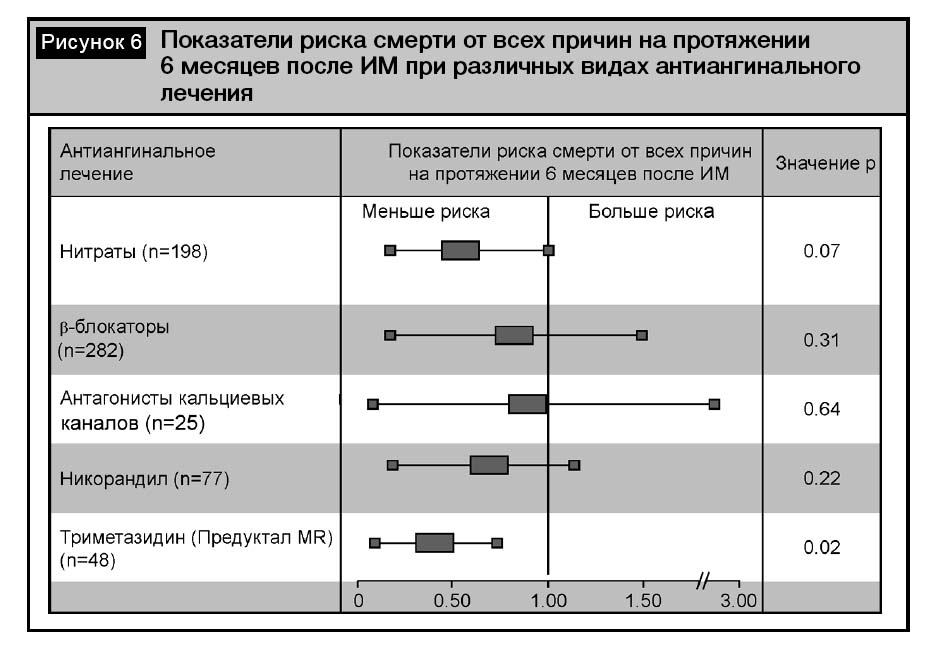
В исследовании METRO (ManagEment of angina: a reTRospective cOhort, 2009) изучалось влияние различных антиангинальных препаратов, принимаемых в среднем около 2 лет до развития ИМ на риск смерти от всех причин в течение 6 месяцев после ИМ. Установлено, что Предуктал?MR достоверно снижает этот риск на 64% (р=0,02), но не нитраты (р=0,07), антагонисты кальциевых каналов (р=0,64), никорандил (р=0,22) и бета-блокаторы (БАБ) (р=0,31). Данные представлены на рис. 6 [24].
Возможности использования Предуктала MR при гибернации миокарда и ХСН
Ошеломленный, или оглушенный, миокард – это такое состояние сердца, когда после короткого периода ишемии возникает его сократительная дисфункция, длящаяся от нескольких часов до нескольких дней, но поскольку КМЦ живы, в последующем наблюдается восстановление перфузии миокарда. Термином гибернирующий (спящий) миокард обозначается такое его состояние, когда он находится в состоянии гипоперфузии, поэтому стойко дисфункционален, но поскольку КМЦ живы, потенциальное восстановление сократимости сердца возможно, например с помощью операции реваскуляризации. Гибернирующий миокард существует за счет остаточного (резидуального) кровотока, которого недостаточно для обеспечения нормальной сократительной функции сердца.
Убедительные данные об эффективности Предуктала MR получены у пациентов с ХСН с выраженной систолической дисфункцией, особенно у лиц с гибернирующим миокардом [2]. Доказано, что начало благоприятного влияния Предуктала MR на сократительную функцию миокарда проявляется уже спустя 15 дней его приема, усиливаясь ко 2–3-му месяцу лечения. Предуктал MR не только улучшает функциональный класс (ФК) хронической сердечной недостаточности (ХСН), КЖ, переносимость физических нагрузок, фракцию выброса левого желудочка (ФВ ЛЖ) и снижает величину конечного систолического объема (КСО) в среднем на 10,4?мл (p<0,01), но, главное, – уменьшает общую смертность, риск сердечно-сосудистых осложнений и необходимость госпитализации по поводу ухудшения течения ХСН на 42–70% (р<0,00001) [19]. Эффект был наиболее выражен у тяжелых пациентов и у пациентов, принимающих Предуктал MR постоянно. Кроме того, субанализ подгруппы исследований, в которых Предуктал MR принимался длительно, показал, что улучшение функции сердца на фоне приема Предуктала MR связано со значительным снижением общей смертности, снижением риска развития сердечно-сосудистых катастроф и госпитализации по поводу ХСН (р<0,01 в сравнении с плацебо).
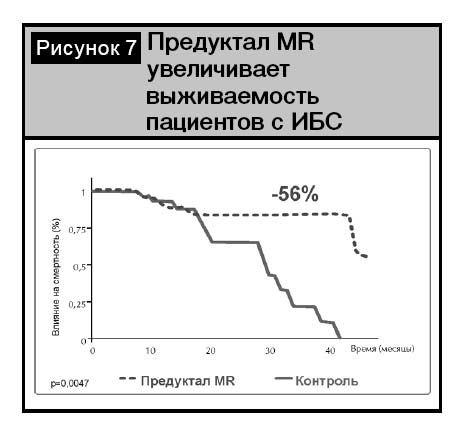
В исследовании Di Napoli изучалось влияние Предуктала MR на общую смертность и госпитализацию вследствие ХСН у пациентов с ишемической дисфункцией ЛЖ при назначении его в дополнение к стандартной терапии ИБС [15]. Результаты показали, что на фоне улучшения ФВ длительная терапия Предукталом MR приводит к уменьшению количества пациентов с III–IV ФК и к выраженному увеличению числа пациентов с II ФК ХСН. При этом через 1,5 года лечения в этой группе появились пациенты с I?ФК и исчезли – с IV ФК ХСН. 4-летняя терапия Предукталом?MR, добавленным к стандартной терапии, достоверно снижает количество госпитализаций на 47% и увеличивает выживаемость на 56% (рис. 7).
Назначение Предуктала MR показало, что он обладает выраженным антиишемическим и антиангинальным действием у широкого круга пациентов с ИБС на всем протяжении кардио-васкулярного континуума: молодых и пожилых, с болевой и безболевой ишемией миокарда, у лиц с сахарным диабетом, ишемической дилатационной кардиомиопатией.
Выводы:
1. Преимущество использования антиангинального препарата с метаболическим механизмом действия Предуктала MR заключается в улучшении энергетических возможностей кардиомиоцита в частности и миокарда в целом, вне зависимости от факторов, вызывающих ишемию: степени сужения коронарной артерии, исходного сердечного выброса и частоты сердечных сокращений, воспаления, эндотелиальной дисфункции. Поэтому Предуктал MR является необходимым компонентом терапии ИБС.
2. Выраженность антиангинального и антиишемического эффекта не уступает бета-блокаторам, нитратам, антагонистам кальция и даже превосходит некоторые из них в эффективности. Кроме того, Предуктал nMR при длительном лечении позволяет не только снизить частоту ангинозных приступов и количество потребляемого нитроглицерина, но и снизить частоту госпитализаций и увеличить выживаемость пациентов с ИБС, тем самым обеспечивая должный экономический эффект.
Л И Т Е Р А Т У Р А
1. Атрощенко Е.С., Мацкевич С.А. Возвратная стенокардия: пособие для врачей.– Минск, 2011.– 60 с.
2. Васюк Ю.А. [и др.]. // Терапевт. архив.– 2007.– №1.– С.25–28.
3. Воронков Л.Г. // Укр. кардіол. журн.–2007.– №2.– С.8–20.
4. Митьковская Н.П., Статкевич Т.В. // Мед. журн.– 2009.– №2.– С.8–12.
5. Мрочек А.Г., Дубень С.А., Ермолкевич Ф.Ф.?// Кардиология в Беларуси.– 2010.– №2(9).– С. 3–16.
6. Островский Ю.П. Хирургия сердца?/ Ю.П. Островский.– М.: Мед. лит, 2007.– 576 с.
7. Хомазюк А.И., Гончар И.В.?// Укр. кардіол. журн.– 2000.– №3.– С.88–95.
8. Barnes E. [et al.]?// J. Amer. Coll. Cardiol.– 2002.– Vol.39.– P.420–427.
9. Boden et al.?// N. Engl. J. Med.– 2007.– Vol.35.– P.1503–1516.
10. Bonello L., Sbragia P., Amabile N. et al.?// Heart.– 2007.– Vol.93.– P.703–707.
11. Ciapponi A., Pizzaro R., Harrison J. Trimetazidine for stable angina (Review). The Cochrane Collaboration.– John Wiley & Sons, Ltd., 2006.
12. Danchin N., Marzilli M., Parkhomenko O., Pinto Ribero // J. Cardiology.– 2011.– Vol.120.– P.59–72.
13. Danchin O., Marzilli M., Parkhomenko A., Ribeiro J. Trimetazidine in the treatment of stable angina pectoris: a meta-analysis of randomized, controlled clinical trials.– ICCAD, 2009.
14. Détry J.M., Sellier P., Pennaforte S. et al.?// Brit. J. Clin. Pharmacol.– 1994.– Vol.37.– P.279–288.
15. Di Napoli P., Di Giovanni P., Gaeta M. et al.?// J. Cardiovasc. Pharmacol.– 2007.– Vol.50.– P.585–589.
16. El-Banani H. [et al.] // Cardiovasc. Res.– 2000.– Vol.47.– P.696.
17. Fox K., Ford I., Steg P.G. et al. // Eur. Heart. J.– 2009.– Vol.30.– P.2337–2345.
18. Fox K. [et al.] // Eur. Heart J.– 2006.– Vol.27.– P.1341–1381.
19. Gao D. et al.?// Cardiology.– 2011.– Vol.97.– P.278–286.
20. Glezer M.G., Deev A.D. // Eur. Heart. J.– 2007.– Vol.28, abstr. suppl.– P.770.
21. Goldhaber G. Metabolism in normal and ischemic myocardium // Metabolism.– N.Y.: Acad. Press, 1997.– P.325–393.
22. Gupta R., Sawhney J.P., Narain V.S. et al.// Amer. J. Cardiovasc. Drugs. –2005.–Vol.5.– P.325–329.
23. Iskesen I., Kurdal A.T., Eserdag M. et al.// Heart Surg. Forum.– 2009.– Vol.E175–E179.
24. Iyengar S., Rosano G.M.C.// Am. J. Cardiovasc. Drugs.– 2009.– Vol.9.– P.293–297.
25. Kantor P.F., Lucien A., Kozak R. et al.// Circ. Res.– 2000.– Vol.86.– P.580–588.
26. King S.B. [et al.] // J. Am. Coll. Cardiol.– 2008.– Vol.51.– P.172–209.
27. Kölbel F., Bada V. // Int. J. Clin. Pract.– 2003.– Vol.57.– P.867–870.
28. Kober G., Buck T., Sievert H. et al. // Eur Heart J. – 1992.– Vol.13.– P.1109–1115.
29. Lopaschuk G.D. // Eur. Heart J.– 1999. – Vol.1, suppl.O.– P.32–39.
30. Maragiannis D. [et al.] // Hellenic. J. Cardiol.– 2011.– Vol.52, №3.– P.246–252.
31. Madsen J.K. [et al.] // Cardiology.– 2007. – Vol.108. – P.243–251.
32. Marazzi G., Wajngarten M., Vitale C. et al. // Int. J. Cardiol.– 2007.– Vol.120.– P.79–84
33. Nascimben L. [et al.] // Circulation.– 1996.– Vol. 94.– P.1894–1901.
34. Padial L.R., Bellido CM, Vélazquez-Martin M. et al.// Rev.Clin. Esp.?– 2005.– Vol.205.– P.57–62.
35. Rosano G., Vitale C., Fragasso G.// Amer. J. Cardiol.– 2006.– Vol.98 (Suppl.?J).– P.14– 18.
36. Sellier P., Broustet J.P. // Amer. J. Cardiovasc. Drugs.– 2003.– Vol.3.– P.361–369.
37. StanleyW.C., RecchiaF.A., LopaschukG.D. // Physiol. Rev.– 2005.– Vol.85.– P.1093–1129.
38. Tabbi Anneni I. [et al.] // Pharmacol. Exp. Therap.– 2003.– Vol.304.– P.1003–1009.
39. Trikalinos T.A. [et al.] // Lancet.– 2009.– Vol.373.– P.911–918.
40. Yabe T. [et al.] // Circulation.– 1995.– Vol.92.– P.15–23.
Медицинские новости. – 2012. – №6. – С. 39-65.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.