Likhachev S.A., Zabrodets G.V., Rovbut S.M., Golets U.N., Bunyak A.G., Reduto V.V., Franchuk K.A., Naumova G.I., Baginsky F.V., Kulesh S.D., Orlovskaya T.U., Tumilovich E.N., Getmanova A.O.
Republican Research Center of Neurology and Neurosurgery, Minsk; Brest Regional Hospital, Belarus; Vitebsk Regional Diagnostic Center, Belarus;
Gomel Regional Clinical Hospital, Belarus; Grodno State Medical University, Belarus; Grodno Regional Hospital, Belarus; Minsk Regional Clinical Hospital, Belarus; Mogilev Regional Clinical Hospital, Belarus
The experience of disseminated sclerosis treatment using recombinant human interferon beta-1a Rebif
Резюме. В 2010–2011 годах впервые в Республике Беларусь было проведено многоцентровое открытое проспективное клиническое исследование действия лекарственного средства «Ребиф». Целью данной работы являлось обобщение полученных результатов практического использования препарата «Ребиф» с оценкой эффективности и переносимости препарата, наличия побочных действий. Всего в исследование было включено 125 пациентов. Шестимесячный курс лечения препаратом окончил 121 пациент. Имеющиеся побочные проявления были ранзиторного характера и редко приводили к прекращению лечения. Всего за время проведения исследования было выявлено 3 случая обострения рассеянного склероза с увеличением балла EDSS от 1,5 до 2 баллов.
Ключевые слова: клиническое исследование, рассеянный склероз, Ребиф, обострение, EDSS.
Summary. In 2010–2011 for the first time in Belarus opened multicenter prospective clinical trial of Rebif was organized. An aim of this article is to summarize all received results and estimate efficacy and safety profile of Rebif. 125 patients are took participation on this trial. 121 patients finished full6-months course of treatment. Registered adverse reaction had transition character required discontinuation of treatment very rarely. During this trial 3 cases of exacerbation were registered with increasing of EDSS from 1,5 to 2.
Keywords: clinical trial, multiply sclerosis, Rebif, exacerbation, EDSS.
Рассеянный склероз (PC) – хроническое мультифакториальное демиелинизирующее заболевание ЦНС, возникающее под воздействием экзогенных факторов и реализуемое посредством комплекса иммунопатологических и патохимических реакций [3, 5, 13, 14]. Беларусь, как и другие европейские страны, а также Кипр, Израиль, США и Канада относятся к зоне повышенного риска PC с распространенностью заболевания свыше 30 случаев на 100 000 населения.
Средством выбора для купирования экзацербаций рассеянный склероз являются глюкокортикостероиды. При этом предпочтительно использование метилпреднизолона, поскольку именно с этим препаратом проведено наибольшее количество исследований, в которых доказана его эффективность и безопасность [9]. Лечение рассеянного склероза в межприступный период для предотвращения очередных обострений и наступления прогрессирующей фазы заболевания – сложная и дорогостоящая задача, которая решается с помощью иммуномодуляторов и иммуносупрессантов [15, 16]. Наибольшее распространение получили препараты бета-интерферонов (ИФН-бета) – ИФН-бетаlb (Бетаферон) и ИФН-bla (Авонекс, Ребиф). Применение препаратов данной группы, как и других препаратов, направленных на предупреждение обострений PC, в Беларуси ограничено в связи высокой стоимостью лечения. Поэтому опыт ряда лечебных учреждений здравоохранения в данной ситуации ограничивается единичными наблюдениями.
В 2010–2011 годах впервые в Республике Беларусь было проведено многоцентровое открытое проспективное клиническое исследование действия лекарственного средства «Ребиф» (человеческий рекомбинантный ИФН-бета1а) при рассеянном склерозе. Препарат был перераспределен по областным клиническим больницам. В Витебской области лечение пациентов с рассеянным склерозом осуществлялось и контролировалось Витебским областным диагностическим центром. В городе Минске лечение проводилось на базе РНПЦ неврологии и нейрохирургии.
Цель данной работы – обобщение полученных результатов практического использования препарата Ребиф с оценкой его эффективности и переносимости, наличия побочных действий.
Всего в исследование было включено 125 пациентов. Критерии включения в исследование:
• возраст от 18 до 55 лет;
• диагноз достоверного рассеянного склероза, установленный на основании критериев MacDonald et al. в модификации 2005 г.;
• степень инвалидизации по шкале EDSS х 5,5 во время осмотра при скрининге;
• пациенты с рецидивирующими формами РС (не менее одного рецидива в течение последних 12 месяцев или не менее двух рецидивов в течение последних 24 месяцев).
С учетом методологии исследования, а также инструкции по медицинскому применению препарата Ребиф критериями исключения являлись:
• рецидив в течение 30 суток перед выдачей препарата;
• клинически значимое сердечно-сосудистое, неврологическое, эндокринное заболевание или другое серьезное системное заболевание, которое приведет к затруднениям при соблюдении протокола или интерпретации результатов исследования или будет представлять дополнительный риск для пациента;
• пациенты с врожденным или приобретенным тяжелым иммунодефицитом, онкологическими заболеваниями, неадекватно пролеченным туберкулезом в анамнезе;
• гипопротеинемия (например, при тяжелых заболеваниях печени или нефротическом синдроме) с сывороточным альбумином менее 3,0 г/дл;
• нарушение функции почек, с показателями сывороточного креатинина более 133 мкмоль/л (более 1,5 мг/дл);
• пациенты со значительными нарушениями функции костного мозга или значимой анемией, лейкопенией или тромбоцитопенией (гематокрит менее 24% и/или количество лейкоцитов менее 4000 на mm3 (мкл) и/или количество тромбоцитов менее 150000 на mm3 (мкл) и/или количество нейтрофилов 1500 на mm3 (мкл) и менее);
• персистирующая значимая или тяжелая инфекция;
• нарушение функции печени или персистирующие повышения (подтвержденные повторным анализом) аланин-аминотрансферазы (АЛТ), аспартат-аминотрансферазы (ACT) или прямого билирубина с превышением верхней границы нормы более чем в 1,5 раза;
• известный гепатит, злоупотребление алкоголем или наркотическими препаратами в анамнезе;
• пациенты, применявшие адренокортикотропный гормон (АКТГ) или кортикостероиды для системного применения в течение последних 2 недель;
• беременные или кормящие женщины;
• пациенты, желающие завести детей (быть партнером при зачатии ребенка) в течение периода лечения;
• хронические заболевания поджелудочной железы или панкреатит в анамнезе;
• повышенная чувствительность к природному или рекомбинантному ИФН-бета, сывороточному альбумину человека или к другим компонентам препарата;
• тяжелые депрессивные нарушения и\или суицидальные идеи;
• эпилепсия в случае отсутствия эффекта от применения соответствующей терапии.
При соответствии критериям включения и при отсутствии критериев исключения пациент инструктировался по технике инъекций и действиях при образовании подкожных инфильтратов.
Применялся Ребиф в форме предварительно наполненных шприцев для подкожного введения, содержащих 44 мкг/0,5 мл человеческого рекомбинантного ИФН-бета1а. Первичная инъекция проводилась в условиях процедурного кабинета учреждения здравоохранения. В соответствии с инструкцией по применению, рекомендовалось применять препарат в одно и то же время, желательно вечером, в определенные дни недели с интервалом не менее 48 часов (например, в 20.00 по понедельникам, средам и пятницам). Первые две недели препарат вводился по 0,1 мл (по делению на шприце). Оставшийся в шприце препарат использованию не подлежит. На третьей и четвертой неделях препарат вводится по 0,25 мл шприца (по делению на шприце). На втором, третьем и шестом месяцах лечения проводилась клинико-лабораторная оценка состояния пациента. Определялся балл EDSS. Анализировались показатели общего анализа крови с подсчетом тромбоцитов, биохимический анализ крови (содержание мочевины, креатинина, белка, билирубина, АЛТ, ACT, диастазы, глюкозы), общий анализ мочи. С пятой недели при отсутствии отклонений от нормы доза повышалась до 0,5 мл (весь шприц 44 мкг). Режим введения препарата оставался прежним. При клинически значимых побочных действиях допускалось временное снижение дозы Ребифа до 0,25–0,1 мл или препарат отменялся по решению лечащего врача. По окончании клинического исследования анализировались побочное действие препарата и комплаентность (приверженность лечению), оценивалась эффективность лекарственного средства на основе динамики балла шкалы EDSS и частоты рецидивов PC в течение периода применения Ребифа.
Статистическая обработка полученных данных выполнялась с помощью пакета прикладных программ STATISTICA 6.0. При анализе данных использовались непараметрические статистические методы. Количественные и порядковые данные представлены в виде медианы и 25–75-го процентилей (25; 75). При определении динамики балла EDSS в течение периода лечения использовался критерий Уилкоксона. Статистическая значимость различий определялась при уровне статистической значимости менее 0,05 [2, 6].
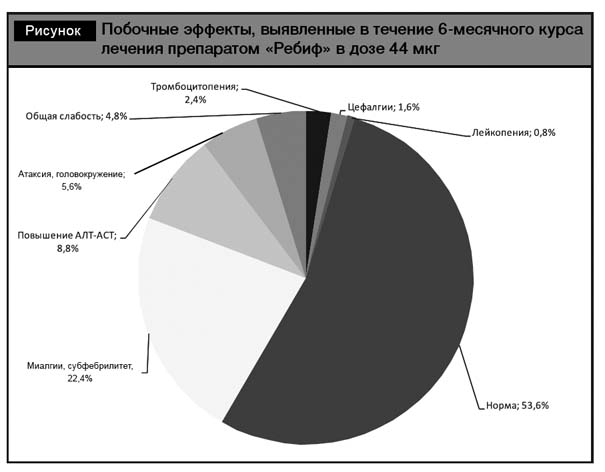
Среди 125 пациентов, начавших терапию Ребифом, было 85 (68%) женщин и 40 (32%) мужчин. Возраст – 36 (28; 45) лет. Давность PC на момент начала лечения составила 7 (5; 11) лет. Побочных действий Ребифа при опросе и осмотре пациентов, анализе лабораторных показателей не выявлено в 67 (53,6%) случаях. Ни у одного пациента не возникало проблем с обучением и выполнением инъекций. Побочные проявления (рисунок) были транзиторного характера и редко требовали прекращения лечения. Чаще отмечались миалгии и субфебрильная температура в первые часы после инъекции препарата. Только в 1 из 11 случаев повышения печеночных трансаминаз доза Ребифа была уменьшена до 0,1 мл в связи с пятикратным превышением верхней границы лабораторной нормы. Однако в течение 2 месяцев доза препарата была восстановлена при нормализации сывороточного уровня АЛТ-АСТ. В целом переносимость ребифа была удовлетворительной. Шестимесячный курс лечения окончил 121 пациент. В 4 (3,2%) случаях лечение было прервано по желанию пациентов в связи с побочными эффектами препарата после инъекции: 2 случая транзиторного повышения температуры тела до фебрильных цифр и миалигии, 2 случая транзиторной общей слабости. Таким образом, комплаентность была высокой – 96,8%.
Балл EDSS (медиана, 25-й и 75-й процентили) при включении в исследование и после 6 месяцев лечения без динамики: 3,5 (2,5; 4). В 5 наблюдениях отмечалось колебание балла EDSS до +/–0,5. До включения в исследование большинство пациентов с РС имели 1–2 обострения за последние 2 года. Свыше 3 обострений за предшествующий год отмечалось у 5 пациентов. При этом за шестимесячный период терапии Ребифом только у 1 из 5 пациентов развился рецидив рассеянного склероза. Всего за время проведения исследования было 3 случая обострения РС с увеличением EDSS от 1,5 до 2 баллов. В конечном итоге статистически значимых различий балла EDSS до и после 6 месяцев лечения Ребифом не выявлено (р=0,68).
Рассеянный склероз – одно из наиболее распространенных неврологических заболеваний. Так, в Республике Беларусь заболеваемость рассеянным склерозом превышает 50 человек на 100 тыс. населения [20]. Эти статистические данные не учитывают больных с РС, которым выставлены диагнозы рассеянный энцефаломиелит, хроническое демиелинизирующее заболевание по типу РС и т.д. Рассеянный склероз поражает преимущественно лиц трудоспособного возраста, повышая показатели временной нетрудо-способности и инвалидности среди лиц трудоспособного возраста. Лечение и контроль эффективности лечения рассеянного склероза – острая и одна из наименее решенных проблем. Существующие методы лечения обострений (глюкокортикостероидные препараты, цитостатики, плазмаферез) не всегда приносят ожидаемый результат: зачастую после экзацербации у пациента сохраняется остаточный неврологический дефицит [9]. Поэтому важно шире использовать лекарственные средства, направленные на предупреждение прогрессирования заболевания.
В соответствии с протоколом, разработанным международной экспертной группой, терапию рецидивно-ремиттирующего РС следует начинать с препаратов ИФН-бета (в высоких или низких дозах) или глатирамера ацетата. В случае неэффективности низких доз ИФН-бета переходят на высокие. При неэффективности выбранного препарата его меняют (ИФН-бета на глатирамера ацетат и наоборот). При дальнейшем отсутствии желаемого результата назначают митоксантрон [8].
Под действием ИФН снижается экспрессия молекул HLA II класса на мембране антигенпрезентирующих клеток, подавляется синтез ИФН-гамма Т-лимфоцитами, нормализуется продукция макрофагами медиаторов воспаления. Кроме того, ИФН-бета подавляют пролиферацию Т-лимфоцитов и восстанавливают их супрессорную активность [5].
Препараты ИФН-бета показаны на самых ранних сроках заболевания, поскольку у больных с рецидивно-ремиттирующим РС они снижают количество обострений заболевания и количество очагов демиелинизации по данным МРТ. В случае отсроченного назначения препаратов ИФН-бета быстрее накапливается неврологическая симптоматика [4, 17].
Антигенспецифическая патогенетическая терапия с помощью глатирамера ацетата (копаксон). Глатирамера ацетат представляет собой полипептид, который входит в состав основного белка миелина. Механизм действия данного препарата реализуется двумя путями: за счет активного конкурентного связывания с антигенами HLA и индукцией антиген-специфических супрессорных Т-лимфоцитов. Назначается в дозе 20 мг ежедневно, подкожно, длительно [7, 12, 18].
Проведено сравнительное исследование результатов лечения препаратами ИФН-бета и глатирамера ацетатом. Показано, что они практически одинаково эффективны в лечении рецидивно-ремиттирующей формы РС и снижают количество обострений примерно на 30% [10].
Помимо указанных выше иммуномодуляторов, при лечении рецидивно-ремиттирующего РС используется и внутривенный иммуноглобулин. Механизм его действия заключается в ингибировании системы комплемента и синтеза аутоантител В-лимфоцитами, блокировании выделения макрофагами провоспалительных цитокинов. Внутривенный иммуноглобулин следует использовать как средство второй линии, в случае неэффективности средств выбора. Рекомендуемая суммарная ежемесячная доза составляет 0,2 г/кг. Такие курсы проводятся ежемесячно, длительно [8].
В тяжелых, трудно курабельных случаях возможно использование цитостатиков. Наиболее достоверно доказана эффективность митоксантрона. Препарат назначается лицам с быстропрогрессирующим РС (два и более обострения с плохим восстановлением утраченных функций (или ухудшение на 2 и более балла по шкале EDSS в течение года) и наличием на МРТ новых контрастируемых гадолинием очагов) и лицам с недостаточным эффектом от лечения иммуномодуляторами. Мито-ксантрон очень токсичный, его побочные эффекты дозозависимые и кумулятивные. Суммарная доза не должна превышать 140 мг/м2, обычно назначается 20 мг в месяц в течение 6 месяцев в сочетании с метилпреднизолоном (1 г в месяц). Наиболее частые побочные эффекты: кардиотоксичность, лейкопения, аменорея, диспепсические явления [8, 19].
В индивидуальных случаях возможно применение аутологичной трансплантации гемопоэтических стволовых клеток. Это весьма агрессивный вид лечения, сопряженный с высоким риском тяжелых осложнений и вероятностью летального исхода. Кроме того, невзирая на подавление иммуновоспалительного процесса в результате трансплантации гемопоэтических стволовых клеток, отмечено дальнейшее прогрессирование атрофического процесса в головном мозге [10, 11].
Таким образом, использование в нашем случае препарата ИФН-бета1a Ребиф было обоснованным и соответствовало международным протоколам лечения рецидивно-ремиттирующего РС.
Ребиф представляет собой природную аминокислотную последовательность ИФН-бета1a человека, полученную методами генной инженерии с использованием культуры клеток яичника китайского хомячка. При проведении международных клинических исследований Ребиф в рекомендуемой дозировке продемонстрировал снижение частоты (30% в течение 2 лет) и тяжести обострений у пациентов с двумя и более обострениями в течение последних 2 лет и с EDSS 0–5 перед началом лечения. Доля пациентов с подтвержденным прогрессированием инвалидизации уменьшилась с 39% (плацебо) до 30% (Ребиф 22 мкг). Через 4 года число обострений снизилось в среднем на 22 и 29% у пациентов, получавших Ребиф 22 мкг и 44 мкг соответственно по сравнению с группой пациентов, получавших в течение 2 лет плацебо, а затем Ребиф 22 мкг и 44 мкг. При рецидиве РС проведение курса пульс-терапии солумедролом не требует прерывания приема Ребифа. В 3-летнем исследовании пациентов с вторично-прогрессирующим рассеянным склерозом (EDSS 3–6,5) с достоверным прогрессированием инвалидизации в течение предшествующих 2 лет и отсутствием обострений в течение предшествующих 8 лет Ребиф не оказывал существенного влияния на инвалидизацию.
При подкожном или внутримышечном введении уровни ИФН-бета1a в сыворотке крови определяются в течение 12–24 ч после инъекции. Способ введения Ребифа (п/к или в/м) не влияет на уровень ИФН-бета1a в сыворотке крови. После однократной инъекции дозы 60 мкг максимальная концентрация, определяемая иммунологическими методами, составляет 6–10 МЕ/мл через 3 ч после введения. При 4-кратном подкожном введении одной и той же дозы каждые 48 ч происходит умеренное аккумулирование препарата. ИФН-бета1a метаболизируется и выводится печенью и почками. Для удобства дозирования на шприц с препаратом нанесены соответствующие деления. Оставшееся в шприце лекарство не подлежит дальнейшему использованию. Решение о длительности лечения принимается индивидуально лечащим врачом.
Гриппоподобные симптомы с головной болью, лихорадкой, ознобом, мышечными и суставными болями, тошнотой отмечаются наиболее часто (до 40% случаев) в течение первых 6 месяцев терапии Ребифом. Эти проявления обычно умеренно выражены, наблюдаются, как правило, в начале лечения и уменьшаются при продолжении лечения. Прием нестероидных противовоспалительных препаратов или временное снижение дозы способствует уменьшению или регрессу данных побочных явлений. В нашем случае эти симптомы наблюдались в 22,4% случаев. Реакции в месте инъекции в виде по-краснения, припухлости и болезненности обычно выражены незначительно, носят обратимый характер, хорошо переносятся пациентами, в чем мы убедились при опросе и осмотре пациентов. Случаев некроза в месте инъекций мы не наблюдали. Реже применение ИФН-бета1a может вызвать диарею, потерю аппетита, рвоту, нарушение сна, головокружение, нервозность, сыпь, расширение кровеносных сосудов и сердцебиение, изменение менструального цикла. Возможны отклонения от нормы лабораторных показателей, проявляющиеся лейкопенией, лимфопенией, тромбоцитопенней. повышением уровня АЛТ-АСТ. Эти изменения обычно незначительные, бессимптомные и обратимые.
Интерфероны могут оказывать разнонаправленное влияние на функцию щитовидной железы, провоцировать развитие депрессии у больных рассеянный склерозом, что требует более тщательного отбора пациентов для лечения с последующим динамическим наблюдением.
Поскольку в организме людей и животных ИНФ снижают активность цитохром Р-450-зависимых ферментов печени, следует соблюдать осторожность при назначении ИНФ одновременно с лекарственными средствами, клиренс которых в значительной степени зависит от цитохромной Р-450 системы печени (противоэпилептические средства, антидепрессанты).
В клинических испытаниях продемонстрировано повышение активности печеночных трансаминаз, особенно АЛТ. Этим обусловлена необходимость биохимического исследования крови до начала терапии Ребифом с последующим контролем через 1,3 и 6 месяцев и далее периодически при продолжении лечения. Если уровень АЛТ превысит верхнюю границу нормы в 5 раз, необходимо снизить дозу препарата, а после нормализации анализов постепенно увеличивать ее. Терапию следует прекратить при появлении желтухи или других клинических признаков нарушения функции печени. Дополнительно с той же периодичностью рекомендуется определять полную и лейкоцитарную формулу крови, содержание тромбоцитов.
На период терапии ИФН-бета1a женщины детородного возраста должны пользоваться эффективными средствами контрацепции ввиду потенциальной опасности для плода. Пациентки, планирующие беременность или забеременевшие на фоне лечения, должны обязательно сообщить об этом своему лечащему врачу для решения вопроса о продолжении или отмене терапии. Учитывая вероятность развития серьезных побочных реакций у новорожденных, следует также сделать выбор между отменой ребифа и прекращением грудного вскармливания.
Таким образом, полученный клинический опыт использования препарата ИФН-бета1a Ребиф подтверждает его хорошую переносимость и низкую частоту побочных явлений, приводящих к прекращению терапии. Несмотря на относительно непродолжительный период лечения, у ряда пациентов отмечено снижение частоты рецидивов РС. Полученные данные, а также накопленный международный опыт лечения пациентов с рассеянным склерозом позволяют применять ИФН-бета1a Ребиф как препарат первой линии для пациентов с рецидивно-ремиттирующим РС.
Л И Т Е Р А Т У Р А
1. Аутологичная трансплантация кроветворных стволовых клеток при рассеянном склерозе: результаты исследования российской кооперативной группы клеточной терапии / Ю.Л. Шевченко [и др.] // Невролог. журн. – 2008. – № 2. –С. 11–18.
2. Гланц, С. Медико-биологическая статистика / С. Гланц. – М.: Практика, 1999. – 459 с.
3. Завалишин, И.А. Рассеянный склероз. Избранные вопросы теории и практики / И.А. Завалишин, В.И. Головкин. – М., 2000. – 640 с.
4. Завалишин, И.А. Рассеянный склероз: современная концепция патогенеза и патогенетического лечения / И.А. Завалишин. А.В. Переседова // Анналы клинической и экспериментальной неврологии. – 2007. – № 1. – С. 32–40.
5. Завалишин, И.А. Рассеянный склероз: современные аспекты этиологии и патогенеза / И.А. Завалишин // Журн. неврологии и психиатрии им. С.С. Корсакова. –2003.–№ 2.–С. 10–17.
6. Реброва, О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA / О.Ю. Реброва. – М.: Медиа- Сфера, 2003. –312 с.
7. Шмидт, Т.Е. Рассеянный склероз / Т.Е. Шмидт, Н.Н. Яхно. – М.: Медицина, 2003. – 160 с.
8. A recommended treatment algorithm in relapsing multiple sclerosis: report of an international consensus meeting / D. Karussis[et al.] // Eur. J. Neurol. – 2006. –Vol. 13.–P. 61–71.
9. EFNS guideline on treatment of multiple sclerosis relapses: report of an EFNS task force on treatment of multiple sclerosis relapses / F. Sellebjerg [et al.] // Eur. J. Neurol. – 2005. – Vol. 12. – P. 939–946.
10. Functional correlates of callosal atrophy in relapsing-remitting multiple sclerosis patients. A preliminary MRI study / F. Barkhof [et al.] // J. Neurol. – 1998. – Vol. 245. – P. 153–158.
11. Hematopoetic stem cell transplantation for multiple sclerosis / R.K.Burt [et al.] // Arch. Neurol. – 2005. – Vol. 62. – P. 860–864.
12. Jones, S.J. Neurophysiologycal evidence for long–term repair of MS lesions: implications for axon protection / S.J. Jones, A. Brusa // J. Neurol. Sciences. – 2003. – Vol. 206. –P. 193–198.
13. Multiple sclerosis – the plaque and its pathogenesis / E.M.Frohman [et al.] // N. Engl. J. Med. – 2006. – Vol.354. – P. 942–955.
14. Multiple sclerosis / J.H.Noseworthy [et al.] // N. Engl. J. Med. – 2000. – Vol. 343. – P. 938–952.
15. Poser, C.M. Epilepsy and multiple sclerosis / CM.Poser, V.V.Brinar // Epilepsy & Behavior. – 2003. – Vol. 4. – P. 6–12.
16. Primary progressive multiple sclerosis: clinical and paraclinical characteristics with application of the new diagnostic criteria / I.Dujmovic [et al.] // Eur. J. Neurol. – 2004. – Vol. 11. – P. 439–144.
17. Quantitative pathological evidence for axonal loss in normal-appearing white matter in multiple sclerosis / N. Evangelou [et al.] // Ann. Neurol. – 1997. – Vol. 47. – P. 391–395.
18. Ramsaransing, G.S.M. Benign course in multiple sclerosis: a review / G.S.M. Ramsaransing, J. De Keyser // Acta Neurol. Scand. – 2006. – Vol. 113. – P. 359–369.
19. Regulation of gene expression in experimental autoimmune encephalomyelitis indicates early neuronal dysfunction / A.Nicot [et al.] // Brain. – 2003. – Vol. 126. – P. 398–412.
20. The epidemiology of multiple sclerosis in Europe / M. Pugliatti [et al.] // Eur. J. Neurol. – 2006. – Vol. 13. – P. 700–722.
Медицинские новости. – 2012. – №1. – С. 49-53.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.