Fromilid – improving the therapy of acute respiratory infections in children in the outpatient setting
Zhernosek V.F
Острые инфекционные заболевания верхних дыхательных путей являются самыми распространенными в педиатрии. Приблизительно в 10–20% случаев острые респираторные вирусные инфекции (ОРВИ) осложняются острыми средними отитами и острыми синуситами, несколько реже – острыми ларингитами. Кроме того, как самостоятельное заболевание при определенных условиях возникает бактериальная ангина (острый тонзиллит) [2, 5].
Лечение антибиотиками при ОРВИ необходимо начинать только при наличии явных бактериальных очагов: гноетечении из уха, гноетечении из глаз, паратонзиллярном абсцессе, флюктуации лимфоузла, отеке лица (орбиты, шеи), физикальных признаках пневмонии. Первичную бактериальную этиологию могут иметь тонзиллиты/тонзиллофарингиты. Бактериальную этиологию имеют назофарингиты микоплазменной и хламидийной этиологии, синуситы, пневмонии, отдельные случаи бронхита, редко встречающиеся эпиглоттиты.
Системная антибиотикотерапия детям и подросткам с синдромом острого респираторного заболевания показанапри наличии: 1) гнойных осложнений (гнойный синусит, гнойный лимфаденит, паратонзиллярный абсцесс, нисходящий ларинготрахеит); 2) стрептококкового (группы А) тонзиллита; 3) анаэробной ангины; 4) острого среднего отита; 5) бактериального синусита; 6) респираторного микоплазмоза и хламидиоза (бронхит, атипичная пневмония); 7) бактериальной пневмонии.
Помимо явных бактериальных очагов инфекции антибактериальная терапия может быть начата при выявлении симптомов, подозрительных на их наличие, до уточнения диагноза. После уточнения диагноза показания для дальнейшей антибактериальной терапии пересматриваются.
Для целенаправленного выбора стартовой терапии, очень важно правильно дифференцировать респираторные инфекции, вызванные типичными и атипичными возбудителями. О микоплазменной этиологии респираторной инфекции можно думать при указании на эпидемический подъем заболеваемости среди школьников и лиц молодого возраста и с учетом особенностей клинической картины заболевания. Респираторный микоплаз-моз у детей наиболее часто протекает по типу острого фарингита, значительно реже встречаются ринит, синусит, средний отит, мирингит, бронхит и пневмония. При этом микоплазменные поражения верхних дыхательных путей имеют мало специфических черт. Микоплазменная инфекция начинается остро с подъема температуры тела до фебрильного уровня и недомогания, в ряде случаев отмечаются головная боль и другие симптомы интоксикации. Возникают першение и боли в горле, заложенность носа, реже наблюдается насморк, боли в ушах и проявления конъюнктивита. Лихорадка в подавляющем большинстве случаев купируется в течение 3–5 дней, но субфебрилитет может сохраняться еще на протяжении 1–2 недель. Катаральные симптомы купируются в течение 7–10 дней. Начало микоплазменной пневмонии очень напоминает картину микоплазменной инфекции верхних дыхательных путей. О пневмонии в этих случаях можно думать при затяжной фебрильной лихорадке, симптомы интоксикации обычно минимальны, дыхательная недостаточность также выражена слабо. Через несколько дней от дебюта заболевания появляется сухой, навязчивый кашель, нередко приступообразный. Очаговая симптоматика не характерна, в легких можно выслушать рассеянные сухие и разнокалиберные влажные хрипы. Кашель постепенно становится продуктивным, интенсивность его снижается, полное разрешение наступает к концу 2–3 недели заболевания. У некоторых больных кашель может сохраняться в течение длительного времени (иногда до нескольких месяцев) [9].
В пользу хламидийной этиологии респираторной инфекции свидетельствуют следующие клинико-анамнестические данные: наличие в окружении ребенка «длительно кашляющих» лиц, подострое начало заболевания, длительный субфебрилитет, постепенно нарастающий и длительно сохраняющийся кашель нередко спастического характера, затяжное течение заболевания. О респираторном хламидиозе можно также думать при рецидивирующем бронхообструктивном синдроме, особенно при отсутствии у ребенка наследственной отягощенности по атопии, неэффективности бронхолитической терапия. У ряда детей с респираторной инфекцией, вызванной С. pneumoniae, может иметь место сопутствующая лимфаденопатия [7, 30]. Заподозрить атипичную этиологию респираторной инфекции можно также при отсутствии клинического эффекта от бета-лактамных антибиотиков.
Антибиотики из группы макролидов более полувека широко используются в клинической практике. Они зарекомендовали себя как высокоэффективные и одни из наиболее безопасных антибиотиков, имеют минимальное число противопоказаний к назначению. Подробную характеристику макролидов представил А.И. Синопальников и И.А. Гучев [13].
Основу химической структуры макролидов составляет макроциклическое лактонное кольцо с 1, 2 или 3 боковыми углеводородными цепями. В зависимости от числа атомов углерода, составляющих кольцо, все макролиды подразделяются на 14-, 15- и 16-членные, по происхождению – на природные, полусинтетические и пролекарства.
В основе антимикробного действия макролидов лежит их обратимое связывание с различными доменами каталитического пептидилтрансферазного центра 50S-субъединицы рибосом, что приводит к нарушению процессов транслокации/транспептидации и преждевременному отщеплению соединения растущей транспортной РНК – полипептидная цепочка. Благодаря этому прекращается сборка белковой молекулы.
Макролиды являются классическими бактериостатическими препаратами. В зависимости от вида микроорганизма, концентрации антибиотика они могут оказывать бактерицидное действие препаратов. Бактерицидный эффект отмечен в отношении Str. pyogenes, Str. pneumoniae, N. meniingitidis, возбудителей коклюша, дифтерии.
Макролиды обладают также и неантибактериальной активностью, прежде всего – противовоспалительным эффектом. Противовоспалительная активность и эффективность против Chl. pneumoniae и M. pneumoniae послужили основанием для изучения эффективности препаратов при бронхиальной астме.
Макролиды имеют примерно одинаковый спектр активности in vitro, включающий грамположительных, ряд грамотрицательных, а также внутриклеточных возбудителей. Существуют и различия, клиническое значение которых не всегда очевидно. Так, например, против метициллиночувствительных штаммов S. aureus наилучший эффект демонстрирует кларитромицин. Кларитромицин in vitro активнее, чем другие макролиды, против Chl. pneumoniae, L. pneumophila, H. pilory и атипичных микобактерий.
Макролиды обладают постантибиотическим действием, которое заключается в подавлении жизнедеятельности микроорганизмов уже после прекращения контакта возбудителей с антибиотиком. Постантибиотический эффект объясняют возникновением необратимых изменений в бактериальных рибосомах микробных клеток, в результате чего даже после отмены макролидов в чувствительных к ним микроорганизмах нарушается синтез протеинов. Это и является причиной замедления роста и размножения возбудителей в постантибиотический период.
Для макролидов характерно быстрое всасывание из желудочно-кишечного тракта. Пища оказывает разнонаправленное влияние на биодоступность макролидов. Прием пищи не влияет на всасывание кларитромицина, джозамицина и мидекамицина ацетата, в то же время незначительно понижает биодоступность мидекамицина, азитромицина и значительно – эритромицина и спирамицина.
В отличие от многих антибактериальных препаратов макролиды хорошо проникают внутрь клеток организма человека, где создают высокие концентрации. Это имеет исключительное значение для лечения инфекционных заболеваний, вызываемых внутриклеточными возбудителями (Mycoplasma spp., Chlamydia spp., Legionella spp., Campylobacter spp.). Содержание макролидов в моноцитах, макрофагах, фибробластах и полиморфноядерных лейкоцитах в десятки раз превышает их сывороточную концентрацию.
Важная особенность макролидов – их способность накапливаться в фагоцитах с последующим выделением в очаге инфекции под воздействием бактериальных стимулов и обратный активный захват «неутилизированного» микроорганизмами препарата. Максимальное накопление макролидов наблюдается в легочной ткани, жидкости, выстилающей слизистую бронхов и альвеолы, бронхиальном секрете, слюне, миндалинах, среднем ухе, синусах, слизистой желудочно-кишечного тракта, предстательной железе, конъюнктиве и тканях глаза, коже, желчи, уретре, матке, придатках и плаценте.
Метаболизм макролидов осуществляется в печени ферментами системы цитохрома Р450. По степени сродства к ферментам все макролиды различаются.
Макролиды выводятся из организма главным образом с желчью, подвергаясь кишечно-печеночной рециркуляции. Некоторые метаболиты макролидов обладают самостоятельной антимикробной активностью. Так, например, один из метаболитов кларитромицина – 14-гидроксикларитромицин – характеризуется большей антигемофильной активностью и периодом полувыведения, чем сам кларитромицин.
Антимикробный эффект кларитромицина и азитромицина в отношении H. influenzae зависит от создаваемой в очаге инфекции концентрации. То же правило применимо для названных препаратов и в отношении Str. pneumoniae.
Показания к применению макролидов определяются спектром их активности, фармакокинетическими особенностями, переносимостью и в определенных случаях противовоспалительным действием. Внутриклеточное накопление позволяет использовать их при инфекциях, вызванных внутриклеточными возбудителями. Высокие концентрации в очаге воспаления делают их альтернативным средством выбора при лечении инфекций верхних и нижних дыхательных путей, органов малого таза, кожи и мягких тканей, H. pylori-ассоциированной патологии.
Макролиды являются препаратами резерва при лечении неосложненных кокковых инфекций кожи и мягких тканей, острых синуситов, острого среднего отита (бактериологическая неэффективность при отитах, вызванных H. influenzae, достигает 53–71%) и стрептококкового тонзиллофарингита. В последнем случае они имеют схожую с амоксициллином эффективность.
Комбинация макролидов с другими антибиотиками может обеспечить синергидное или аддитивное действие. Комбинация бета-лактамов с высокими дозами макролидов возможна при эмпирической терапии тяжелых внебольничных пневмоний и предназначена для «перекрытия» атипичных возбудителей, в отношении которых неэффективны бета-лактамы. Комбинированное применение макролидов возможно с фторхинолонами, аминогликозидами, рифампицином.
Макролиды характеризуются хорошей переносимостью. Наиболее характерные нежелательные реакции наблюдаются со стороны желудочно-кишечного тракта. Крайне редко наблюдаются и перекрестные аллергические реакции ко всем макролидам.
С 1950-х гг. и до настоящего времени макролиды применяются с высокой эффективностью, особенно при патологии верхних дыхательных путей. По частоте применения макролиды занимают третье место среди всех классов антибиотиков, а в терапии тонзиллитов конкурируют с пенициллинами [8]. По мнению Т.И. Гаращенко и М.Р. Богомильского [4], это связано с рядом причин:
1. Высокая степень накопления макролидов в лимфоидной ткани.
2. Эффективность (до 90%) у больных с тонзиллофарингитом.
3. Увеличение частоты выделения из миндалин (особенно при рецидивирующем тонзиллофарингите) микроорганизмов, продуцирующих бета-лактамазы, способных разрушать пенициллины, цефалоспорины I поколения (М. catarrhalis, S. aureus) и высокая активность макролидов в отношении к этим возбудителям.
4. Увеличение частоты атипичных возбудителей (М. pneumoniae, Chl. pneumoniae) в этиологии острых и рецидивирующих тонзиллофарингитов, аденоидов (до 43%), недоступных для пенициллинов (в том числе защищенных), цефалоспоринов, аминогликозидов, линкозамидов.
5. Незначительное количество побочных эффектов по сравнению с другими антибиотиками.
6. Отсутствие влияния на микрофлору кишечника и глотки.
7. Высокий диапазон безопасности.
8. Активность некоторых макролидов против H. influenzae.
9. Высокая активность макролидов не только против неспецифических возбудителей заболеваний глотки, но и специфических, активность против анаэробов – возбудителей паратонзиллитов.
10. Иммуномодулирующий эффект.
В соответствии с современными алгоритмами и протоколами этиотропной терапии инфекций органов дыхания макролиды являются препаратами выбора при респираторных микоплазмозах и хламидиозах [10–12, 14, 15]. При внебольничных пневмониях у детей школьного возраста и у подростков макролиды обсуждаются в качестве антибиотиков первого ряда. В то же время при фарингитах, ангинах, синуситах, остром гнойном среднем отите, а также при бронхитах и внегоспитальных пневмониях у детей-дошкольников терапию рекомендуют начинать с бета-лактамных антибиотиков (природные или полусинтетические пенициллины, цефалоспорины). Макролиды при этих заболеваниях рассматриваются в качестве альтернативных средств. Независимо от формы респираторной инфекции макролиды могут быть включены в стартовую терапию в тех случаях, когда у ребенка имеется непереносимость бета-лактамных антибиотиков. Представленные подходы базируются на особенностях этиологии различных форм респираторных инфекций и чувствительности возбудителей к основным группам антибиотиков. Так, Chl. рneumoniae и М. pneumoniae, вызывающие соответственно респираторный хламидиоз и микоплазмоз, высокочув-ствительны к макролидам, при том что бета-лактамные антибиотики не оказывают на них ингибирующего влияния. Это является основанием рекомендовать макролиды для стартовой терапии респираторных инфекций хламидиозной и микоплазмозной этиологии. Принимая во внимание, что синуситы, гнойный средний отит, а также пневмонии у детей первых 5 лет жизни опосредованные только грамположительными кокками, чувствительными к макролидам, но и грамотрицательными палочками, устойчивыми к большинству макролидных антибиотиков, последние не должны рассматриваться в качестве препаратов первого ряда. В то же время особенности этиологии пневмонии у школьников и подростков с возрастанием роли микоплазмы определяют возможность назначения макролидов в дебюте заболевания. Таким образом, стартовая терапия респираторных инфекций макролидными антибиотиками показана при атипичной этиологии заболевания (микоплазмоз, хламидиоз), а также при развитии нетяжелой внебольничной пневмонии у детей старшего возраста [1, 10, 15, 16].
Кларитромицин – один из последних синтезированных макролидов, имеющий оптимальное соотношение эффективности и безопасности. Фармакокинетические особенности: способность создавать высокие концентрации в тканях, превышающие таковые в плазме; высокая тропность к тканям дыхательной системы; внутриклеточное проникновение и накопление; образование активных метаболитов. Кларитромицин благодаря хорошей растворимости как в воде, так и в липидах легко проникает внутрь клеток (в т.ч. в клетки иммунной системы – макрофаги и нейтрофилы) и накапливается в них в высоких концентрациях. Он свободно обменивается между межклеточной и внутриклеточной средой, и уровень антибиотика в очаге всегда превышает минимальную подавляющую концентрацию для многих патогенов [20, 21].
Кларитромицин эффективен в отношении внутриклеточных микроорганизмов: Chlamydia trachomatis, Chlamydia pneumoniae, Ureaplasma urealyticum, Mycoplasma pneumoniae, Legionella pneumophila; грамположительных бактерий: стрептококки, в т.ч. S. рneumoniae, стафилококки, Listeria monocytogenes, Corynebacterium spp.; грамотрицательных бактерий: Haemophilus influenzae, Haemophilus ducreyi, Bordetella pertussis, Pasteurella multocida, Moraxella catarrhalis, Neisseria gonorrhoeae, Neisseria meningitidis, Borrelia burgdorferi, Campylobacter spp. Важным микробиологическим свойством кларитромицина является его мощное действие в отношении Helicobacter pylori, по уровню которого он превосходит другие макролиды. Кларитромицин активен в отношении некоторых анаэробов: Eubacterium spp., Peptococcus spp., Propionibacterium spp., Clostridium perfringens, Bacteroides melaninogenicus; а также в отношении Toxoplasma gondii, Mycobacterium spp. (кроме Mycobacterium tuberculosis).
Одним из представителей кларитромицинов является Фромилид® (KRKA, Словения). Фромилид выпускается в разных лекарственных формах, что позволяет осуществлять лечение практически на протяжении всего периода детства: в виде таблеток по 0,25 и 0,5, пролонгированной формы Фромилид Уно. С сентября 2011 г. в аптечной сети появилась новая форма Фромилида – гранулят для приготовления суспензии с содержанием кларитромицина 125 мг / 5 мл. Препарат зарегистрирован для применения у детей с 6 месяцев жизни (табл. 1, 2).
Таблица 1. Дозирование Фромилида при инфекциях дыхательных путей в зависимости от возраста ребенка
|
Возраст и показания
|
Фромилид Уно, таблетки пролонгированного действия 500 мг
|
Фромилид, таблетки 250 мг
|
Фромилид, таблетки 500 мг
|
|
Дети старше 12 лет
|
|
Легкие и умеренно тяжелые инфекции
|
500 мг 1 раз в сутки
|
250 мг 2 раза в сутки
|
|
|
Инфекции связанные с
H. influenzae
Синусит
Пневмония
Более тяжелые инфекции
|
1000 мг 1 раз в сутки
|
|
500 мг 2 раза в сутки
|
|
Дети в возрасте младше 12 лет
|
Суспензия, 125 мг/5 мл
|
|
7,5 мг/кг массы тела 2 раза в сутки
|
Таблица 2. Принцип дозировки суспензии Фромилида (гранулят для приготовления суспензии 125 мг/мл с дозирующим шприцем)
|
Масса тела ребенка
|
Доза, мл (шприц)
|
Доза, мг
|
|
8 кг
|
2,5 (1/2) 2 раза в сутки
|
62,5
|
|
16 кг
|
5 (1) 2 раза в сутки
|
125
|
|
24 кг
|
7,5 (1,5) 2 раза в сутки
|
187,5
|
|
33 кг
|
10 (2) 2 раза в сутки
|
250
|
До недавнего времени одним из факторов, уменьшающим комплайенс при назначении препаратов кларитромицина, был двукратный режим дозирования препарата.
Разработанная новая оригинальная лекарственная форма кларитромицина – ФромилидУно [3] . Таблетка покрыта защитной кислотоустойчивой оболочкой. Она способствует медленному высвобождению активного вещества в тонком кишечнике. Таблетка также содержит альгинат кальция, который в присутствии воды набухает и постепенно вытесняет молекулы кларитромицина, в результате чего обеспечивается постоянное всасывание препарата и возможность однократного приема его в течение суток. Проведенное сравнение однократного (Фромилид Уно) и двукратного (обычный Фромилид) применения кларитромицина свидетельствует об идентичности фармакокинетики этих двух форм антибиотика. При применении Фромилида Уно достоверно уменьшились колебания концентрации кларитромицина и его метаболита (14-гидроксикларитромицина) в плазме. Выявлено повышение биодоступности кларитромицина пролонгированного действия при приеме во время еды [23, 26, 34].
Ценным свойством и немаловажным преимуществом Фромилида Уно перед другими макролидами является менее выраженное по сравнению с другими макролидами действие препарата на мотилиновые рецепторы желудочно-кишечного тракта, что способствует снижению побочных проявлений (боль в животе, тошнота и рвота), типичных для макролидов.
У Фромилида выявлены важные неантибиотические свойства: иммунотропная активность и противовоспалительное действие. Фромилид повышает фагоцитарную активность нейтрофилов и макрофагов, обладает синергическим эффектом с комплементом сыворотки крови, увеличивает активность Т-хелперов [22, 32, 33]. Препарат в группе макролидов характеризуется наибольшей ингибирующей активностью в отношении провоспалительных цитокинов. Кроме того, Фромилидспособен блокировать процесс распространения инфекции за пределы первичного очага уже в первые 2–4 ч после приема, что связывают с быстрым захватом антибиотика лейкоцитами и таким же быстрым высвобождением во внеклеточное пространство, что вызывает гибель бактерий. Препарат может воздействовать на процессы перекисного окисления липидов, а также (в отличие от других макролидов) уменьшать образование лейкотриена В4, ответственного за хемотаксис нейтрофилов и приводящего к инициации воспаления. Важным механизмом противовоспалительного действия Фромилида является его способность ингибировать выработку и высвобождение NO альвеолярными макрофагами, что уменьшает воспаление дыхательных путей. При применении Фромилида уменьшается степень интраназальной гиперсекреции и наблюдается улучшение реологических свойств мокроты [17, 34].
Фромилид Уно имеет определенные уникальные свойства, которые выделяют его из группы других макролидов:
1. Избирательность действия, а следовательно – безопасность применения. Под избирательным действием Фромилида Уно понимают высокую активность препарата в отношении трех типичных (Str. pneumoniae, H. influenzae и M. catarrhalis) и трех атипичных (Chl. pneumoniae, M. pneumoniae, L. pneumophila) микроорганизмов – наиболее распространенных возбудителей инфекций дыхательных путей.
2. Клиническая эффективность, которая определяется уникальным фармакокинетическими свойствами Фромилида Уно. Ретардная форма обеспечивает пролонгированный антибактериальный и высокий терапевтический эффект в режиме дозирования один раз в сутки [28].
Кроме того, Фромилиду Уно свойственен эффект «2 в 1». Приблизительно половина дозы кларитромицина, поступая в организм, метаболизируется в печени с образованием активного метаболита – 14-гидроксикларитромицина, который по антибактериальной активности не уступает предшественнику. Благодаря синер-гизму со своим активным метаболитом кларитромицин сохраняет высокую активность, даже если уровень препарата в крови несколько ниже минимальной подавляющей концентрации.
3. Удобство применения, а значит, и повышение комплайенса терапии. Прием один раз в сутки оптимален для пациента.
Доказано, что макролиды столь же эффективны, как пенициллины, и обеспечивают эрадикацию возбудителя из миндалин более чем у 90–95% больных, тем самым осуществляют надежную профилактику серьезных осложнений ангин – ревматизма и гломерулонефрита [19, 24, 29].
По данным крупного европейского многоцентрового исследования, при лечении тонзиллита и фарингита у 1065 детей кларитромицин был эффективен у 95% больных. Данные о равной высокой клинической (98 и 97%) и бактериологической (86 и 88%) эффективности кларитромицина и амоксициллина при тонзиллофарингите были получены в контролируемом исследовании с участием 191 ребенка [18, 27].
Позитивным свойством применения Фромилида Уно при бактериальных инфекциях ротоглотки является создание постантибиотического эффекта – продолжение подавления роста микроорганизмов при удалении антибиотика из среды. В терапии бактериальных инфекций ротоглотки особенно привлекательным эффектом Фромилида Уно является возможность стимуляции функции иммунокомпетентных органов, которые представляют собой структуры лимфоидно-глоточного кольца Вальдейера–Пирогова. Миндалины и лимфоидная ткань, ассоциированная со слизистыми оболочками верхних дыхательных путей, обусловливают резистентность не только верхних, но и нижних дыхательных путей и пищевода. Проникая внутрь макрофагов, фибробластов, нейтрофильных лейкоцитов, Фромилид Уно способен транспортироваться вместе с клетками, оказывая антимикробное действие непосредственно в очаге воспаления [6].
Доказано, что кларитромицин хорошо проникает в слизистую придаточных пазух носа и накапливается там в концентрациях, превышающих сывороточные и минимальные подавляющие концентрации для возбудителей синусита. По данным многоцентрового европейского исследования с участием 310 детей, страдающих острым синуситом, и 315 детей с ринитом эффективность кларитромицина при синусите составила 97,3%, а при рините – 93,8% [25, 31]. Фромилид Уно один раз в сутки на протяжении 7 дней рекомендован при лечении синуситов. Применение Фромилида Уно для лечения гнойных синуситов вполне оправданно вследствие представлений о спектре действия этого препарата в отношении основных современных возбудителей указанных заболеваний, а также способности создавать стойкие высокие внутритканевые концентрации.
В связи с активным поступлением и кумуляцией Фромилида Уно в полостях среднего уха он может с успехом использоваться для терапии средних отитов [35].
Антибактериальная терапия острого тонзиллофарингита [2]. Наиболее частые возбудители острого тонзиллофарингита – вирусы (риновирус, коронавирус, вирусы гриппа и парагриппа, аденовирус и др.). Среди бактериальных возбудителей наибольшее значение имеет ?-гемолитический стрептококк группы А. В последнее время все чаще отмечают присутствие внутриклеточных возбудителей – M. pneumoniae и Chl. pneumoniae.
Антибактериальная терапия при среднетяжелом и тяжелом течении тонзиллофарингита может быть начата до получения результатов бактериологического исследования при наличии эпидемиологических и клинических данных, указывающих на стрептококковую этиологию.
Препаратом выбора для лечения тонзиллофарингита является пенициллин, так как стрептококки группы А остаются универсально высокочувствительны к бета-лактамным антибиотикам. У пациентов с доказанной аллергией на пенициллины сразу же следует применять макролиды (кларитромицин). Макролиды назначаются также при появлении аллергических реакций в ходе лечения пенициллинами. Кларитромицин назначается также, если есть данные о внутриклеточных возбудителях. Курс лечения пенициллином и кларитромицином составляет 10 дней.
Антибактериальная терапия острого синусита [2]. Острый синусит относится к числу самых распространенных заболеваний. Он является наиболее частым осложнением ОРВИ (5–10%). Основными возбудителями являются S. pneumoniae, H. influenzae, M. catarrhalis, несколько реже – Str. pyogenes, S. aureus. При синуситах одонтогенного происхождения причиной могут быть анаэробы. S. pneumoniae и H. influenzae сохраняют высокую чувствительность к аминопенициллинам и цефалоспоринам. Общая тенденция – рост резистентности Str. pneumoniae к амоксициллину. У пациентов, которые получали недавно курс амоксициллина, значительно выше вероятность выделения микроорганизмов, продуцирующих ?-лактамазы. При легком и среднетяжелом течении препаратами выбора являются амоксициклин и защищенные пенициллины, альтернативные препараты – цефуроксим аксетил, из макролидов рекомендуют кларитромицин как действующий на H. influenzae. При легком и среднетяжелом течении следует использовать только пероральные препараты, парентеральная терапия проводится только при тяжелом течении в условиях стационара. Если положительная динамика отсутствует в течение 48 ч после начала антибиотикотерапии производят пункцию верхнечелюстной пазухи с целью уточнения характера возбудителя и его чувствительности к антибиотику. Длительность антибиотикотерапии амоксициллином, цефалоспорином и кларитромицином даже при уменьшении выраженности клинических симптомов в первые дни составляет 710 дней. Только в этих случаях удается добиться эрадикации возбудителя. В то же время частота нежелательных реакций, в т.ч. аллергических при лечении амоксициллином/клавуланатом была существенно выше.
Антибактериальная терапия острого среднего отита [2, 15]. Острые воспаления среднего уха составляют 15–20% всех ЛОР-заболеваний и 65–70% всех заболеваний уха. На первом году жизни 44% детей переносят острый средний отит 1–2 раза, а в возрасте до 3 лет 35% детей болеют 3 раза и более. Основные причины возникновения среднего отита – вирусные и бактериально-вирусные инфекции. Главная роль принадлежит вирусам гриппа, респираторно-синцитиальным, а также риновирусам, обладающим наибольшей тропностью к слизистой оболочке верхних дыхательных путей. Доказано, что они вызывают воспаление и отек слизистой оболочки слуховой (евстахиевой) трубки, нарушение мукоцилиарного клиренса мерцательного эпителия, обструкцию трубы и задержку экссудата в барабанной полости. Полагают, что вирусные инфекции являются в определенной степени лишь пусковым моментом этиологии и развития воспаления среднего уха, а уже на 3–4-й день присоединяется бактериальная флора. Микрофлора при остром среднем отите практически идентична таковой при остром синусите, поскольку источник инфекции при ОРВИ – носоглотка.
Назначение антибиотиков производится по тем же принципам, что и при остром синусите и зависит от тяжести течения. При тяжелом течении и в возрасте до 2 лет антибиотики назначаются практически всегда. В первые дни эмпирически, в дальнейшем, если сделан парацентез или появляется гноетечение, выбор зависит от флоры и ее резистентности.
Препараты первого ряда для терапии острого среднего отита в настоящее время – амоксициллин и амоксициллин/клавуланат. Альтернативными препаратами являются макролиды (кларитромицин) и цефалоспорины. Данные последнего времени указывают на важную роль внутриклеточных возбудителей в этиологии острых средних отитов, в этих случаях кларитромицин назначается сразу.
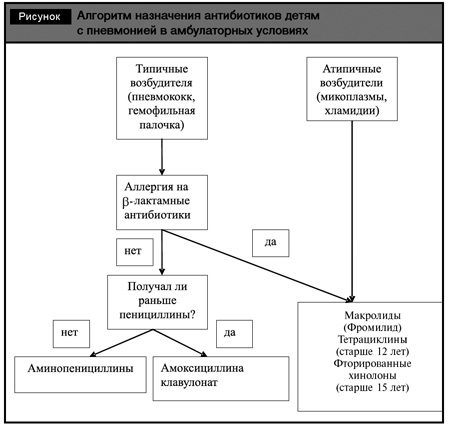
Спектр возбудителей внебольничных пневмоний у детей зависит от возраста и варианта течения болезни (табл. 3). Алгоритм назначения антибактериальной терапии при пневмониях в амбулаторных условиях представлен на рисунке.
Таблица 3. Этиологическая структура внебольничных пневмоний у детей в зависимости от возраста
|
Возраст ребенка
|
Типичные пневмонии
|
Атипичные пневмонии
|
|
1–6 мес.
|
E. coli и другая грамотрицательная кишечная флора
Стафилококки
M. catarrhalis
Str. pneumoniae
H. influenzae
|
Chl. trachomatis
P. carinii – у недоношенных и ВИЧ-инфицированных детей
|
|
6 мес. – 6 лет
|
Str. pneumoniae
H. influenzae
|
M. pneumoniae
Chl. pneumoniae
|
|
7–15 лет
|
Str. pneumoniae
H. influenzae
Str. pyogenes
|
M. pneumoniae
Chl. pneumoniae
|
Обобщенный алгоритм антибиотикотерапии острых бактериальных внебольничных инфекций дыхательных путей представлен в табл. 4.
Таблица 4. Обобщенный алгоритм антибиотикотерапии острых бактериальных инфекций верхних нижних дыхательных путей у детей
|
Заболевание, клиническая ситуация
|
Острый тонзиллит
|
Острая пневмония, острый синусит, острый отит, острый бронхит
|
Гиперчувстви-тельность к пенициллинам
|
Данные в пользу икоплазменной или хламидийной нфекции
|
|
Стартовый препарат
|
Пенициллины, аминопеницил-лины, защищенные аминопенициллины
|
Аминопеницил-лины, защищенные аминопенициллины
|
Макролиды (Фромилид)
|
Макролиды (Фромилид)
|
|
Отсутствие эффекта
|
Цефалоспорины II–III поколений
|
Тетрациклины (старше 12 лет), ранние фторхинолоны (старше 15 лет)
|
|
При атипичных возбудителях – макролиды (Фромилид)
|
Таким образом, Фромилид открывает новые возможности антибактериальной терапии острых инфекций дыхательных путей у детей в амбулаторных условиях.
Л И Т Е Р А Т У Р А
1. Антибактериальная терапия стрептококкового тонзиллита и фарингита: метод. рекоменд / Под ред. В.А. Насоновой, Б.С. Белова, Л.С. Страчунского и др. // Клин. микробиология и антимикроб. терапия. – 1999. – № 1. – С. 78–82.
2. Богомильский М.З. // Трудный пациент. – 2008. – № 12. – С. 14–18.
3. Бойкова Н.Э. // Рус. мед. журн. – 2009. – № 23. – С. 1543–1548.
4. Гарашенко Т.И., Богомильский М.Р. // Детские инфекции. – 2004. – № 1. – С. 23–25.
5. Горшкова П.Б., Глухарева Н.С., Заплатников А.П. // Рус. мед. журн. – 2010. – № 20. – С. 1237–1240.
6. Гуров А.В. // Рус. мед. журн. – 2008. – № 22. – С. 1520–1524.
7. Заплатников А.П., Коровина Н.А. // Рус. мед. журн. – 2006. – № 9. – С. 1333–1338.
8. Ключников С.О., Болдырева В.Б. // Рус. мед. журн. – 2007. – № 21. – С. 1552–1559.
9. Коровина Н.А., Заплатников А.П. // Рус. мед. журн. – 2004. – № 13. – С. 778–786.
10. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Антибактериальная терапия респираторных заболеваний в амбулаторной практике врача-педиатра. – М., 2000. – 52 с.
11. Острые респираторные заболевания у детей: лечение и профилактика: науч.-практ. программа Союза педиатров России. – М., 2002. – 69 с.
12. Самсыгина Г.А. // Consilium medicum. – 2001. – № 2 (приложение, вып. 3). – С. 3–7.
13. Синопальников А.И., Гучев И.А. // Рус. мед. журн. – 2003. – № 2. – С. 88–92.
14. Страчунский Л.С. Антибактериальная терапия в педиатрической практике. – М., 1999. – С. 3–8.
15. Страчунский Л.С., Богомильский М.Р. // Детский доктор. – 2001. – № 1. – С. 5–7.
16. Таточенко В.К., Середа Е.В., Федоров А.М. и др. // Клин. микробиология и антимикроб. терапия у детей. – 2000. – № 1. – С. 77–87.
17. Giamarellos-Bourboulis E.J. // Int. J. Antimicrob. Agents. – 2008. – Vol. 31, N 1. – P. 12–0.
18. Kamdar M.K., Coles S. J. // Br. J. Clin. Pract. – 1997. – Vol. 51, N 3. – P. 133–137.
19. Kardas P. // J. Antimicrob. Chemother. – 2007. – Vol. 59, N 3. – P. 531–536.
20. Klein J. O. // Pediatr. Infect. Dis. J. – 1993. – Vol. 12, N 3. – P. 148–151.
21. Klein J. O. // Pediatr. Infect. Dis. J. – 1997. – Vol. 16, N 4. – P. 427–431.
22. Kohyama T., Yamauchi Y., Takizawa H. et al. // Respir. Med. – 2008. – Vol. 102, N 12. – P. 1769–76.
23. MacLeon C.M. // Macrolides in New Millenium. – Crete, 1998. – P. 34–35.
24. McCarthy J., Hedrick J., Gooch M. // ICMASK. – Barcelona, 1998. – P. 140–141.
25. Miyazawa Т., Iino Y., Ogawa K. et al. // Jpn. J. Antibiot. – 1998. – Vol. 51. – P. 100–102.
26. Nightingale C. H. // Pediatr. Infect. Dis. J. – 1997. – Vol. 16, N 4. – P. 438–443.
27. Normand Y., Drugeon H., Abbas S., Palestro B. // Therapie. – 2004. – Vol. 59, N 1. – P. 155–62.
28. Periti P., Mazzei T. // J. Chemother. – 1999. – Vol. 11, N 1. – P. 11–27.
29. Pichichero M. E. // Ann. Emerg. Med. – 1995. – Vol. 25, N 3. – P. 390–403.
30. Red Book: 2000. Report of the Committee on Infection Diseases. 25rd. – American Academy of Pediatrics, 2000. – 855 p.
31. Soriano F., Granizo J.J., Coronel P. et al. // Int. J. Antimicrob. Agents. – 2004. – Vol. 23. – P. 296–299.
32. Sugiyama K., Shirai R., Mukae H. et al. // Clin. Exp. Immunol. – 2007. – Vol. 147, N 3. – P. 540–546.
33. Tamaoki J, Kadota J, Takizawa H. // Am. J. Med. – 2004. – Vol. 117 (Suppl. 9A). – P. 5–11.
34. Tarlow M. J., Block S. L., Harris J., Kolokathis A. // Pediatr. Infect. Dis. J. – 1997. – Vol. 16, N 4. — P. 457–462.
35. Zhanel G.G., DeCorby M., Noreddin A. et al. // J. Antimicrob. Chemother. – 2003. – Vol. 52, N 1. – P. 83–88.
Медицинские новости. – 2011. – №9. – С. 63-68.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.