.jpg) В Республике Беларусь по состоянию на начало 2010 г. выявлено и учтено 1 539 470 лиц с артериальной гипертензией (АГ) [7]. Каждый пациент с АГ должен оцениваться комплексно, с учетом не только цифр артериального давления (АД), но и наличия у него известных факторов риска (ФР), повышающих риск развития сердечно-сосудистых осложнений (ССО). Грозное сочетание артериальной гипертензии с такими ФР, как абдоминальное ожирение, гипергликемия, дислипидемия, составляет в совокупности метаболический синдром, каждая составляющая которого суще-ственно повышает сердечно-сосудистый риск (ССР). По данным литературы, до 40% лиц с эссенциальной артериальной гипертензией имеют дислипидемию [10], ведущий ФР развития атеросклероза и как следствие ишемической болезни сердца (ИБС). Известно, что каждый лишний сантиметр талии увеличивает риск развития сердечно-сосудистых заболеваний на 2% [12]. Недостаточное медикаментозное воздействие на эти патогенетические механизмы сохраняет тенденцию неуклонного прогрессирования заболевания. Большое клиническое и прогностическое значение имеет выявление и адекватная коррекция у лиц с АГ вышеуказанных факторов риска, поскольку может предотвратить у них развитие атеросклероза и ССО.
В Республике Беларусь по состоянию на начало 2010 г. выявлено и учтено 1 539 470 лиц с артериальной гипертензией (АГ) [7]. Каждый пациент с АГ должен оцениваться комплексно, с учетом не только цифр артериального давления (АД), но и наличия у него известных факторов риска (ФР), повышающих риск развития сердечно-сосудистых осложнений (ССО). Грозное сочетание артериальной гипертензии с такими ФР, как абдоминальное ожирение, гипергликемия, дислипидемия, составляет в совокупности метаболический синдром, каждая составляющая которого суще-ственно повышает сердечно-сосудистый риск (ССР). По данным литературы, до 40% лиц с эссенциальной артериальной гипертензией имеют дислипидемию [10], ведущий ФР развития атеросклероза и как следствие ишемической болезни сердца (ИБС). Известно, что каждый лишний сантиметр талии увеличивает риск развития сердечно-сосудистых заболеваний на 2% [12]. Недостаточное медикаментозное воздействие на эти патогенетические механизмы сохраняет тенденцию неуклонного прогрессирования заболевания. Большое клиническое и прогностическое значение имеет выявление и адекватная коррекция у лиц с АГ вышеуказанных факторов риска, поскольку может предотвратить у них развитие атеросклероза и ССО.
Гиполипидемические препараты пред-ставлены несколькими группами лекарств, однако лидирующее положение среди них принадлежит статинам, для которых доказано снижение риска развития ССО и смертности по результатам многочисленных международных исследований.Действие статинов основывается на частичном обратимом ингибировании фермента 3-гидрокси-3-метилглутарил-коэнзим-А-редуктазы (ГМГ-Ко-А редуктазы) и блокировании превращения ГМГ-Ко-А в мевалоновую кислоту (первый этап эндогенного синтеза холестерина (ХС), что приводит к снижению синтеза ХС в гепатоцитах. По механизму обратной отрицательной связи снижение образования внутриклеточного ХС стимулирует захват из плазмы липопротеидов очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), промежуточной плотности и ремнантных частиц [4]. Положительные эффекты статинов связаны не только с подавлением биосинтеза ХС в гепатоцитах, но и наличием многочисленных плейотропных эффектов, которых в настоящее время описано более двух десятков [1, 6, 9, 14].
Цель исследования – изучение влияния терапии симвастатином («Симвалип-ЛФ», СООО «Лекфарм», Республика Беларусь) на показатели липидного, пуринового обменов и функцию эндотелия сосудов у лиц с АГ с высоким ССР.
Материалы и методы
Контрольную группу составили 14 практически здоровых лиц (9 женщин и 5 мужчин), без ожирения и дислипидемии, средний возраст 38,7 ± 10,7 года и 20 пациентов (12 женщин и 8 мужчин) с АГ I, II степени протекающей в сочетании с абдоминальным ожирением и гиперхолестеринемией, средний возраст 51,9 ± 9,0 года. Диагноз артериальная гипертензия I, II степени верифицирован в соответствии с национальными рекомендациями (2010 г.) по диагностике, лечению и профилактике артериальной гипертензии [7]. В течение всего периода наблюдения (3 мес.) больные получали гипотензивную терапию с применением ингибитора АПФ и антагониста кальция, а в качестве гиполипидемической терапии назначался симвастатин («Симвалип-ЛФ», СООО «Лекфарм», РБ) в дозе 20 мг/сут, однократно в вечернее время. Никто из пациентов ранее гиполипидемическую терапию не принимал.
Всем больным была рекомендована гипохолестериновая низкокалорийная диета, увеличение физической активности. В исследование не включались пациенты с верифицированной ИБС, нарушениями ритма, сахарным диабетом, печеночной или почечной недостаточностью, наличием ИБС, недостаточностью кровообращения выше Н1.
Всем обследованным выполнялись общеклинические анализы крови и мочи, измерялись: рост, вес, окружность талии (ОТ) и окружность бедер (ОБ), рассчитывались индекс ОТ/ОБ и индекс массы тела (ИМТ) (ИМТ = вес(кг)/рост2(м)). Определяли ряд биохимических показателей: мочевина, креатинин, мочевая кислота, показатели функции печени (билирубин, АсАТ, АлАТ). Электрофоретическим методом выполнялось определение общего холестерина (ОХС), липопротеидов высокой плотности (ЛПВП), ЛПНП, триглицеридов (ТГ). Рассчитывался коэффициент атерогенности (КА) (КА = ОХС/(ОХС–ЛПВП)).
Функция эндотелия оценивалась по уровню эндотелийзависимой вазодилатации (ЭЗВД) и количеству циркулирующих эндотелиальных клеток (ЦЭК). ЭЗВД определяли с помощью аппаратно-программного комплекса «Импекард-М» (РБ) при проведении пробы с реактивной гиперемией. Методом реоимпедансографии измерялась исходная скорость кровенаполнения обоих предплечий в покое (после 10–15-минутного пребывания больного в горизонтальном положении). Затем накладывали компрессионную манжетку на правое плечо, давление в которой повышали на 50 мм рт. ст. от исходного в течение 5 мин, вызывая таким образом реактивную гиперемию, в ответ на которую возникает ЭЗВД. После прекращения окклюзии оценивали относительное изменение максимальной скорости кровенаполнения (Ddz/dt) в течение 5 мин. Признаком ДЭ считали прирост Ddz/dt менее 12% через 1 мин после снятия манжетки. Диапазон значений Ddz/dt от 12% до –2% соответствовал 1-й степени ДЭ, от –2% до –15% – 2-й степени ДЭ, менее –15% – 3-й степени ДЭ. ЦЭК подсчитывались в камере Горяева в цитратной плазме. Скорость распространения пульсовой волны (СРПВ) определяли с помощью того же комплекса «Импекард-М» для определения степени жесткости артериальной стенки.
Пациенты из группы принимающих «Симвалип-ЛФ» (симвастатин)проходили суточное мониторирование АД в начале и в конце программы обследования. Оценивались средние величины систолического АД (ср. вел. САД) и диастолического АД (ср. вел. ДАД), показатели вариабельности САД и ДАД, скорость утреннего подъема САД и ДАД, суточный индекс САД и ДАД соответственно и индекс времени САД и ДАД.
Статистическая обработка данных осуществлялась с помощью программы «STATISTIKA 7.0». Результаты исследования представлены в виде среднего значения ± среднего квадратического отклонения для параметрических данных и медианы и интерквартильного размаха для непараметрических данных. Достоверность различий между группами оценивали по t-критерию Стьюдента для нормально распределенного признака и по критерию Манна–Уитни для непараметрических данных. Достоверными считались изменения при значении вероятности ошибки р < 0,05.
Сравнительная характеристика групп
|
Показатель
|
Группа здоровых лиц
|
Группа Симвалипа-ЛФ
|
|
до лечения
|
после лечения
|
|
Количество обследованных
|
14
|
20
|
10
|
|
ИМТ, кг/м2
|
22,9 ± 1,9
|
32,6 ± 5,2
р1 < 0,001
|
33,5 ± 5,3
|
|
ОТ, см
|
80,6 ± 8,5
|
106,5 ± 9,9
р1 < 0,001
|
104,5 ± 9,3
|
|
ОБ, см
|
96,8 ± 5,0
|
110 [108;117]
р1 < 0,001
|
110,1 ± 7,7
|
|
ОТ/ОБ
|
0,83 ± 0,07
|
0,94 ± 0,07
р1 < 0,001
|
0,95 ± 0,07
|
|
Сахар, ммоль/л
|
5,0 ± 0,7
|
4,9 ± 1,0
|
4,7 [4,1;5,1] р2 = 0,03
|
|
Мочевина, ммоль/л
|
5,3 ± 1,4
|
4,8 ± 1,3
|
5,0 ± 1,5
|
|
Креатинин, мкмоль/л
|
82,9 ± 20,8
|
85 ± 22,3
|
78,5 ± 15,4
|
|
Мочевая кислота, мкмоль/л
|
292,6 ± 83,6
|
355,5 [291,5;498,5]
р1 = 0,04
|
224 [204;390]
р2 = 0,03
|
|
ОХС, ммоль/л
|
4,9 ± 0,7
|
6,8 [5,9;7,9]
р1 < 0,001
|
5,9 ± 1,3
р2 = 0,01
|
|
ХС ЛПВП, ммоль/л
|
1,77 ± 0,61
|
1,65 ± 0,54
|
1,66 ± 0,63
|
|
ХС ЛПНП, ммоль/л
|
3,04 ± 1,1
|
4,2 [3,3;4,9]
р1 = 0,01
|
4,0 ± 1,25
р2 = 0,03
|
|
КА
|
1,7 ± 0,69
|
2,69 [2,26;3,92]
|
2,13 ± 1,3
|
|
ТГ, ммоль/л
|
1,05 ± 0,51
|
1,6 [1,17;2,1]
р1 = 0,02
|
1,6 [1,4;2,5]
|
|
Билирубин, ммоль/л
|
13,8 ± 3,3
|
11,6 [10,9;16,4]
|
13,5 ± 3,6
|
|
АсАТ, МЕ
|
24 [20;26]
|
31,4 ± 8,8
р1 = 0,013
|
32,3 ± 12,0
|
|
АлАТ, МЕ
|
19 [17;33]
|
30 [25;42]
|
28 [25,43]
|
|
ЦЭК
|
3,4 ± 2,0
|
4 [3;5]
|
4,1 ± 2,0
|
|
СРПВ, м/с
|
5,5 [3,8;9,2]
|
4,3 [3,3;5,3]
|
8,0 [4,9;10,2]
|
|
SCORE, %
|
0 [0;1]
|
3 [1;4]
|
2 [1;4]
р2 = 0,04
|
|
Ср. вел. САД
|
|
118,5 [111,5;120,5]
|
119 [117;121]
|
|
Ср. вел. ДАД
|
|
74,5 [74;77,5]
|
75 [70;79]
|
П р и м е ч а н и е: p1 – достоверность при сравнении с группой здоровых; p2 – достоверность при сравнении с показателями до лечения в группе, получающей симвалип; ср. вел. САД – средняя величина систолического АД; ср. вел. ДАД – средняя величина диастолического АД.
Результаты и обсуждение
В наблюдаемой группе с артериальной гипертензией 6 лиц (30%) были с избыточной массой тела(ИМТ 25–29 кг/м2)и 13 (65%) – с ожирением (ИМТ >30 кг/м2).Отложение жира по абдоминальному типу ожирения, при индексе ОТ/ОБ ³0,9 было у 13 (65%) пациентов. У лиц с АГ абдоминальное ожирение расценивается как фактор риска при ОТ >102 см для мужчин и >88 см для женщин [7].В наблюдаемой группе у 16 (80%) больных имелся вышеуказанный ФР. Острота проблемы АГ протекающей в сочетании с абдоминальным ожирением обусловлена повышенным риском ССО у этих лиц, ранней инвалидизацией и смертностью от инфаркта миокарда и инсульта по сравнению с общей популяцией. Абдоминальное ожирение служит основой для развития инсулинорезистентности – механизма, запускающего каскад метаболических взаимосвязанных нарушений, которые легче предотвратить, чем лечить. Как видно из таблицы, группа пациентов достоверно отличалась от группы здоровых лиц по уровню мочевой кислоты, ОХС, ЛПНП и ТГ, что подтверждает, что метаболиче-ский каскад в виде нарушения пуринового и липидного обмена в наблюдаемой группе лиц с артериальной гипертензией уже запущен и в совокупности составляет метаболический синдром, повышающий риск развития сердечно-сосудистых заболеваний в 3 раза и риск смерти от них в 2 раза, а также риск развития сахарного диабета в 5 раз [11]. Кроме этого, отягощенный семейный анамнез (сердечно-сосудистые заболевания до 55 лет у мужчин и до 65 лет у женщин) был у 12 человек, курили 5. В сформированной группе пациентов 10 из 20 имели высокий 10-летний риск развития ССО (больше 5%) при оценке по шкале SCORE.
По данным литературы известно, что изменение образа жизни, направленное на снижение массы тела в сочетании с повышением двигательной активности, приводит к снижению АД. Однако, реализация данных рекомендаций для лиц с ожирением зачастую более трудная задача, чем контроль АД и ежедневный прием лекарств. В наблюдаемой группе только 4 человека снизили вес за 3 мес. в среднем на 2 кг, ОТ у них уменьшилась на в среднем на 2,5 см.
Медикаментозная терапия АГ в наблюдаемой группе лиц проводилась согласно Европейским и отечественным рекомендациям [7] с учетом имеющихся ФР и целевых цифр АД. На фоне гипотензивной терапии целевые цифры САД и ДАД достигнуты у всех пациентов и составили САД – 119,0 [117,0;121,0] мм рт.ст., ДАД – 75,0 [70,0;79,0] мм рт. ст. Отмечалось снижение вариабельности: вариаб. САД – с 39,0 [31,0;53,0] до 23,0 [21,0;40,0]; вариаб. ДАД – с 32,5 [26,0;47,0] до 23,0 [18;24]. Более значительно изменился индекс времени ДАД – с 36,3 [23,5;47,0] до 20,8 [14,3;22,2], чем индекс времени САД – с 20 [12,6;35,8] до 16,7 [8,3;21,6]. Суточный индекс изменялся незначительно: для САД – 9,3 [5,5;15,2] – 10 [4,2;20,7]; для ДАД – 14,6 [7,8;19,4] – 15,2 [8,9;18]. Показатели скорости утреннего подъема АД имели разную направленность: для САД этот показатель снизился с 24,2 [13;32,1] до 15,5 [13,9;30], а для ДАД повысился с 14,2 [7,5;22,4] до 22 [10,3;63,5].
Среди прочих ФР при АГ ключевое значение в развитии атеросклероза имеет дислипидемия, при уровне ОХ >5 ммоль/л, или ЛПНП >3 ммоль/л, или ЛПВП <1 ммоль/л у мужчин и <1,2 ммоль/л у женщин, или ТГ >1,7 ммоль/л [7]. При этом каждая составляющая этой дислипидемии представляет собой независимый ФР ИБС, а наличие всех компонентов у пациентов даже без сахарного диабета 2-го типа увеличивает риск ИБС в 3–5 раз [2]. У взятых под наблюдение лиц повышенный уровень ОХС выявлен у 90%, увеличение ЛПНП – у 93,3%, гипертриглицеридемия у 42,9%, уровень ЛПВП был снижен у 12,5%. Атерогенная дислипидемия (одновременное повышение ОХ, ЛПНП и снижение ЛПВП) выявлена у 12,5% пациентов. Патофизиология дислипидемии при АГ протекающей с абдоминальным ожирением связана с повышенной секрецией свободных жирных кислот из жировой ткани в печень, где происходит синтез ЛПОНП, а затем их выброс в кровоток. При помощи липопротеидлипазы ЛПОНП превращаются в атерогенные мелкие плотные частицы – ЛПНП. В условиях энтерогепатической циркуляции избыток ЛПНП частично вновь улавливается печенью для синтеза из них атерогенного апобелка Апо В-100, необходимого для сборки ЛПОНП. Остальные мелкие атерогенные частицы ЛПНП, на фоне имеющейся ДЭ, легко проникают в интиму сосудов и дают старт формированию атеросклеротической бляшки, а повышение их концентрации в крови на каждый 1 ммоль/л увеличивает риск развития ишемической болезни сердца в 1,57 раза [8]. Сегодня четко доказана закономерность: чем сильнее удастся снизить уровень ЛПНП, тем более значимо снижается риск ССО [3].
Нами в динамике наблюдались изменения исследуемых параметров после трехмесячной терапии атерогенной дислипидемии «Симвалипом-ЛФ» в суточной дозе 20 мг. В результате лечения удалось добиться снижение уровня ОХ на 13,2% от исходного (p < 0,05) и ЛПНП на 5,4% (p < 0,05), а КА снизился на 20,8%, что подтверждает адекватность проводимой гиполипидемической терапии. Достоверных измерений уровня ТГ не выявлено. За время наблюдения пациенты не предъявляли жалоб на миалгии и слабость в мышцах тела или какие-либо другие побочные эффекты, потребовавшие отмены препарата; уровень трансаминаз и билирубина достоверно не повышался.
В последние годы результаты многих научных трудов продемонстрировали неоспоримую роль ДЭ в атерогенезе и показали возможность нормализации функции эндотелия путем повышения уровня ЛПВП. Уровень ЛПВП повысился у 37,5% пациентов, из них у 1/3 лиц уровень повысился до целевых значений. Известно, что при повышении уровня ЛПВП на 1 мг/дл отмечается снижение ССР на 2–3% [2].
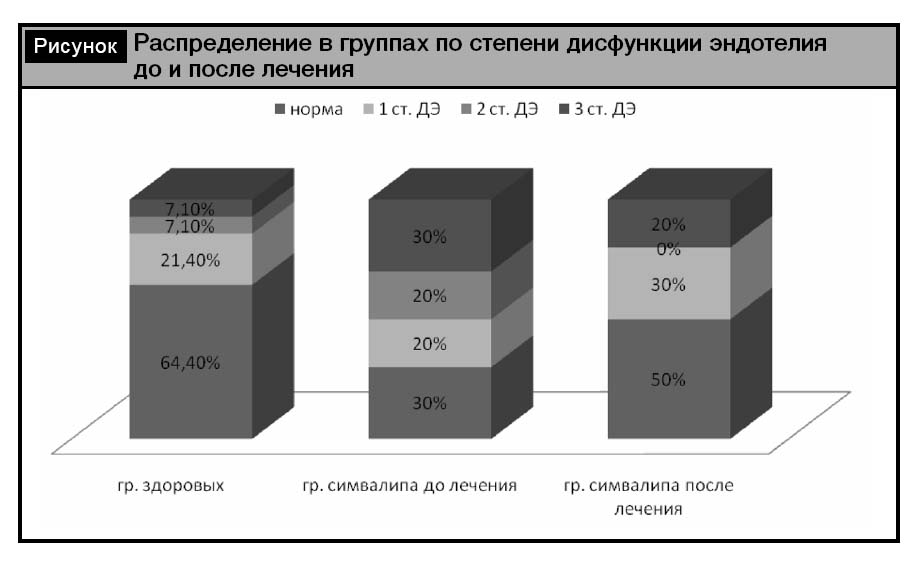
Из рисунка видно, что в контрольной группе количество лиц с нормальной функцией эндотелия составило 64,4%, с 1-й степенью ДЭ – 21,4%, со 2-й и 3-й степенью ДЭ – по 7,1%. В группе пациентов нормальная функция была у 30%, ДЭ отмечалась: 1-й ст. – у 20%, 2-й ст. – у 20% и 3-й ст. – у 30%. После проведенного лечения доля пациентов с нормальной функцией эндотелия увеличилось до 50%, с 1-й степенью ДЭ также увеличилась до 30% за счет больных со 2-й степенью ДЭ и составила 30%, уменьшилась доля лиц с 3-й степенью ДЭ, составив 20%. Следует отметить, что в контрольной группе лица с нормальной функцией эндотелия и 1-й степенью ДЭ суммарно составили 85,8%, а остальные пациенты со 2-й и 3-й степенью ДЭ – 14,2%. После проведенной терапии в группе больных это соотношение было схоже с группой контроля и составило 80% к 20%. Положительное влияние проводимой терапии на функцию сосудистого эндотелия вероятно обусловлено достижением целевых цифр АД с одной стороны и плейотропным эффектом статинов – с другой. Известно, что статины оказывают корригирующее влияние опосредованно через нормализацию липидного спектра крови и путем прямого воздействия на эндотелий – повышая продукцию NO-синтазы и оксида азота и подавленяя синтез эндотелина-1 и супероксиданиона [14]. Кроме того, статины снижают чувствительность липопротеидов к окислению, которые, в свою очередь, оказывают повреждающее действие на эндотелий [1]. По данным O’Driscoll и соавт. [13], лечение симвастатином приводит к улучшению эндотелиальной функции уже через 30 дней.
Нарушения липидного обмена находятся в тесной взаимосвязи с другими компонентами метаболического синдрома, что определяет необходимость комплексного подхода к лечению. Особо следует отметить положительное влияние назначенной терапии на содержание мочевой кислоты в плазме крови (снижение на 36,9%; р = 0,03), что, вероятно, обусловлено синергизмом действия иАПФ, дигидропиридинового антагониста кальция и симвастатина.
Таким образом,следует отметить, что несмотря на большое количество крупных клинических исследований, доказавших высокую эффективность статинов, сохраняется тенденция недостаточного использования этой группы препаратов в Республике Беларусь. К основным причинам относят: переоценка риска побочных эффектов и осложнений терапии статинами, формальное отношение врачей и больных к профилактике и лечению нарушений липидного обмена, а также недооценка эффективности использования статинов как средств профилактики и лечения атеросклероза и ССО. Применение симвастатина («Симвалип-ЛФ», СООО «Лекфарм», РБ) в комплексной терапии АГ с высоким ССР позволило снизить уровень ОХС и наиболее атерогенного ХС ЛПНП, способствовало снижению КА, повышению ЛПВП. При этом использование препарата «Симвалип-ЛФ» (симвастатин) характеризовалось высоким профилем безопасности. Проведенная комплекс-ная терапия привела к нормализации пуринового обмена и улучшила функцию эндотелия сосудов, что подчеркивает целесообразность ее применения у лиц с АГ высокого сердечно-сосудистого риска.
Л И Т Е Р А Т У Р А
1. Аронов Д.М. Симвастатин. Новые данные и перспективы. – М., 2002. – 80 с.
2. Драпкина О. М., Буеверова Е.Л. // РМЖ. – 2008. – Т. XIII, № 3. – С. 11–16.
3.Ежов М.В. // Вестн. «МЕДСИ». – 2010. – № 9. – С. 38–43.
4. Королева О.С., Затейщиков Д.А., Сидоренко Б. А. // Кардиология. – 2005. – № 5. – С. 60–71.
5. Мохорт Т.В., Сысоева О.В. // Мед. новости. – 2007. – № 3. – С. 46–51.
6. Напалков Д.А., Жиленко А.В. // Лечащий врач. – 2009. – № 2. – С. 48–51.
7. Национальные рекомендации. Диагностика, лечение и профилактика артериальной гипертензии. – Минск, 2010. – 52 с.
8. Российские рекомендации, разработанные группой экспертов ВНОК. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. – М., 2004. – 58 с.
9. Суджаева О.А., Манак Н.А., Карпова И.С. // Мед. новости. – 2006. – № 5. – С. 90–96.
10. Cifkova R., Nilsson P.M. // Eur. Society of Hypertens. Scient. Newsletter: Update on Hypertension Management. – 2008. – N 9. – Р. 35.
11. Ford E.S., Giles W.H., Dietz W.H. // JAMA. – 2002. – Vol. 287. – P. 356–359.
12. Koning L., Merchant A.T., Pogue J. et al. // Eur. Heart J. – 2007. – Vol. 28, N 7. – P. 850–856.
13. O`Driscoll G., Green D., Tylor R. // Circulation. – 1997. – Vol. 95. – P. 1126–1131.
14. Simons L.A., Sullivan D., Simons J. et al. // Atherosclerosis. – 1998. – Vol. 137. – P. 197–203.
Медицинские новости. – 2011. – №6. – С. 37-40.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.