Effectiveness assessment of Enterogermina probiotic for correction of dysbacteriosis in children
Nazarenko O.N., Yurchik K.V., Bondar T.A., Zagorsky S.E.
В настоящее время проблема дисбактериоза кишечника является предметом острой дискуссии среди гастроэнтерологов и педиатров [1]. Причиной тому послужила абсолютизация, зачастую спекулятивная, состояния микрофлоры кишечника, возведение этого понятия в ранг клинико-бактериологического диагноза [1]. Это мешает своевременной постановке диагноза и в лучшем случае может привести к несвоевременному назначению адекватной терапии (например, при болезнях с синдромом мальабсорбции), а в худшем – к прогрессированию процесса или развитию опасных для жизни осложнений (например, при кишечных инфекциях или начальных проявлениях хронических воспалительных заболеваний кишечника). Необходимо помнить, что дисбактериоз кишечника не является нозологической единицей, так как не соответствует критериям болезни. По общепринятому определению, дисбактериоз – такое состояние микроэкосистемы кишечника, при котором имеют место выраженные ее количественные и качественные изменения, сопровождающиеся появлением ряда клинических симптомов болезни, причем эти изменения являются существенными и стойкими [1, 2].
По убеждению профессора А.И. Хавкина [1], дисбактериоз не является симптомом, синдромом или симптомокомплексом. Изменение состава микрофлоры правильнее всего определять как патогенетическое звено в цепи патологического процесса в желудочно-кишечном тракте (ЖКТ), отражением состояния его микроэкологии, т.е. дисбактериоз кишечника всегда вторичен. Причинами его часто являются любые заболевания органов пищеварения, так как при этом всегда изменяется внутренняя среда кишки. Нередкими причинами дисбактериоза могут быть антибиотикотерапия, перенесенные острые кишечные инфекции [3], функциональные нарушения моторики, диетические особенности и, видимо, дефекты местного иммунитета [1, 2]. Исследования, проведенные нами ранее, показали, что у детей раннего возраста (которые, как известно, наиболее часто страдают от дисбактериоза) спектр причин развития дисбиотических расстройств несколько отличается от такового у старших детей. Существенную роль играет состояние здоровья матери (наличие урогенитальных инфекций в анамнезе), сроки прикладывания к груди и роды посредством кесарева сечения [4, 5]. По-видимому, эти факторы нарушают процесс заселения кишечника нормофлорой, приводя к развитию дисбактериоза. В свою очередь дисбактериоз как звено патогенеза может приводить к повреждению кишечного эпителия, нарушению процессов переваривания и всасывания, усугубляя уже имеющиеся нарушения в ЖКТ.
Таким образом, изменение качественного и количественного состава микрофлоры кишечника является объективной реальностью, процессом, неизбежно возникающим при любом неблагополучии в ЖКТ [1], проявляющимся рядом клинических симптомов и требующим коррекции [1, 2, 6]. В некоторых случаях коррекция дисбактериоза возможна только при одновременном воздействии, с одной стороны, на макроорганизм (устранение основного заболевания или причины дисбактериоза, нивелирование секреторных и моторно-эвакуаторных расстройств органов пищеварения), а с другой – на микрофлору кишечника. В легких случаях можно обойтись влиянием лишь на одно из названных звеньев дисбиоза [2, 6].
Специфическое воздействие на кишечный микробиоценоз осуществляют с помощью антибактериальных средств, иммуномодулирующих препаратов, а также пре- и пробиотиков [1, 2, 5, 6]. Применение антибактериальных средств, учитывая их негативное влияние на компоненты нормальной микрофлоры, должно осуществляться в наиболее тяжелых случаях, по показаниям и, как правило, ограничивается назначением нитрофурановых препаратов. Назначение иммуномодулирующей терапии обоснованно и с успехом применяется при затяжных формах дисбактериоза кишечника. Однако наиболее часто с целью коррекции дисбактериоза применяют про- и пребиотики, грамотного назначения которых в большинстве случаев бывает достаточно для достижения положительного эффекта [5, 6].
Согласно концепции Всемирной гастроэнтерологической организации [7], пробиотики – это живые микроорганизмы, которые могут быть включены в состав различных типов пищевых продуктов, включая лекарственные препараты и пищевые добавки. Наиболее часто в качестве пробиотиков используются штаммы лактобактерий и бифидобактерий. Также роль пробиотиков могут играть дрожжевые Saccharomycescerevisiae (bоulardii) [7, 8], Bacillussubtilis и Bacillus clausii(Энтерожермина), а также некоторые штаммы кишечной палочки. Строго говоря, термин «пробиотики» должен употребляться в отношении живых микроорганизмов, показавших в контролируемых исследованиях пользу для здоровья человека [3, 7, 8].
В группу бактерий молочной кислоты (БМК) включают штаммы Lactobacillus, Lactococcus, Streptococcusthermophilus. Так как вид Bifidobacterium не связан с ферментацией пищи и таксономически отличается от других бактерии молочной кислоты, обычно его не включают в эту группу. Многие пробиотики также представляют собой бактерии молочной кислоты, но некоторые (например, определенные штаммы E. coli, спорообразные и дрожжевые, используемые в качестве пробиотиков) ими не являются [3, 6, 7, 8].
Пребиотики – это пищевые вещества (в основном состоящие из некрахмальных полисахаридов и олигосахаридов, плохо перевариваемых человеческими ферментами), которые являются питательным субстратом для нормальной кишечной микрофлоры. К этому классу относят олигофруктозу, инулин, галактоолигосахариды, лактулозу и олигосахариды грудного молока. Эффекты пребиотиков: повышение количества бифидобактерий, увеличение всасываемости кальция, увеличение объема каловых масс, уменьшение времени кишечного транзита, вероятно, снижение уровня липидов крови. Пребиотики влияют на кишечную флору посредством увеличения числа полезных анаэробных бактерий и уменьшения популяции потенциально патогенных микроорганизмов [1, 2, 7, 8].
Пробиотики оказывают воздействие на желудочно-кишечную экосистему, стимулируя иммунные механизмы слизистой оболочки и неиммунные механизмы путем антагонизма с потенциальными патогенами. Этот феномен вызывает положительные эффекты, включающие уменьшение частоты и тяжести диареи, и является одним из наиболее признанных эффектов пробиотиков. В результате ряда исчерпывающих метаанализов результатов научных исследований Всемирной гастоэнтерологической организацией сделаны выводы, часть из которых, касающаяся детского возраста, приведена ниже [7].
1. Для определения роли пробиотиков как терапевтических средств при воспалительных заболеваниях кишечника все еще требуется проведение рандомизированных исследований с хорошо разработанным дизайном. Однако ряд работ указывает на позитивное их влияние [9].
2. Важным эффектом воздействия микрофлоры на тонкий кишечник является стимуляция иммунного ответа, которая обеспечивает профилактику пищевой аллергии и подавление патогенных микроорганизмов – рота- и полиовирусов, бактерий (сальмонелла, листерия, клостридии и т.д.), паразитов (например, токсоплазм) [2, 6, 7, 10, 11].
3. Несколько исследований продемонстрировали клинические выгоды от применения пробиотиков по сравнению с плацебо при синдроме раздраженного кишечника – уменьшение метеоризма, боли, общего самочувствия. B. Infantis 35624, L. Reuteri оказались эффективными в отношении лечения новорожденных и младенцев с инфантильными коликами [12].
4. StreptococcusThermophilus и LactobacillusBulgaricus улучшают перевариваемость лактозы и уменьшают симптомы, относящиеся к ее непереносимости [7].
5. Показано снижение риска смерти при язвенно-некротическом энтероколите у новорожденных на фоне пробиотиков [7].
6. Существуют доказательства того, что некоторые штаммы пробиотиков и пребиотическая олигофруктоза эффективны для повышения иммунного ответа: в исследованиях, направленных на профилактику острых инфекционных заболеваний (внутрибольничная диарея у детей, зимняя эпидемия гриппа), а также в работах, оценивающих ответ антител на введение вакцин.
7. Некоторые штаммы лактобактерий и бифидобактерий, так же, как и Bacillus clausii, уменьшают побочные эффекты антихеликобактерной терапии и повышает приверженность пациента лечению. Недавно проведенный метаанализ 14 рандомизированных исследований позволяет предположить, что добавление некоторых пробиотиков к антихеликобактерной терапии может оказаться эффективным в усилении эрадикации и помочь пациентам с ее пониженным уровнем [7, 13].
Как видно из сказанного выше, группа пробиотиков неоднородна и представлена условно двумя подгруппами. Первая подгруппа – компоненты нормальной микрофлоры (их еще называют биопрепаратами) – бифидо-, лактобактерии и нормальная кишечная палочка, среди которых по многообразию позитивных эффектов лидируют лактобактерии. К этой же группе можно отнести и Bacilliclausii, также являющиеся компонентом нормальной микрофлоры кишечника. Вторая группа – препараты, содержащие другие полезные микроорганизмы, оказывающие позитивное влияние на микробиоценоз кишечника. Среди этих препаратов наиболее распространенными являются Bacillussubtilis (бактисубтил), Saccharomycescerevisiae seu boulardii (энтерол).
Основными показаниями для назначения пробиотиков у детей являются [14]:
– острые кишечные инфекции, особенно вирусные и обусловленные условно-патогенной флорой;
– хронические заболевания ЖКТ, сопровождающиеся ферментативной недостаточностью и дисбактериозом кишечника;
– хронические персистирующие инфекции;
– пищевая аллергия;
– антибиотикоассоциированная диарея.
Врач должен выбирать пробиотик в соответствии со следующими критериями [14]: присутствие в его составе штаммов с доказанной клинической эффективностью; сочетание симбионтных штаммов; кислотоустойчивость; антибиотикоустойчивость; безопасность.
Всем вышеуказанным требованиям отвечает Энтерожермина. Препарат состоит из суспензии спор Bacillusclausii – нормального обитателя кишечника, лишенного патогенного действия, и содержит 4 антибиотикорезистентных (OC, NR, T, SIN) штамма, которые используют в профилактике кишечных расстройств [15]. Споровая форма Bacillusclausii обеспечивает их выживаемость и безопасный транзит по ЖКТ [16]. Прием Энтерожермины способствует восстановлению микробной флоры кишечника, претерпевшей изменения в результате дисбактериоза. В экспериментальном исследовании было показано, что пробиотические штаммы Bacillusclausii обладают антибактериальной активностью против St. aureus и Cl. difficilae, причем ингибировались только грамположительные штаммы, на грибы и грамотрицательные бактерии подавляющего эффекта не было [17]. Штаммы Bacillusclausii имеют доказанный иммуномодулирующий эффект (стимуляция выработки интерферона и пролиферацию CD4 лимфоцитов) [17], оказывают модулирующее действие на аллергиче-ский ответ [18].
Цель настоящего исследования –изучение клинических особенностей дисбактериоза у детей с последующей сравнительной оценкой эффективности применения пробиотиков и биопрепаратов для его коррекции.
В качестве пробиотика мы применяли препарат Энтерожермина, который назначали по 1–2 флакона в день (в зависимости от возраста, детям до 1 года – 1 флакон, старше года – 2) в течение 10 дней 33 пациентам (основная группа) в возрасте от 3 месяцев до 5 лет, обратившихся на амбулаторный прием к гастроэнтерологу в 10 детскую клиническую поликлинику за период с ноября 2009 г. по май 2010 г. Поскольку противопоказания к применению Энтерожермины практически отсутствуют, всем обратившимся был назначен этот препарат, т.е. специального подбора пациентов не было. Это позволило нам не только оценить эффективность его применения, но и сделать некоторые выводы о структуре заболеваний, на фоне которых может развиться дисбактериоз у детей, и особенностях его клинических проявлений. Оценку эффективности использования препарата проводили через 10 дней и 1 месяц от первого дня его назначения по данным анкет, заполнявшихся ежедневно матерями, и по результатам копрологических исследований и проведенных исследований кала на дисбактериоз до и через 1 мес. после назначения Энтерожермины. Через 3 мес. проводился опрос матерей на предмет клинических проявлений дисбактериоза.
Сравнение эффективности применения Энтерожермины проводили с контрольной группой детей в возрасте от 6 месяцев до 2,5 лет (n = 18), проходивших лечение ранее. Эти дети получали в качестве основного лечения биопрепараты – бифидо- или лактобактерии (в зависимости от изменений в бактериограммах кала (10 пациентов) или последующие смеси, содержащие бифидо- и лактобактерии. При изучении данной группы мы проводили оценку основных и сопутствующих диагнозов, основных жалоб пациентов и данных копрограмм и бактерио-грамм кала, выполнявшихся до и через 1 мес. после назначения двухнедельного курса биопрепаратов в возрастной дозировке. Поскольку матери пациентов этой группы не заполняли подробных анкет, отражающих ежедневные жалобы, оценка динамики симптомов у этих детей в полном объеме не проводилась.
Клиническая характеристика основной и контрольной групп оказалась следующей. Средний возраст детей в основной группе составил 13,11 месяцев, в контрольной – 12,72 месяца. Поскольку дисбиотические расстройства, как правило, вторичны и наблюдаются на фоне других заболеваний, являясь чаще всего их следствием, нас интересовали основные диагнозы, которые были выставлены детям обеих групп. Оказалось, что в обеих группах наиболее часто наблюдались различные аллергические заболевания (у 57,57% больных основной и 50% контрольной группы), причем в подавляющем большинстве случаев имел место атопический дерматит, наблюдавшийся у 15 из 19 пациентов c аллергопатологией в первой группе и у 6 из 7 – во второй (рис. 1). Бронхиальная астма, аллергический ринит и рецидивирующая крапивница встречались в обеих группах в единичных случаях. На втором месте по частоте встречались кишечные дисфункции, имевшие место после перенесенных 1–3 мес. назад острых кишечных инфекций, как вирусных, так и бактериальных, или лямблиоза кишечника, составившие 21,21% в основной и 38,89% в контрольной группе. В некоторых случаях явления дисбактериоза наблюдались на фоне функциональных гастроинтестинальных расстройств – дискинезии желчевыводящих путей (ДЖВП), функционального запора, дисфункции кишечника или гастроэзофагеального рефлюкса (ГЭР). В четырех случаях в основной группе и в одном – в группе контроля дисбактериоз наблюдался после антибактериальной терапии. Достаточно часто дисбактериоз был определен после обследования детей с младенческими коликами (15,15 и 38,89% соответственно). Здесь следует подчеркнуть, что при проведении копрологического исследования детям обязательно определяли уровень рН кала с целью исключения транзиторной или вторичной лактазной недостаточности, которая была выявлена в двух случаях при младенческих коликах и в одном – после перенесенной ротавирусной инфекции. Эти дети в группу наблюдения включены не были, поскольку причиной улучшения их самочувствия и исчезновения жалоб было исключение молока из рациона.
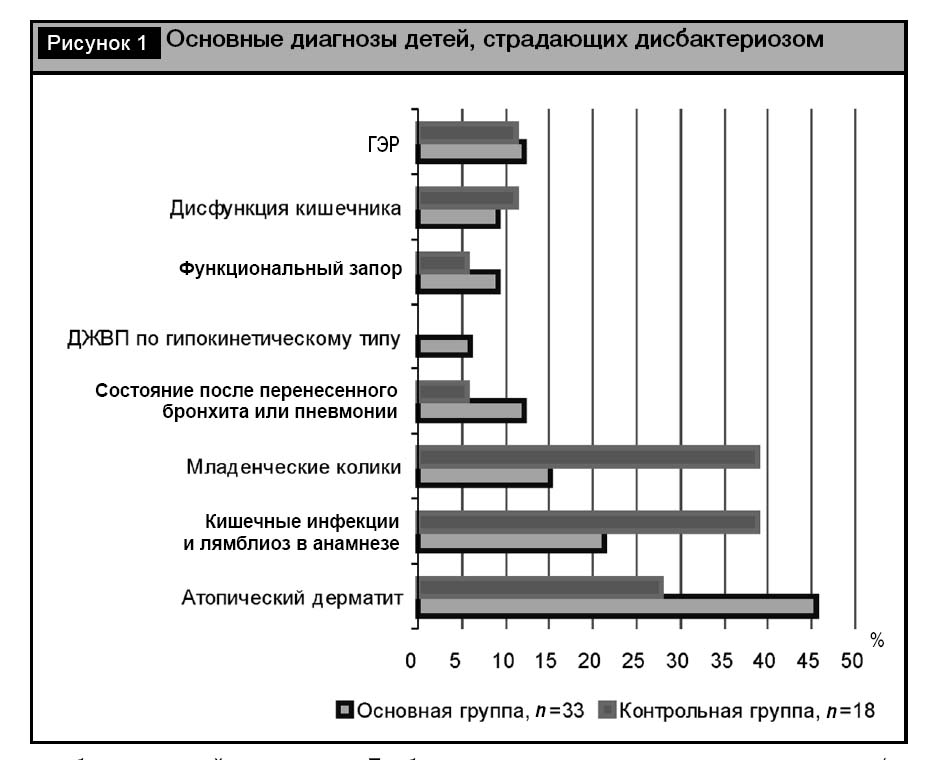
При изучении возможных факторов, предрасполагавших к возникновению дисбактериоза у наших пациентов, мы подвергли подробному анализу акушерский анамнез их матерей. В результате была установлена высокая частота встречаемости воспалительных заболеваний мочеполовой сферы у матерей во время беременности как в основной группе (54,54%), так и в контрольной (66,67%); кесарево сечение имело место в 7 (21,21%) случаях в основной группе и в 2 (11,11%) в контрольной; другие факторы наблюдались в единичных случаях. Из перенесенных до момента взятия под наблюдение заболеваний в обеих группах острые кишечные инфекции были зарегистрированы в 8 (24,24%) случаях в основной группе и в 6 (33,33%) – в группе контроля, острые заболевания верхних дыхательных путей, потребовавшие проведения антибактериальной терапии, – в 10 (30,3%) и 4 (22,22%) случаях соответственно. Остальные заболевания наблюдались редко.
Таким образом, можно утверждать, что факторами риска развития дисбактериоза у детей младшего возраста являются наличие различных воспалительных заболеваний мочеполовой сферы у матерей и кесарева сечения в акушерском анамнезе; перенесенные острые кишечные инфекции; а также повторные заболевания органов дыхания, требовавшие антибактериальной терапии. Дисбиотические расстройства наиболее часто наблюдаются на фоне атопического дерматита, младенческих колик (у детей первого года жизни) и после перенесенных в недавнем времени острых кишечных инфекций.
Существенный интерес для нас представлял анализ частоты встречаемости той или иной формы дисбактериоза. Оказалось, что обратившиеся к гастроэнтерологу дети имели преимущественно вторую его степень (60,6 и 55,56% в основной и контрольной группах соответственно); анаэробный дисбактериоз (со снижением уровня бифидо- и лактобактерий на 2–3 порядка) наблюдался в 21,21 и 16,67% случаев, аэробный (со снижением количества нормальной кишечной палочки) – в 15,15 и 11,11% случаев, смешанный – с такой же частотой, как и аэробный. Следует отметить, что значительно чаще, чем вышеуказанные варианты дисбактериоза, как в основной, так и в контрольной группах, наблюдался дисбактериоз, ассоциированный с условно-патогенной флорой (в 51,51 и 38,89% случаев соответственно), причем не обязательно имело место снижение уровня нормальной микрофлоры. Анализ спектра условно-патогенной флоры показал, что у наших пациентов преобладали стафилококк (47,06 и 71,43% в основной и контрольной группах соответственно), протей (17,64 и 28,57% соответственно), кандиды и их ассоциации.
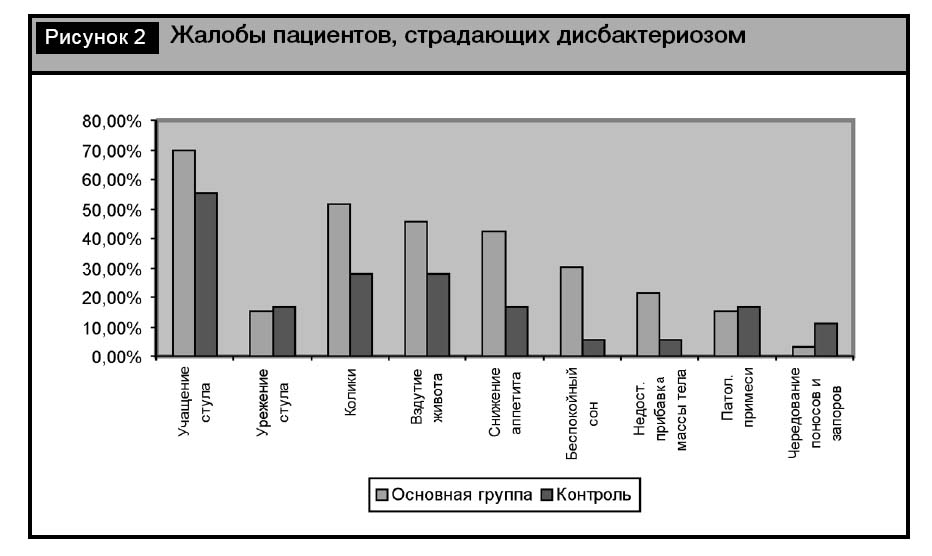
Наиболее частыми жалобами, отражающими клинические проявления дисбактериоза в обеих группах, были учащение стула до 3–5 раз в сутки (у 69,69% пациентов в основной группе и 55,56% в контрольной), колики (в 51,51 и 27,78% случаев соответственно), вздутие живота (у 45,45 и 27,78% больных соответственно) и снижение аппетита (у 42,42 и 16,67% пациентов) (рис. 2). Несколько реже наблюдались урежение стула, беспокойный сон и недостаточная прибавка массы тела. Следует отметить, что некоторая часть основных симптомов встречалась чаще и была более выражена в основной группе, т.е. получить положительный эффект от лечения в ней было сложнее.
Далее нами была проведена оценка динамики клинических проявлений дисбактериоза на фоне лечения пребиотиком Энтерожерминой, а также данных копрологического исследования и бактериограмм до и через 1 мес. после назначения 10-дневного курса этого препарата в сравнении с традиционной коррекцией дисбактериоза биопрепаратами.
Частоту встречаемости жалоб, отражающих клинические проявления кишечной диспепсии, а также частоту и характер стула оценивали в начале исследования, и далее в течение 10 дней применения Энтерожермины, а также через 1 и 3 мес. от начала исследования. Оценка переносимости и клинической эффективности препарата проведена у 30 детей в течение 1 месяца и у 18 – через 3 мес. Анализ данных табл. 1 показывает выраженную эффективность Энтерожермины в отношении купирования схваткообразных болей в животе (р2 < 0,01), и снижения их интенсивности (р2 < 0,001), причем указанные эффекты развивались постепенно. Мы наблюдали также существенное, быстрое и стойкое снижение частоты встречаемости вздутия живота у наших пациентов (р1 и р2 < 0,001). На рис. 3, демонстрирующем динамику различных вариантов частоты стула (от 5–6 раз в сутки до 1 раза в 2–3 дня) на фоне и после лечения Энтерожерминой, хорошо видна отчетливая тенденция к ее нормализации: через 1 мес. у детей преимущественно имел место стул 1–2 или 2–3 раза в сутки.
Таблица 1 Динамика основных симптомов дисбактериоза на фоне и после лечения Энтерожерминой (n = 30)
|
Симптом
|
В начале исследования
|
Через 10 дней после начала исследования
|
Р1
|
Через 1 мес. от начала исследования
|
Р2
|
|
Схваткообразные боли в животе
|
15 (50 ± 9,13%)
|
12 (40 ± 8,94%)
|
–
|
3 (10 ± 5,48%)
|
<0,01
|
|
Интенсивность болей «+»
|
5 (16,67 ± 6,8%)
|
6 (20 ± 7,3%)
|
–
|
3 (10 ± 5,48%)
|
–
|
|
Интенсивность болей «++»
|
10 (33,33 ± 8,61%)
|
6 (20 ± 7,3%)
|
–
|
0
|
<0,001
|
|
Снижение аппетита
|
13 (43,33 ± 9,05%)
|
7 (23,33 ± 7,71%)
|
–
|
7 (23,33 ± 7,71%)
|
–
|
|
Срыгивания
|
3 (10 ± 5,48%)
|
2 (6,67 ± 4,56%)
|
–
|
1 (3,33 ± 3,27%)
|
–
|
|
Вздутие живота
|
14 (46,67 ± 9,11%)
|
4 (13,33 ± 6,21%)
|
<0,001
|
4 (13,33 ± 6,21%)
|
<0,001
|
|
Примесь зелени
|
8 (26,67 ± 8,07%)
|
2 (6,67 ± 4,56%)
|
–
|
2 (6,67 ± 4,56%)
|
–
|
|
Примесь слизи
|
8 (26,67 ± 8,07%)
|
2 (6,67 ± 4,56%)
|
–
|
2 (6,67 ± 4,56%)
|
–
|
|
Примесь крови в кале
|
2 (6,67 ± 4,56%)
|
0
|
–
|
0
|
–
|
Также было установлено, что на фоне лечения Энтерожерминой (вероятно, по мере коррекции имеющихся у пациентов группы наблюдения нарушений биоценоза кишечника) наблюдается снижение частоты встречаемости и существенное (р < 0,05) снижение выраженности проявлений атопического дерматита (рис. 4).
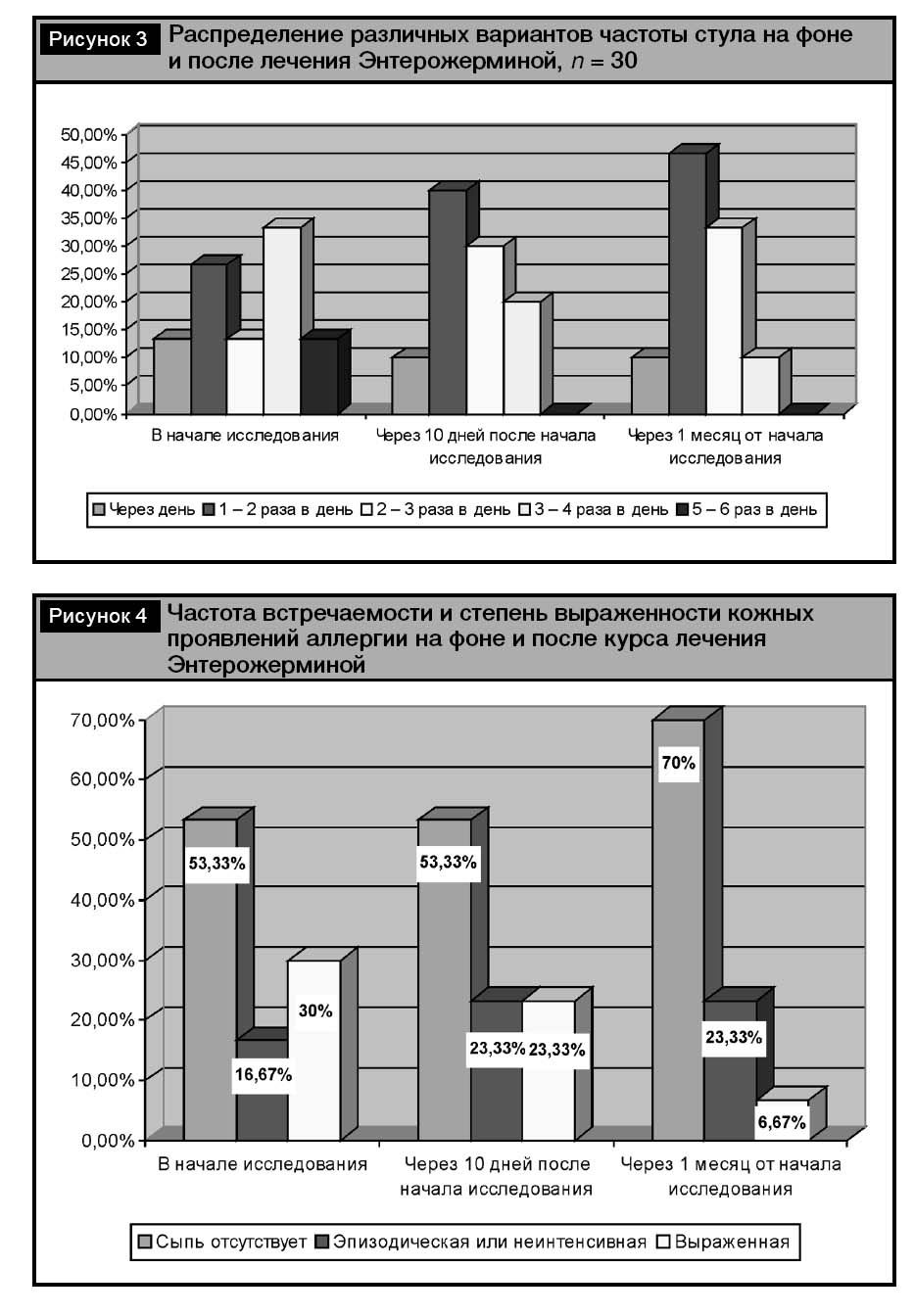
В нашем наблюдении не было зарегистрировано ни одного случая появления каких-либо симптомов, свидетельствующих о непереносимости препарата ни со стороны кожи, ни со стороны ЖКТ.
При уточнении клинических проявлений дисбактериоза у 18 детей через 3 мес. после проведения исследования отсутствие признаков кишечной диспепсии зарегистрировано в 16 (88,9%) случаях. У двоих пациентов имели место повторные выраженные проявления дисбактериоза после проведенной антибактериальной терапии: в одном случае – по поводу бронхита, в другом случае – отита.
При анализе результатов копрологических исследований нас интересовали показатели, отражающие синдром нарушения переваривания компонентов пищи (наличие мышечных волокон, нейтрального жира, жирных кислот и мыл) и синдром дисбактериоза с признаками воспаления в толстой кишке (наличие повышенного содержания переваримой клетчатки, крахмала, йодофильной флоры, лейкоцитов и слизи). Оценку динамики указанных синдромов проводили до и через 1 мес. после назначения 10-дневного курса Энтерожермины (основная группа, n = 32) или двухнедельного курса биопрепаратов (контрольная группа, n = 15).
При изучении частоты встречаемости признаков нарушения переваривания нутриентов установлена лишь тенденция к улучшению переваривания компонентов пищи без достоверных различий до и через 1 мес. после назначения лечения как в основной, так и в контрольной группе. Оценка динамики симптомов, отражающих косвенные признаки дисбактериоза (табл. 2), позволила установить существенное снижение частоты обнаружения йодофильной флоры, повышенного содержания лейкоцитов и слизи в копрограммах через 1 мес. после назначения 10-дневного курса Энтерожермины, тогда как после биопрепаратов наметилась лишь тенденция к снижению частоты встречаемости переваримой клетчатки.
Таблица 2 Динамика копрологических изменений: синдром дисбактериоза и воспаления в толстой кишке
|
Показатель
|
Основная группа, n = 32
|
р
|
Контрольная группа, n = 15
|
р
|
|
до исследоявани
|
через 1 мес. после начала приема Энтерожермины
|
до исследования
|
через 1 мес. после начала приема биопрепаратов
|
|
Переваримая клетчатка, ++, +++
|
14 (44,7 ± 8,79%)
|
7 (21,8 ± 7,31%)
|
|
8 (53,3 ± 12,88%)
|
4 (26,6 ± 11,42%)
|
<0,1
|
|
Крахмал, ++, +++
|
12 (37,5 ± 8,56%)
|
7 (21,8 ± 7,31%)
|
|
8 (53,3 ± 12,88%)
|
5 (33,3 ± 12,17%)
|
–
|
|
Йодофильная флора
|
17 (53,1 ± 8,82%)
|
4 (12,5 ± 5,85%)
|
<0,01
|
7 (46,6 ± 12,88%)
|
5 (33,3 ± 12,17%)
|
–
|
|
Лейкоциты
|
9 (28,1 ± 7,95%)
|
3 (9,38 ± 5,15%)
|
<0,05
|
4 (26,6 ± 11,42%)
|
2 (13,3 ± 8,78%)
|
–
|
|
Слизь
|
7 (21,8 ± 7,31%)
|
0
|
<0,01
|
1 (6,7 ± 6,44%)
|
2 (13,3 ± 8,78%)
|
–
|
Полученные результаты анализа копрограмм позволяют предположить, что назначение как пробиотиков, так и биопрепаратов оказывает позитивное влияние на состояние биоценоза толстой кишки, более выраженное у пробиотика Энтерожермины, однако эти данные требовали уточнения и подтверждения. Поэтому нами был проведен анализ бактериограмм кала в динамике наблюдения у 33 детей основной группы и 15 – контрольной. В результате было установлено, что как после применения Энтерожермины, так и после назначения биопрепаратов имеет место нормализация уровня нормальной микрофлоры, однако влияние пробиотика Энтерожермины оказалось более существенным (р < 0,05 для бифидобактерий, р < 0,01 для лактобацилл и р < 0,01 для нормальной кишечной палочки) и касалось всех компонентов нормальной микрофлоры, т.е. В. clausii в процессе своей жизнедеятельности создают благоприятные условия для восстановления нормофлоры, способствуя росту как анаэробной, так и аэробной нормальной микрофлоры толстой кишки (табл. 3). Поскольку лактобактерии обладают доказанной антагонистической активностью в отношении ряда условно-патогенных микробов, а кишечная палочка, кроме того, имеет хорошо выраженный иммуностимулирующий эффект, можно предположить, что у Энтерожермины, кроме непосредственного влияния на патогенные микроорганизмы, описанного в литературе, будет иметь место и опосредованный (через стимуляцию роста нормофлоры) выраженный эффект как в отношении подавления условно-патогенной кишечной флоры, так и иммуномодуляции.
Таблица 3 Cредние показатели уровня нормальной микрофлоры до и через 1 мес. после назначения лечения в группах наблюдения и контроля
|
Показатель
|
Средняя степень уровня бактерий в 1 г фекалий до лечения
|
Средняя степень уровня бактерий в 1 г фекалий через 1 мес после назначения Энтерожермины
|
Р
|
Средняя степень уровня бактерий в 1 г фекалий до лечения
|
Средняя степень уровня бактерий в 1 г фекалий через 1 мес. после назначения биопрепаратов
|
Р
|
|
Бифидобактерии
|
8,33 ± 0,28
|
9,17 ± 0,14
|
<0,05
|
8,08 ± 0,22
|
8,98 ± 0,15
|
<0,05
|
|
Лактобактерии
|
6,88 ± 0,29
|
7,71 ± 0,14
|
<0,01
|
6,92 ± 0,38
|
7,5 ± 0,15
|
–
|
|
Нормальная
|
7,03 ± 0,33
|
8,03 ± 0,13
|
<0,01
|
7,33 ± 0,45
|
7,41 ± 0,22
|
–
|
|
кишечная палочка
|
|
|
|
|
|
|
При оценке влияния назначенного лечения на показатели условно-патогенной микрофлоры мы анализировали как их средний уровень (табл. 4), так и частоту встречаемости их повышенного уровня (табл. 5) в обеих группах до и после лечения. Установлено, что применение Энтерожермины привело к существенному снижению частоты встречаемости повышенного уровня стафилококков и протея (р < 0,05), а также средней степени уровня протея (р < 0,05). Существенный интерес для нас также представляла частота встречаемости и степень выраженности кандидоза кишечника, поскольку существует мнение, что пробиотики (в частности, сахаромицеты) могут способствовать повышению уровня грибов рода кандида. В нашем исследовании этот факт не получил подтверждения: после курса лечения Энтерожерминой частота встречаемости и степень выраженности кандидоза не повысилась, а имела тенденцию к снижению. Хотя следует отметить более значительную эффективность биопрепаратов в отношении грибковой флоры.
Таблица 4 Cредние показатели уровня условно-патогенной микрофлоры в бактериограммах кала
до и через 1 мес. после назначения Энтерожермины
|
Показатель
|
Средняя степень уровня бактерий в 1 г фекалий до лечения
|
Средняя степень уровня бактерий в 1 г фекалий через 1 мес. после назначения Энтерожермины
|
Р
|
Средняя степень уровня бактерий в 1 г фекалий до лечения
|
Средняя степень уровня бактерий в 1 г фекалий через 1 мес. после на-значения биопрепаратов
|
Р
|
|
Протей
|
4,0 ± 0,62
|
1,33±0,8
|
<0,05
|
3,66±0,54
|
4,0±0,7
|
–
|
|
Стафилококк
|
4,38 ± 0,2
|
3,42 ± 0,25
|
–
|
4,6 ± 0,26
|
4,33 ± 0,33
|
–
|
|
Клебсиелла
|
6,25 ± 1,22
|
5,0 ± 3,24
|
–
|
4,4 ± 1,4
|
4,0 ± 1,7
|
–
|
|
Кандиды
|
3,73 ± 0,3
|
3,17 ± 0,14
|
–
|
4,2 ± 0,43
|
3,2 ± 0,7
|
–
|
|
Клостридии
|
2,44 ± 0,46
|
2,75 ± 0,71
|
–
|
2,0 ± 1,4
|
0
|
–
|
|
Энтеробактер
|
8,6 ± 0,34
|
8,0 ± 1,1
|
–
|
7,25 ± 1,02
|
6,0 ± 0,5
|
–
|
|
Цитробактер
|
6,0 ± 0,88
|
7,0 ± 1,04
|
–
|
0
|
0
|
–
|
|
Энтерококки
|
7,1 ± 0,66
|
5,62 ± 0,87
|
–
|
7,15 ± 1,6
|
6,0 ± 1,6
|
–
|
Таблица 5 Частота обнаружения повышенного уровня условно-патогенной микрофлоры в бактериограммах
кала до и через 1 мес. после назначения Энтерожермины
|
Показатель
|
Частота обнаружения условно-патогенной микрофлоры до лечения
|
Частота обнаружения условно-патогенной микрофлоры через 1 мес. после начала приема Энтерожермины
|
Р
|
Частота обнаружения условно-патогенной микрофлоры до лечения
|
Частота обнаружения условно-патогенной микрофлоры через 1 мес. после начала приема биопрепаратов
|
Р
|
|
Протей
|
5 (15,15 ± 6,24%)
|
0
|
<0,05
|
3 (20 ± 10,33%)
|
1 (6,7 ± 6,44%)
|
–
|
|
Стафилококк
|
21 (63,63 ± 8,37%)
|
14 (42,42 ± 8,6%)
|
<0,05
|
9 (60 ± 12,64%)
|
7(46,7 ± 12,8%)
|
–
|
|
Клебсиелла
|
4 (12,12 ± 5,68%)
|
1 (3,03 ± 2,98%)
|
–
|
4 (26,7 ± 11,4%)
|
3 (30 ± 11,3%)
|
–
|
|
Кандиды
|
9 (27,27 ± 7,75%)
|
6 (18,2 ± 6,71%)
|
–
|
5 (33,3 ± 12,2%)
|
1 (6,7 ± 6,44%)
|
<0,05
|
|
Клостридии
|
2 (6,06 ± 4,15%)
|
1 (3,03 ± 2,98%)
|
–
|
2 (13,33 ± 8,8%)
|
0
|
–
|
Выводы
1. Значимыми факторами риска дисбактериоза у детей младшего возраста в настоящее время являются наличие различных воспалительных заболеваний мочеполовой сферы матерей во время беременности и кесарева сечения в родах; перенесенные острые кишечные инфекции; а также повторные заболевания органов дыхания, требовавшие антибактериальной терапии. Дисбиотические расстройства наиболее часто наблюдаются на фоне атопического дерматита и младенческих колик (у детей первого года жизни).
2. Клиническими проявлениями дисбактериоза являются учащение стула до 3–5 раз в сутки (более чем у половины пациентов), схваткообразные боли в животе или младенческие колики, эпизоды вздутия живота и снижение аппетита.
3. Среди различных вариантов дисбактериоза, требующих коррекции, наиболее часто встречается ассоциированный с условно-патогенной флорой и преобладанием стафилококка (47,06 и 71,43% в основной и контрольной группах соответственно), протея (17,64 и 28,57% соответственно), кандид и их ассоциаций.
4. Оценка особенностей дисбактериоза у детей, обратившихся на амбулаторный прием к гастроэнтерологу, указывает на необходимость применения у них пробиотика с комплексным воздействием на микрофлору (включающим стимуляцию нормофлоры, подавление условно-патогенной, иммуномодулирующий и противоаллергический эффекты), каковым может быть Энтерожермина.
5. Назначение пробиотика Энтерожермины приводит к постепенному и стойкому купированию схваткообразных болей в животе (или снижению их интенсивности), способствует нормализации частоты стула и урежению эпизодов вздутия живота у детей с различными вариантами дисбактериоза.
6. Применение Энтерожермины способствует повышению уровня таких важнейших компонентов нормальной микрофлоры кишечника, как бифидобактерии (р < 0,05), лактобациллы (р < 0,01) и нормальная кишечная палочка (р < 0,01), обладая более выраженным позитивным эффектом, чем биопрепараты, что подтверждается также результатами копрологических исследований.
7. Через 1 месяц после назначения 10-дневного курса Энтерожермины зарегистрировано снижение частоты встречаемости повышенного уровня и средних показателей золотистого стафилококка и протея у детей с ассоциированным дисбактериозом.
8. Препарат обладает хорошей переносимостью и не способствует повышению уровня кандид в бактериограммах кала.
Л И Т Е Р А Т У Р А
1. Хавкин А.И. Нарушения микроэкологии кишечника. Принципы коррекции: метод. рекоменд. – М., 2004. – 40 с.
2. Корниенко Е.А. Актуальные вопросы коррекции кишечной микрофлоры у детей: учеб. пособие. – М., 2006. – 48 с.
3. Ильина Н.О., Мазанкова Л.Н. и др. // Гастроэнтерология. – 2007. – № 1. – С. 32–39.
4. Назаренко О.Н., Твардовский В.И., Дайнович В В., Дечко Е.В. // Актуальные проблемы абдоминальной патологии у детей – 2005: материалы ХII Конгресса детских гастроэнтерологов России. – М., 2005. – С. 324–325.
5. Назаренко О.Н., Твардовский В.И., Рожанец А.Н. и др. // Мед. новости. – 2006. – № 2. – С. 121–129.
6. Михайлов И.Б., Корниенко Е.А. Применение про- и пребиотиков при дисбиозе кишечника у детей: метод. пособие. – СПб., 2004. – 23 с.
7. Пробиотики и пребиотики: Практические рекомендации Всемирной гастоэнтерологической организации. – World Gastroenterology Organisation, 2008. – 24 с.
8. Fuller R. // J. Appl. Bacteril. – 1989. – Vol. 66. – P. 365–378.
9. Kamm M.A. // Eur. J. Surg. – 2001. – Vol. 586, Suppl. – P. 30–33.
10. Ouwehand A., Isolauri E., Salminen S. // Eur. J. Nutr. – 2002. – Vol. 41, suppl. 1. – P. 132–137.
11. Saaverda J. // Am. J. Gastroenterol. – 2000. – Vol. 95, suppl. 1. – P. 16–18.
12. Savino F., Pelle E., Palumeri E. et al. // Pediatrics. – 2007. – Vol. 119. – P. 124–130.
13. Nista E.S. et al. // Aliment. Pharmacol. Ther. – 2004. – Vol. 20. – P. 1181–1188.
14. КорниенкоЕ.А. // Вопр. совр. педиатрии. – 2005. – Т. 4, № 1. – С. 3–6.
15.CiffoF. // Chemioterapia. – 1984. – Vol. 3. – P. 45–52.
16. Ченчи Г., Трота Ф. и др. // Журн. прикладной микробиологии. – 2006. – № 101. – С. 1208–1215.
17. Urdaci M. et al. // J. Clin. Gastroenterol. – 2004. – Vol. 38. – P. 86–90.
18. Ciprandi G., Vizzacaro A. et al. // Allergy. – 2005. – Vol. 60. – P. 702–703.
Медицинские новости. – 2011. – №2. – С. 98–100.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.