|

Шепелькевич А.П., Холодова Е. А., Кравчук В.Г. , Жалейка Е.В., Богомазова Е.В., Толкачев Ю.В.
Эффективность комплексной профилактики диабетической остеопатии у пациентов молодого возраста с сахарным диабетом
1-го типа
Белорусский государственный медицинский университет Республиканский центр медицинской реабилитации 1-я городская клиническая больница г. Минска Республиканская клиническая больница медицинской реабилитации
Изучение особенностей формирования, диагностики и разработки лечебно-профилактических мероприятий при вторичных формах остеопороза, в том числе обусловленных эндокринопатиями, по мнению экспертов ВОЗ, входит в приоритетные научные направления в области остеопороза [1].
Наиболее социально-значимые исходы остеопороза – переломы шейки бедра и позвоночника [2–6]. Результаты эпидемиологических исследований последних лет свидетельствуют о высоком риске переломов осевого скелета у пациентов с сахарным диабетом (СД) 1-го типа [4, 7–14].
Одним из доказанных предикторов остеопоротических переломов является низкая костная плотность [1, 4, 15–18]. Исследования последних лет свидетельствуют о снижении минеральной плотности кости (МПК) более чем у 50% пациентов с сахарным диабетом 1-го типа [19–26]. Разработка комплексных мероприятий по профилактике потерь костной массы у пациентов с СД 1-го типа – актуальная задача современной диабетологии [1, 4, 24–26].
Цель исследования – оценка эффективности комплексной профилактики диабетической остеопатии у пациентов молодого возраста с сахарным диабетом 1-го типа.
Материалы и методы
Клиническое рандомизированное проспективное исследование проводилось на базе кабинета остеопороза отделения эндокринологии УЗ «Республиканская больница медицинской реабилитации», УЗ «1-я городская клиническая больница» г. Минска, ГУ «Республиканский центр медицинской реабилитации и бальнеолечения». В ходе исследования проводилась оценка эффективности комплексной профилактики диабетической остеопатии у 55 пациентов молодого возраста с са 1-го типа.
Критерии исключения из исследования: мужчины старше 45 лет; женщины в возрасте старше 40 лет; женщины в менопаузе; наличие выраженных стадий хронических осложнений сахарного диабета 1-го типа (диабетическая нефропатия с наличием хронической почечной недостаточности, проведение программного гемодиализа, перитонеального диализа; нейропатическая форма синдрома диабетической стопы с остеоартропатией); наличие заболеваний и синдромов, ассоциированных со снижением минеральной плотности кости; прием препаратов, оказывающих влияние на состояние костного метаболизма; женщины в период беременности, лактации.
Проведено комплексное клиническое обследование пациентов с оценкой антропометрических данных (рост, вес, индекс массы тела – ИМТ), анкетирование (оценка питания, наличие нежелательных явлений). В ходе оценки суточного потребления кальция и витамина D с продуктами питания пациент совместно с врачом-исследователем заполнял индивидуальный вопросник «Обследование состояния питания населения Республики Беларусь» (согласно Приложению 2 к приказу Министерства здравоохранения Республики Беларусь от 13 декабря 2000 г. № 580-А), учитывающий прием продуктов питания в течение последних трех суток. Количественный и качественный состав продуктов питания оценивался согласно альбому порций продуктов и блюд.
Биохимический анализ крови (мочевина, креатинин, общий белок, холестерин, триглицериды, общая щелочная фосфатаза (ЩФ), кальций общий (Са общий), фосфор неорганический (Р неорг.) выполнялся на автоматическом многоканальном биохимическом анализаторе HITACHI 911 производства «Roche Diagnostics» (Германия) с использованием реагентов «Cormay» (Польша).
Определение скорости клубочковой фильтрации (СКФ) проводилось по формуле MDRD (the Modification of Diet in Renal Disease) для мужчин и женщин [27].
Оценка компенсации углеводного обмена проводилась на основании данных гликированного гемоглобина (НвА1с). Исследование показателей НвА1с выполнялось методом высокоэффективной жидкостной хроматографии на автоматизированном анализаторе D10 для количественного исследования фракций гемоглобина А1с, А2 и F (США).
Уровни ионизированного кальция (Са2+), оценивались на анализаторе электролитов AVL9180 производства «Roche Diagnostics» (Германия) с использованием реагентов «Roche Diagnostics».
С целью изучения скорости костного обмена оценивались уровни биохимических маркеров костного метаболизма: N-MID остеокальцин, СТX (бета-КроссЛапс) методом иммуноферментного электрохемилюминесцентного анализа на иммуноферментной системе MODULAR E 170 производства «Roсhe Diagnostics» с использованием реагентов «Roсhe Diagnostics».
Исследования проводились на базе клинической диагностической лаборатории Республиканского центра медицинской реабилитации и бальнеолечения.
Состояние минеральной плотности кости оценивалось методом двойной рентгеновской абсорбциометрии осевого скелета на денситометре «Sophos L-XRA» (Франция) в области позвоночника (LII–LIV) и шейки бедра. Исследовались показатели минеральной плотности кости (BMD-bone mineral density), г/см2; Z-критерий (Z-score); Т-критерий (Т-score), %. С целью количественной оценки состояния МПК использовались критерии ISCD, 2007 [1, 2].
Статистическую обработку результатов проводили в программе STATISTICA 6.0. Меры центральной тенденции и рассеяния данных рассчитывали при помощи методов описательной статистики; количественные параметры в зависимости от вида распределения представлены в виде среднего значения (m) и среднего квадратического отклонения (SD), либо в виде медианы (Me) и интерквартильного размаха (LQ–UQ). Анализ соответствия вида распределения признаков закону нормального распределения проводили с использованием критерия Шапиро–Уилка; при p<0,05 распределение признака считали отличающимся от нормального. Критическим уровнем при проверке статистических гипотез принят p<0,05. Для анализа различий подгрупп, выделенных по качественным клинико-диагностическим признакам, использовались непараметрические методы Манна–Уитни, Вилкоксона, Фридмана (ANOVA) и Кендала. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Клиническая характеристика обследованных пациентов с СД 1-го типа, включенных в исследование, представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов с СД 1-го типа, включенных в исследование
|
Параметр
|
Пациенты с СД 1 типа, n=55, m+SD или
Me [LQ–UQ]
|
Критерий
Шапиро–Уилка,
p1
|
|
Возраст, лет
|
26 [24–29]
|
<0,001
|
|
Соотношение мужчин и женщин
|
10/17
|
|
Рост, м
|
1,67 [1,62–1,75]
|
<0,001
|
|
Масса тела, кг
|
63 [58–69]
|
<0,001
|
|
ИМТ, кг/м2
|
22,14 [20,55–24,38]
|
<0,001
|
|
Суточное потребление Са, мг/сут
|
516 [420–603]
|
0,006
|
|
Суточное потребление витамина D, мкг/сут
|
3,2 [2,45–4,23]
|
0,02
|
|
Длительность СД 1-го типа, лет
|
11 [6–14]
|
0,42
|
|
Возраст манифестации СД 1-го типа, лет
|
16 [12–23]
|
<0,001
|
|
Креатинин, мкмоль/л
|
89,47±15,11
|
0,08
|
|
НвА1с,%
|
8,26±0,44
|
0,23
|
|
СКФ, мл/мин
|
81,77 ±31,92
|
0,22
|
|
Са общий, ммоль/л
|
2,22 ±0,11
|
0,43
|
|
Са2++, моль/л
|
1,02 [0,98–1,04]
|
0,009
|
|
Р неорг., ммоль/л
|
1,29 ±0,15
|
0,51
|
|
ЩФ, ЕД/л
|
110,06 ±29,14
|
0,12
|
|
Остеокальцин, нг/мл
|
15,36 [13,23–28,45]
|
<0,001
|
|
бета-СТХ, нг/мл
|
564,25 [542,21–583,14]
|
<0,001
|
|
МПК (LII-LIV): г/см2
Z-критерий
МПК (ШБ): г/см2
Z-критерий
|
0,98±0,088
–1,02±0,71
0,78 [0,7–0,86]
–1,15 ±1,1
|
0,42
0,09
<0,001
0,52
|
Потребление кальция с продуктами питания, по результатам анкетирования, в среднем составило 516 мг/сут, что вдвое ниже рекомендуемых норм потребления кальция для лиц в возрасте до 50 лет [2,4]. Средний показатель потребления витамина D с продуктами питания составил 3,2 мкг при необходимом 5 мкг в сутки [2,4].
Пациенты, включенные в исследование, в ходе первого визита подписывали информированное согласие на участие в исследовании; заполняли индивидуальный вопросник «Обследование состояния питания населения Республики Беларусь»; проходили индивидуальное обучение по вопросам профилактики диабетической остеопатии, включавшее определение возможных причин развития костно-мышечных осложнений диабета, рекомендации по оптимизации инсулинотерапии, самоконтролю, рациональному питанию, комплексу физических упражнений.
С целью оценки эффективности комплексной программы профилактики костных потерь пациенты с СД 1-го типа, включенные в исследование, в ходе рандомизации были разделены на две подгруппы, сопоставимые по возрасту, полу, длительности заболевания, состоянию минеральной плотности кости осевого скелета (табл. 2).
Таблица 2. Клиническая характеристика выделенных подгрупп пациентов с СД 1-го типа
|
Параметр
|
I подгруппа, n=28 Me [LQ–UQ
|
II подгруппа, n=27
Me [LQ–UQ]
|
U тест
Манна–Уитни
|
|
Клинико-анамнестические параметры
|
|
Возраст, лет
|
27,5 [25–31,5]
|
24 [23–28]
|
0,09
|
|
Соотношение мужчин и
женщин
|
9/19
|
10/17
|
|
|
Рост, м
|
1,67 [1,61–1,79]
|
1,67 [1,62–1,7]
|
0,45
|
|
Масса тела, кг
|
63 [57–72,5]
|
63 [58–67]
|
0,66
|
|
ИМТ, кг/м2
|
21,78 [20,37–24,17]
|
22,39 [20,55–24,46]
|
0,87
|
|
Суточное потребление Са,
мг/сут
|
525 [428–630]
|
465 [365–560]
|
0,09
|
|
Суточное потребление
витамина D, мкг/сут
|
3,45 [2,5–4,94]
|
2,86 [2,35–3,6]
|
0,23
|
|
Длительность СД 1-го типа, лет
|
11 [8–16]
|
8 [5–12]
|
0,08
|
|
Возраст манифестации
СД 1-го типа, лет
|
16 [12–23]
|
16,5 [13–23,5]
|
0,79
|
|
Лабораторные параметры
|
|
НвА1с,%
|
8,4 [7,96–8,46]
|
8,26 [7,96–8,45]
|
0,63
|
|
СКФ, мл/мин
|
91,08 [67,16–115]
|
68,3 [43,4–115]
|
0,77
|
|
Креатинин, мкмоль/л
|
89,0 [79–100]
|
90,5 [76–103]
|
0,92
|
|
Са общий, ммоль/л
|
2,21 [2,13–2,29]
|
2,23 [2,15–2,31]
|
0,61
|
|
Са2++, моль/л
|
1,01 [0,97–1,04]
|
1,02 [0,98–1,04]
|
0,58
|
|
Р неорг., моль/л
|
1,3 [1,21–1,34]
|
1,29 [1,21–1,39]
|
0,78
|
|
ЩФ, ЕД/л
|
110,5 [86–132]
|
107 [89–126]
|
0,98
|
|
Остеокальцин, нг/мл
|
15,8 [13,23–25,56]
|
15,23 [13,24–29,56]
|
0,61
|
|
бета-СТХ, нг/мл
|
562,24
[523,32–586,54]
|
564,53
[546,28–580,15]
|
0,46
|
|
Инструментальные параметры
|
|
МПК (LII-LIV):
г/см2
Z-критерий
|
0,97 [0,91–1,01]
–1,06 [–1,46/–0,88]
|
0,97 [0,94–1,04]
–1,16 [–1,33/–0,59]
|
0,48
0,57
|
|
МПК (ШБ):
г/см2
Z-критерий
|
0,77 [0,71–0,86]
–1,23 [–1,89/–0,21]
|
0,79 [0,7–0,87]
–1,21 [–1,71/–0,65]
|
0,52
0,91
|
Пациентам I подгруппы дополнительно давались пояснения по режиму приема комбинированного препарата карбоната кальция (500 мг/сут) и холекальциферола (витамин D – 400 МЕ/сут) в течение 12 месяцев.
Во время 2-го и 3-го визитов пациенты заполняли индивидуальный вопросник «Обследование состояния питания населения Республики Беларусь» и анкету по оценке наличия нежелательных явлений.
Кроме того, в качестве контрольных параметров для оценки эффективности профилактических мероприятий в обеих подгруппах исследовались: состояние минеральной плотности кости осевого скелета (LII-LIV и шейки бедра) через 12 месяцев; лабораторные показатели: содержание Са общего, Са ионизированного, Р неорганического, ЩФ общей, остеокальцина, -СТХ (-КроссЛапс) через 6 и 12 месяцев наблюдения.
Динамика показателей потребления кальция и витамина D с продуктами питания у пациентов I и II подгрупп с СД 1-го типа через 6 и 12 месяцев представлена на рис. 1–4.
Полученные данные свидетельствуют об увеличении суточного потребления продуктов, содержащих кальций и витамин D, в обеих выделенных подгруппах через 6 и 12 месяцев, однако оно ниже рекомендуемых для лиц молодого возраста норм.
Кроме того, при проведении сравнительного анализа суточного потребления кальция (500,0 [410,0–600,0] vs 530,0 [440,0–645,0], Р=0,13) и витамина D (3,6 [3,0–4,0] vs 3,65 [2,9–5,05], P=0,69) между показателями I и II подгрупп через 12 месяцев наблюдения достоверных различий не выявлено (рис. 5, 6).
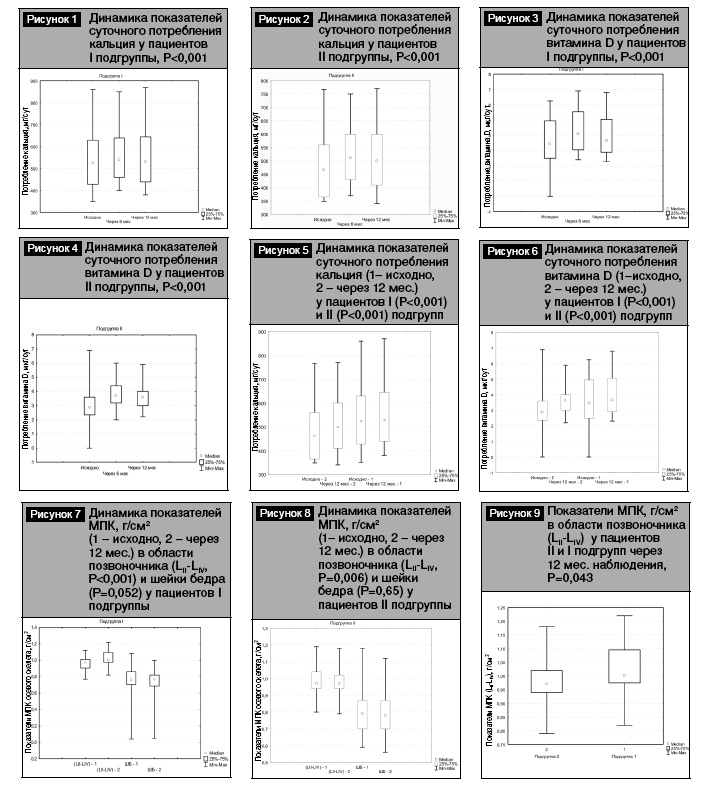
Таким образом, результаты оценки суточного потребления кальция и витамина D с продуктами питания свидетельствуют о его повышении в ходе исследования, не достигающем, однако, рекомендуемых для лиц молодого возраста норм.
Анализ нежелательных явлений. В ходе второго визита жаловались на диспепсию два пациента, на запоры – один из I подгруппы. Во II подгруппе отмечены жалобы на диспепсию у одного пациента, на запоры – у двух, на метеоризм – у одного пациента. В ходе третьего визита жаловались на диспепсию один пациент (во время второго визита данные жалобы отсутствовали) из I подгруппы и на метеоризм – один пациент из II подгруппы. Ни один из пациентов досрочно не вышел из исследования.
Полученные результаты анкетирования наличия нежелательных явлений подтверждают хорошую переносимость комбинированного лекарственного средства карбоната кальция 500 мг и холекальциферола 400 МЕ у пациентов с СД 1-го типа.
Динамика показателей минеральной плотности кости осевого скелета (на основании критерия Вилкоксона) у пациентов выделенных подгрупп с сахарным диабетом 1-го типа представлена на рис. 7, 8.
Отмечено повышение показателя минеральной плотности кости в области позвоночника (LII-LIV, 0,97 [0,91–1,01] vs 1 [0,97–1,1], Р<0,001) у пациентов I подгруппы, а во II подгруппе выявлено снижение данного показателя в динамике (0,97 [0,94–1,04] vs 0,97 [0,94–1,02], Р=0,006). Данные минеральной плотности кости в области шейки бедра исходно и через 12 месяцев наблюдения не имели достоверных различий как в I, так и во II подгруппе пациентов.
При сравнении показателей минеральной плотности кости осевого скелета I и II подгрупп через 12 месяцев наблюдения выявлены достоверно более низкие показатели в области позвоночника (LII-LIV) у пациентов II подгруппы (1,0 [0,97–1,1] vs 0,97 [0,94–1,02], Р=0,043) (рис. 9).
Таким образом, результаты динамического наблюдения параметров МПК осевого скелета свидетельствуют об увеличении костной массы в области позвоночника у пациентов молодого возраста с сахарным диабетом 1-го типа и начальной стадией снижения костной плотности, выполнявших комплекс немедикаментозных профилактических мероприятий и принимавших комбинированное лекарственное средство карбонат кальция 500 мг и 400 МЕ витамина D3 (холекальциферола) в сутки в течение 12 месяцев. В то же время отмечена недостаточная эффективность немедикаментозных методов профилактики для предотвращения потерь костной плотности у пациентов молодого возраста с СД 1-го типа.
Динамика показателей фосфорно-кальциевого обмена и костных маркеров представлена в табл. 3.
Таблица 3. Динамика показателей фосфорно-кальциевого обмена и костных маркерову пациентов выделенных подгрупп
|
Параметр
|
Исходно
|
Через 6 мес
|
Через 12 мес
|
|
Подгруппа I,
|
Подгруппа II,
|
Р1
|
Подгруппа I,
|
Подгруппа II,
|
Р2
|
Подгруппа I,
|
Подгруппа II,
|
Р3
|
|
n=28
|
n=27
|
n=28
|
n=27
|
n=28
|
n=27
|
|
Са общий,
моль/л
|
2,21
[2,13–
2,29]
|
2,23
[2,15–
2,31]
|
0,61
|
2,25
[2,17–
2,31
|
2,2
[2,18–
2,26]
|
0,16
|
2,36
[2,27–
2,44]
|
2,23
[2,15–
2,3]
|
<0,001
|
|
Са2++,
ммоль/л
|
1,01
[0,97–
1,04]
|
1,02
[0,98–
1,04]
|
0,58
|
1,05
[1,02–
1,1]
|
1,02
[1–
1,05]
|
0,01
|
1,1
[1,1–
1,12]
|
1,02
[0,99–
1,05]
|
<0,001
|
|
Р неорг.,
моль/л
|
1,3
[1,21–
1,34]
|
1,29
[1,21–
1,39]
|
0,65
|
1,29
[1,18–
1,32]
|
1,3
[1,23–
1,36]
|
0,39
|
1,29
[1,22–
1,32]
|
1,31
[1,24–
1,37]
|
0,49
|
|
ЩФ, ЕД/л
|
110,5
[86–
132,0]
|
107,0
[89,0–
126,0]
|
0,98
|
112,5
[90,0–
136,0]
|
102,5
[90,0–
120,0]
|
0,58
|
112,5
[89,0–
132,0]
|
110
[90,0–
121,0]
|
0,85
|
|
Остео-
кальцин,
нг/мл
|
15,8
[13,23–
25,56]
|
15,23
[13,24–
29,56]
|
0,61
|
16,88
[14,61–
27,33]
|
14,35
[12,56–
28,45]
|
0,83
|
16,29
[13,22–
25,84]
|
14,9
[13,0–
29,12]
|
0,82
|
|
бета-СТХ, нг/мл
|
562,24
[523,32–
586,54]
|
564,53
[546,48–
580,15]
|
0,46
|
544,56
[520,23–
576,18]
|
568,78
[540,36–
581,34]
|
0,06
|
536,96
[517,74–
566,52]
|
565,87
[543,4–
577,23]
|
0,02
|
P1 – достоверность различий параметров I и II подгрупп исходно
P2 – достоверность различий параметров I и II подгрупп через 6 мес.
P3 – достоверность различий параметров I и II подгрупп через 12 мес.
На рис. 10, 11 отражена динамика содержания Са общего у пациентов I и II подгрупп.
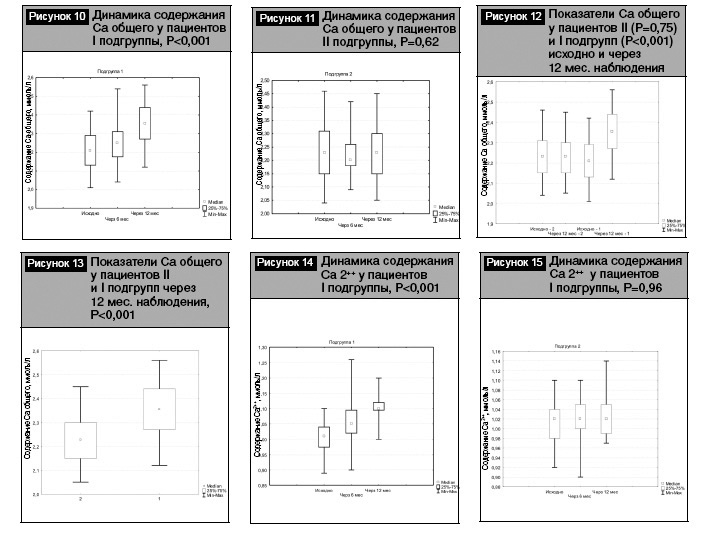
На рис. 12 представлены результаты сравнения содержания Са общего у пациентов I и II подгрупп исходно и через 12 месяцев наблюдения. Полученные данные свидетельствуют о наличии достоверного повышения уровня Са общего у пациентов I подгруппы (2,36 [2,27–2,44] vs 2,23 [2,15–2,3], Р<0,001).
На рис. 13 приведены результаты сравнительного анализа содержания Са общего у пациентов I и II подгрупп через 12 месяцев наблюдения, которые свидетельствуют о наличии более высокого уровня данного показателя в I подгруппе (2,36 [2,27–2,44] vs 2,23 [2,15–2,3], Р<0,001).
Аналогичные тенденции выявлены при оценке динамики содержания Са ионизированного у обследованных пациентов (рис. 14–17):
Данные динамического изменения содержания маркера костной резорбции бета-СТХ у пациентов I и II подгрупп представлены на рис. 18, 19.
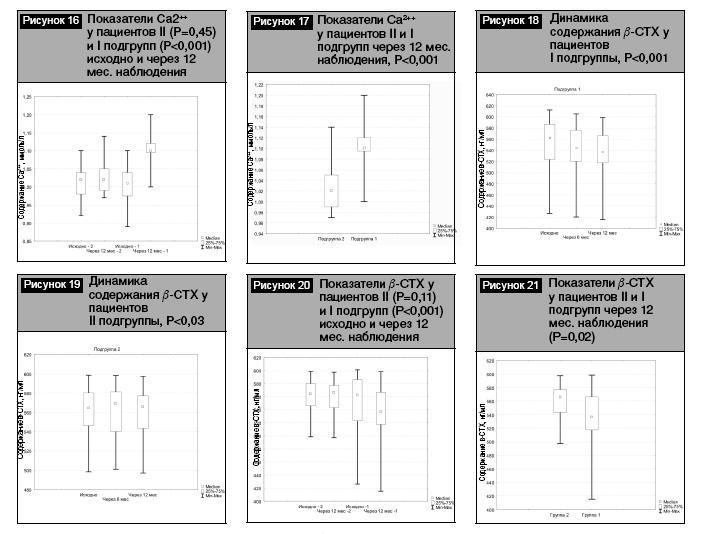
Сравнительный анализ показателей содержания бета-СТХ у пациентов I и II подгрупп исходно и через 12 мес наблюдения выявил наличие достоверного снижения у пациентов I подгруппы (536,96 [517,74-566,52] vs 565,87 [543,4-577,23], Р<0,001) (рис. 20). Кроме того, отмечено наличие более низкого содержания бета-СТХ у пациентов I подгруппы через 12 месяцев наблюдения в сравнении с пациентами II подгруппы (536,96 [517,74-566,52] vs 565,87 [543,4-577,23], Р=0,02) (бета-СТХ рис. 21):
Таким образом, полученные результаты свидетельствуют о повышении содержания Са общего и ионизированного, а также о снижении содержания бета-СТХ у пациентов I подгруппы, выполнявших комплексную профилактику, включавшую немедикаментозные и медикаментозные мероприятия. У пациентов II подгруппы содержание Са общего и ионизированного, бета-СТХ не отличалось от исходных данных.
Результаты проведенного проспективного клинического исследования свидетельствуют об эффективности комплексной профилактики диабетической остеопатии, включавшей выполнение немедикаментозных мероприятий и применение комбинированного лекарственного средства карбонат кальция 500 мг и витамин D3 (холекальциферол) 400 МЕ в сутки в течение 12 месяцев, у пациентов молодого возраста с СД 1-го типа и начальной стадией снижения костной плотности. Эффективность комплексной профилактики диабетической остеопатии подтверждена результатами динамического наблюдения параметров МПК осевого скелета, свидетельствующими о повышении костной массы в области позвоночника; лабораторных параметров – выявлено повышение содержания кальция общего и ионизированного, а также снижение содержания маркера костной резорбции бета-СТХ. В то же время отмечена недостаточная эффективность немедикаментозных методов профилактики для предотвращения потерь костной плотности у пациентов молодого возраста с СД 1-го типа.
Л И Т Е Р А Т У Р А
1. Kanis, J.A. Assessment of osteoporosis at the primary health-care level / J.A. Kanis on behalf of the World Health Organization Scientific Group – University of Sheffield, United Kindom, 2007. – 287 p.
2. Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение /Л.И. Беневоленская [и др.]; под общ. ред. Л.И. Беневоленской, О.М. Лесняк. – М.: ГЭОТАР-Медиа, 2009. – 272 с.
3. Руденко, Э.В. Остеопороз. Диагностика, лечение и профилактика / Э.В. Руденко. – Минск, “Белорусская наука”, 2001. – 153 с.
4. Холодова, Е.А. Эндокринные остеопатии: особенности патогенеза, диагностики и лечения: Практ. рук. для врачей / Е.А. Холодова, А.П. Шепелькевич, З.В. Забаровская – Минск: Белпринт, 2006. - 88 с.
5. Некрасова, М.Р. Предикторы развития остеопении при сахарном диабете 1 типа /М.Р. Некрасова, Л.А. Суплотова // Сахарный диабет. – 2006. – № 1. – С. 58 –61.
6. The Living Skeleton / Edit. C.Roux. – Wolters Kluwer Health France, 2007. – 113 p.
7. Strotmeyer, E.S. Middle-aged premenopausal women with type 1 diabetes have lower bone mineral density and calcaneal quantitative ultrasound than nondiabetic women / Elsa S. Strotmeyer [et al.] // Diabetes Care. – 2006. – Vol.29, №2. – P. 306 –311.
8. Некрасова, М.Р. Предикторы развития остеопении при сахарном диабете 1 типа /М.Р. Некрасова, Л.А. Суплотова // Сахарный диабет. – 2006. – № 1. – С. 58 –61.
9. Kemink, S.A. Osteopenia in insulin-dependent diabetes mellitus; prevalence and aspects of pathophysiology / S.A. Kemink [et al.] // J. Endocrinol. Invest. – 2000. – Vol.23, №5 – P. 295 –303.
10. Alexopoulou, O. Bone density and markers of bone remodeling in type 1 male diabetic patients / O. Alexopoulou [et al.] // Diabetes Metab. – 2006. – Vol.32, №5, Pt. 1 – P.453 –458.
11. Nicodemus, K.K. Type 1 and type 2 diabetes and incident hip fractures in postmenopausal women / K.K. Nicodemus, A.R. Folsom // Diabetes Care. – 2001. – Vol.24, №7. – P.1192 –1197.
12. Miao, J. Elevated Hip Fracture Risk Type 1 Diabetes Patients // J. Miao [et al.] // Diabetes Care. – 2005. – № 28. – P. 2850 –2855.
13. Brown, S.A. Osteoporosis: an under-appreciated complication of diabetes / Sue A. Brown, Julie L. Sharpless // Clin. Diabetes. – 2004. – № 22. – P.10 –20.
14. Белых, О.А. Состояние кальций-фосфорного обмена у больных сахарным диабетом 1 типа / О.А. Белых, Е.А. Кочеткова // Остеопороз и остеопатии. – 2005. – № 1. – С. 12 –15.
15. Kemmis, K. Diabetes and osteporotic fractures / K. Kemmis, D. Stuber // The Diabetes Educator. – 2005. – Vol. 31, № 2. – P. 187 –196.
16. Jehke, P.M. Serum level of insulin-like growth factor sustem components and relationship to bone metabolism in type 1 and type 2 diabetes mellitus patient / P.M. Jehke [et al.]// J. Endocrinol. – 1998. – Vol.159. – P. 297 –306.
17. Valerio, G. The lumbar bone mineral density is affected by long-term poor metabolic control in adolescents with type 1 diabetes mellitus / G.Valerio [et al.] // Horm. Res. – 2002. – Vol.58. – P. 266 –272.
18. Ivers, R.Q. Diabetes and risk of fracture: the Blue Montains Eye Study / R.Q. Ivers [et al.] // Diabetes Care. – 2001. – Vol.24. – P.1198 –1203.
19. Gunczker, P. Decreased bone mineral density and bone formation markers shortly after diagnosis of clinical type 1 diabetes mellitus / P. Gunczker [et al.] // J. Pediatr. Endocrinol. Metab. – 2001. – Vol. 14. – P. 525 –528.
20. Lunt, H. A popopulation-based study of bone mineral density in women with longstanding type 1 (insulin dependent) diabetes / H. Lunt [et al.] // Diabetes Res. Clin. Pract. – 1998. – Vol.40. – P.31 –38.
21. Chau, D.L. Osteoporosis and diabetes /Diane L. Chau, Steven V. Edelman// Clin. Diabetes. – 2002. – Vol.20, № 3. – P. 153 –157.
22. Marshall, D. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures / D. Marshall, O. Johnell, H. Wedel // BMJ – 1996. – Vol.312. – P. 1254 –1259.
23. Rakic, V. Bone mineral density and its determinants in diabetes: the Fremantle Diabetes Study / V. Ragic [et al.] // Diabetologia. – 2006. – № 49. – P. 863 –871.
24. Hamilton, E.J. Prevalence and predictors of osteopenia and osteoporosis in adults with Type 1 diabetes / E.J. Hamilton [et al.] // Diabetic Medicine. – 2008. – Vol. 26, Is.1. – P. 45 – 52.
25. Danielson, K.K. Poor glycemic control is associated with low BMD detected in premenopausal women with type 1 diabetes / K.K. Danielson // Osteoporosis International. – 2008 . – Vol. 19.
26. Vestergaard, P. Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes - a meta-analysis / P. Vestergaard // Osteoporosis International. – 2007. – Vol.18, № 4. – P. 427 –444.
27. Stevens, L.A., Levey, A.S. Frequently Asked Questions about GFR estimates /L.A. Stevens, A.S. Levey// National Kidney Foundation, 2007.
Медицинские новости. – 2010. – №12. – С. 78–84.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|