Список сокращений, использованных в статье: АД – артериальное давление; ИБС – ишемическая болезнь сердца; ЭД – эректильная дисфункция; иАПФ – ингибитор ангиотензипревращающего фермента; иФДЭ-5 – ингибитор фосфодиэстеразы-5; ЛПВП – липопротеиды высокой плотности; ЛПНП – липопротеиды низкой плотности; NO – оксид азота; ССЗ – сердечно-сосудистое заболевание; цГМФ – циклический гуанозинмонофосфат.
Артериальная гипертензия (АГ) диагностируется более чем у четверти взрослого населения Европы. Проблема АГ признана глобальной эпидемией, приводящей к ССЗ и смертности. Сегодня глобальные изменения в улучшении медицинской помощи населению расширили возможности медиков от лечения жизнеугрожающих состояний до внимания к состояниям, снижающим качество жизни. Таким образом, проблема сексуальной дисфункции, которая столетиями оставалась в тени, привлекла к себе большой научный интерес, и это оказало громадное влияние на улучшение качества жизни пациентов-мужчин и их любимых. У человека нет той границы возраста, когда сексуальная активность может и должна закончиться, и с увеличением продолжительности жизни человечества нормальная сексуальная функция становится важным аспектом.
Если ранее ЭД ранее считалась психологической проблемой, то в настоящее время общепризнано, что ЭД это, в первую очередь, заболевание сосудистой природы. Благодаря медикализации и широкому освещению в средствах массовой информации, проблема ЭД в течение последних 5 лет по ряду причин интересует уже не только урологов или сексологов, но и кардиологов. Первая причина изучение сердечно-сосудистой безопасности уникальной группы препаратов для лечения ЭД иФДЭ5 после ошеломляющего для всего мира появления в 1998 г. первого представителя этого класса виагры, силденафила компании «Pfizer». Вторая тесная взаимосвязь ЭД и основных сердечно-сосудистых факторов риска. Третья наблюдение кардиологов, что ЭД может быть ранним маркером для выявления пациентов с безболевой ишемией миокарда и ИБС. Четвертая: ЭД может быть обусловлена необдуманно назначенной врачом фармакотерапией для лечения сопутствующих заболеваний.
Действительно, открытие, сделанное более 10 лет тому назад, заставило заговорить о себе все без исключения средства массовой информации. Речь идет о появлении виагры – принципиально нового средства борьбы с вековой проблемой рода человеческого – половым бемссилием. В 1998 г. R. Furchgott, F. Muerada, L. Ignarro стали лауреатами Нобелевской премии по медицине и физиологии за работу «Монооксид азота как сигнальная молекула в сердечно-сосудистой системе». Они доказали, что молекула NO и является тем самым эндотелиальным релаксирующим фактором, который долго не удавалось выявить исследователям. На основании полученных в ходе этого исследования данных была предпринята попытка синтезировать принципиально новое лекарственное вещество, которое могло бы улучшать кровоснабжение миокарда и снижать тонус периферических кровеносных сосудов, регулируя тем самым АД. В результате работы вышеуказанного коллектива ученых на свет появилось соединение – силденафила цитрат. Оказалось, что вновь синтезированное вещество действительно в некоторой степени расширяет периферические сосуды и улучшает кровоснабжение самого сердца. Но в гораздо большей степени (и это было неожиданно) новое соединение подействовало на кровоснабжение совсем другого органа. Силденафил, безусловно, перевернул представления о фармакотерапии вообще и о лечении ЭД в частности. Препарат виагра (силденафил, Pfizer) при приеме внутрь оказывает не столько системное, сколько локальное действие, воздействуя на гемодинамику пещеристых тел пениса.
Виагра стала родоначальницей нового фармакологического класса – иФДЭ-5. Фермент фосфодиэстераза 5 типа присутствует преимущественно в пещеристых телах полового члена, а также на поверхности тромбоцитов, в скелетных мышцах, гладкой мускулатуре сосудов и внутренних органов [1]. Позднее было показано, что существует несколько подтипов фермента ФДЭ разнонаправленного действия. Силденафил, варденафил и тадалафил являются селективными конкурентными пятого подтипа иФДЭ. Препараты этого класса обладают единым механизмом действия, и, соответственно, единым противопоказанием. Они селективно блокируют разрушение цГМФ, обусловленное ФДЭ-5, и ликвидируют дефицит NO, который необходим для возникновения и поддержания эрекции, достаточной для успешного полового акта. Структурные различия между молекулами определяют их различия в фармакокинетике и степени проявления побочных эффектов.
Последнее десятилетие ознаменовалось интенсивным изучением иФДЭ-5 в пульмонологии, кардиологии, гастроэнтерологии, гинекологии и других смежных специальностях [2–4]. Исследования показали, что силденафил имеет определенные преимущества перед другими препаратами в лечении больных легочной АГ [5–9]. Он уменьшает давление в легочной артерии, легочное сосудистое сопротивление. В последние годы доказана антиишемическая эффективность иФДЭ-5, способность вызывать обратное развитие гипертрофии миокарда у больных артериальной гипертензией [10, 11], оказывать кардиопротективный эффект [57] и замедлять апоптоз в сердечной мышце [12, 13].
У пациентов с ССЗ следует учитывать особенность действия иФДЭ-5 – незначительное вазодилататорное действие. Прием силденафила в максимальной дозе 100 мг снижает систолическое АД максимально не более чем на 8 мм рт. ст., диастолическое – на 5,3 мм рт. ст. [14]. Более того, подобное мягкое вазодилататорное действие силденафила может улучшать эластичность артериальной стенки и состояние эндотелия сосудов [15]. На фоне гипотензивной терапии частота развития побочных эффектов, связанных со снижением АД (головокружение, обмороки), при приеме виагры не увеличивается.
В связи с данной особенностью прием всех трех иФДЭ-5 – силденафила, тадалафила и варденафила – противопоказан пациентам, принимающим нитраты в любой форме, из-за увеличения риска развития тяжелой артериальной гипотензии. Если у мужчины, принявшего иФДЭ-5, развился инфаркт миокарда или приступ стенокардии, то нитроглицерин ему можно назначить спустя 24 ч после приема силденафила и варденафила, и только спустя 48 ч после тадалафила [16]. В таком случае могут быть применены любые другие доступные виды противоишемического лечения (тромболизис, чрескожное коронарное интервенционное вмешательство, аспирин и другие антитромбоцитарные препараты, морфин, кислород, β-блокаторы, антагонисты кальция, статины), поскольку они не противопоказаны.
Прием виагры (силденафила, Pfizer) не влияет на сердечный выброс и частоту сердечных сокращений. При проведении стресс-ЭхоКГ у больных (средний возраст – 66 лет) с эректильной дисфункцией и доказанной ишемической болезнью сердца на фоне терапии силденафилом частота пульса, при которой развивалась ишемия и выраженность аномалий движения стенки левого желудочка, не отличались от показателей в контрольной группе. Прием силденафила приводил к улучшению (примерно на 13%) индуцированного аденозином резерва коронарного кровотока (как в стенозированных, так и в интактных артериях) [17].
При назначении следует учитывать, что силденафил принимается внутрь в индивидуально подобранной дозе (терапевтический диапазон 25–100 мг) примерно за час до предполагаемого сексуального контакта. Обычная доза приема – 50 мг, оптимальная – 100 мг, силденафил можно принимать каждый день. Действие начинается через 30–60 мин после приема, возможность развития эрекции сохраняется в течение 4–6 ч. В то же время показано, что после приема натощак действие виагры начиналось уже через 14 мин (у большинства – менее чем через 30 мин) [18], и даже спустя 12 ч после приема таблетки виагры в ответ на сексуальную стимуляцию возникала эрекция [19].
Эффективность применения виагры при ЭД различного генеза и степени тяжести составляет от 62% (доза 25 мг) до 82% (доза 100 мг) по сравнению с 25% эффекта в группе плацебо [17]. У пациентов с ССЗ эффективность применения иФДЭ-5, по данным разных авторов, колеблется от 50 до 70%. В исследовании R. Feldman и соавт. [20] среди больных, принимавших виагру и антигипертензивное лечение, 70% отметили улучшение эрекции по сравнению с 21% из группы пациентов, принимавших антигипертензивное лечение и плацебо (p< 0,0001). Среди пациентов-гипертоников, принимавших только виагру без антигипертензивного лечения, 72% отметили улучшение эрекции.
По данным эпидемиологических исследований, иФДЭ-5 не оказывают неблагоприятного влияния на выживаемость больных ИБС. В плацебоконтролируемых исследованиях частота инфаркта миокарда и смертность от ССЗ у пациентов, принимавших силденафил, составляет 0,91 и 0,84 на 100 человеко-лет соответственно. Относительный риск указанных неблагоприятных исходов для силденафила по сравнению с плацебо составил 1,08 [21]. Хотя ежедневный прием препарата считается вполне допустимым, больным с ишемической болезнью сердца не следует использовать его чаще двух раз в неделю, поскольку занятия сексом относятся к умеренной физической нагрузке.
Американский колледж кардиологов и Американская ассоциация сердца опубликовали совместные Рекомендации по применению иФДЭ-5 у мужчин с эректильной дисфункцией и сопутствующими ССЗ, в которых рекомендовали соблюдать осторожность у больных с активной ишемией миокарда и ИБС при наличии тенденции к снижению объема циркулирующей крови или АД.
Следует отметить, что эффективность и переносимость силденафила не меняется на фоне сопутствующей антигипертензивной терапии, в том числе и комбинированной [22]. В ряде работ показана безопасность сочетания иФДЭ-5 с амлодипином в дозе 5 мг/сут, метопрололом в дозе 25–200 мг/сут, эналаприлом в дозе 10–20 мг/сут, лозартаном в дозе 25–50 мг/сут. Исключение составляют β-адреноблокаторы, назначение которых вместе с иФДЭ-5 может привести к ортостатической гипотензии [22]. Поэтому, согласно последним рекомендациям регуляторных органов, пациентам, уже принимающим β-адреноблокаторы, иФДЭ-5 следует назначать в наименьшей начальной дозе. И наоборот, наименьшие начальные дозы β-адреноблокаторов следует назначать мужчинам, уже принимающим оптимальные дозы иФДЭ-5. Кроме того, следует избегать злоупотребления алкоголем перед приемом иФДЭ-5, учитывая негативное влияние алкоголя в больших дозах на эрекцию в целом. Умеренные дозы алкоголя не влияют на эффективность виагры. При приеме силденафила наблюдаются незначительные преходящие побочные эффекты: головная боль, покраснение лица, гиперемия и заложенность носа, снижение остроты зрения [23].
У большинства мужчин одна из главных причин расстройства эрекции – сосудистые заболевания. Почти во всех эпидемиологических исследованиях, посвященных эректильной дисфункции, выявлена связь ее возникновения с артериальной гипертензией и атеросклерозом. По мнению авторов, ЭД у пациента может свидетельствовать о наличии у него одного из этих заболеваний в скрытой форме [24]. Эпидемиологическая взаимосвязь ЭД и факторов риска развития ССЗ была впервые доказана известным Массачусетским исследованием (Massachusetts Male Aging Study). Это было наблюдательное проспективное исследование 1709 мужчин в возрасте 40–70 лет. Связь ЭД с ССЗ была гораздо выше, чем можно было бы ожидать от зависимости выявления ЭД только от возраста и пола. Частота встречаемости эректильной дисфункции коррелировала с увеличением возраста и некоторыми факторами риска сосудистого атеросклероза. Наличие хотя бы одного из перечисленных факторов риска: повышенный уровень ЛПНП или низкий уровень ЛПВП, сахарный диабет, гипертензия и курение в данном исследовании было связано с более чем четырехкратным повышением риска развития ЭД [1].
При атеросклерозе стенки кровеносных сосудов утрачивают эластичность и сужаются за счет покрывающих их атеросклеротических бляшек, что приводит к атеросклеротическому поражению сосудов, питающих половой член. Вследствие подобного поражения возникает не только механическое нарушение кровотока, но и нарушается выработка нейромедиаторов, уменьшается эластичность сосудов.
Впечатляет факт, что факторы риска эректильной дисфункции те же, что и для ИБС. В исследовании Walczak и соавт. с участием 154 мужчин с ЭД обнаружено, что у 44% из них была гипертензия, у 23% – диабет, 16% курили, у 79% индекс массы тела был >26 кг/м2 и у 74% уровень ЛПНП >120 мг/дл [1]. Данные небольших клинических испытаний подтверждают, что ИБС – мощный индикатор наличия или развития эректильной дисфункции. Dhabuwala и соавт. отметили, что 42% мужчин с ИБС отмечали ЭД. В исследование Greenstein и соавт. с участием 40 мужчин с ИБС показано, что у пациентов с мультифокальным поражением коронарных сосудов вероятность наличия ЭД больше, чем у мужчин с монофокальным поражением [1].
В последнее время большое и универсальное значение в генезе сердечно-сосудистых заболеваний и ЭД придается дисфункции эндотелия и факторам риска ее развития [25, 26]. Этот феномен выражается в утрате эндотелием регуляторных свойств, прежде всего способности изменять тонус гладкой мускулатуры, граничащей с эндотелием, из-за снижения локальной продукции NO. Заметим, что ключевая роль в возникновении, развитии и поддержании эрекции принадлежит усиленному выбросу NO. Вероятно, поэтому растет количество доказательств в пользу благотворного действия иФДЭ-5 на воспалительную активацию и маркеры дисфункции эндотелия. Так, в исследовании S. Morano и соавт. 12-недельный курс антиоксидантной терапии (пропионил L-карнитина) вместе с приемом силденафила снизил активацию моноцитов и уровень маркеров эндотелиального (ICAM-1, P-селектин) и пенильного сосудистого (конечно-диастолическая скорость) повреждений у пациентов с диабетической ЭД [27]. Те же факторы риска, что повышают риск ИБС и/или ЭД, обуславливают и дисфункцию эндотелия. Курение и пассивное курение связаны с развитием преходящей эндотелиальной дисфункции, повышенные уровни холестерина ЛПНП, гипертензия, сахарный диабет, низкая физическая нагрузка, повышенные уровни гомоцистеина – с ухудшением функции эндотелия. Принимая во внимание роль эндотелия в формировании атеросклеротической бляшки, оценка возможной взаимосвязи ЭД и ИБС – это зона интереса врача. При выборе фармакотерапии врачу следует учитывать влияние препарата на эндотелиальную функцию.
Кроме того АГ может вызывать ЭД независимо от того, страдает человек атеросклерозом или нет. По данным ряда исследований, относительный риск развития ЭД у мужчин-гипертоников в 6 раз выше по сравнению с таковым у нормотоников (диапазон ОР = 1,3–6,9, [16]). Показано, что АГ способствует пролиферации мышечной ткани в кавернозных телах и кровеносных сосудах, вызывает фиброз кавернозной ткани и увеличивает в ней количество коллагена III. При этом выраженность этих изменений прямо пропорциональна степени повышения систолического АД.
Еще одна важная область внимания врача – это взаимосвязанная триада: ЭД, ИБС и депрессия. I. Godstein и соавт. после проведения популяционного эпидемиологического исследования сделали заключение о том, что у этих трех состояний многие факторы риска общие. Было отмечено, что у большинства пациентов с сексуальной дисфункцией есть сопутствующее ССЗ и депрессия. Обнаружено, что повышенная активация тромбоцитов и нарушение гипофизарно-адреналового статуса сочетаются с наличием депрессивного состояния, и обуславливают низкую приверженность к мерам вторичной профилактики (изменение образа жизни, прекращение курения, повышение физической нагрузки) и низкому уровню соблюдения схемы приема назначенных препаратов [28].
Таким образом, основные сердечно-сосудистые факторы риска и проблема ЭД тесно взаимосвязаны. При ведении кардиологического пациента в современных условиях врач непременно должен учитывать данный факт.
Ряд авторов предполагает, что ЭД является ранним маркером ССЗ, а степень ее тяжести свидетельствует о прогрессировании ИБС [29]. Поскольку наличие ЭД может показывать ранние стадии дисфункции эндотелия, скрининг и мониторинг ЭД у пациентов с сосудистыми заболеваниями желательны. Это позволит врачу поставить правильный диагноз и начать лечение на самой ранней стадии, насколько это возможно, таким образом предупреждая серьезные клинические осложнения. В реальной жизни эпидемиологическое исследование ЭД выявило, что до 70% мужчин с этим состоянием не лечены [30]. Причины известны: смущение, нежелание мужчин консультироваться об этой проблеме с врачом (чаще всего с женщиной и в присутствии медсестры) или убеждение, что ЭД – это естественное возрастное явление. И в то же время выявление и лечение ЭД препаратами группы иФДЭ-5 может как значительно повлиять на качество жизни мужчины, так и повысить эффективность работы врача. К тому же это эффективный и неинвазивный метод лечения. Несмотря на то, что для бόльшей части пациентов ЭД – это слишком деликатная тема для обсуждения, установлено, что они готовы отвечать, если врач первым спросит об этом [30]. С другой стороны выявлено, что более половины врачей ждет, что пациент первым начнет разговор; из опрошенных врачей 29% убеждены, что эта тема слишком личная для обсуждения; 15% сослались на недостаток времени, чтобы говорить об этом с пациентом. В то же время 82% опрошенных пациентов предпочли бы обсудить проблему ЭД с терапевтом, чем с урологом, но в случае, если врач первым начнет беседу [31].
Однако только треть врачей чувствуют себя уверенно в диагностике ЭД [31]. Сейчас разработан и принят во всем мире ряд простых опросников, позволяющих быстро установить наличие ЭД у пациента. Наиболее простым является IIEF (The International Index of Erectile Function) на русском языке, он состоит из 5 вопросов.
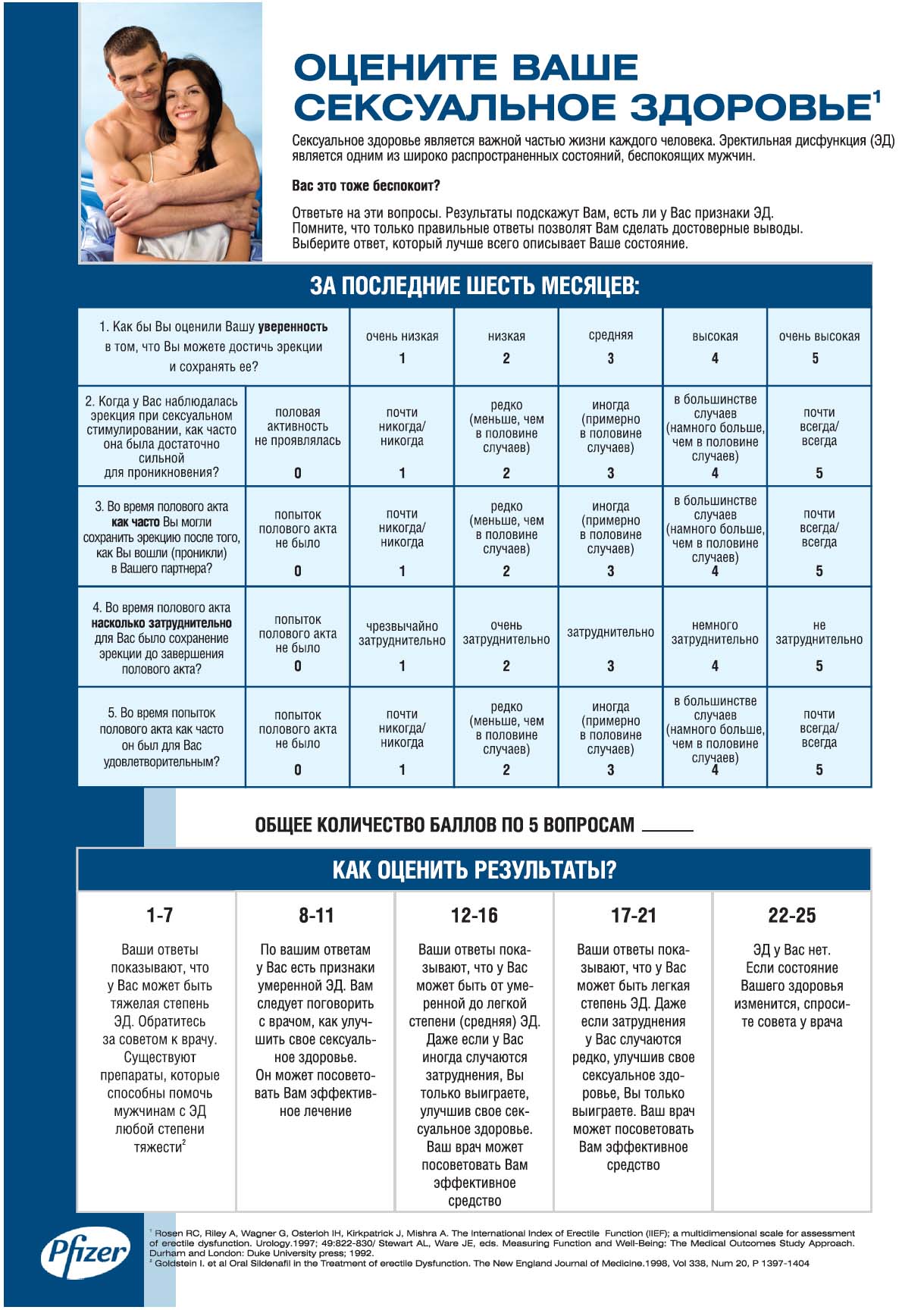
При выявлении у мужчины ЭД какой-либо степени следует провести скрининг на выявление факторов сердечно-сосудистого риска. Доказано, что симптомы ЭД в среднем возникают на 3 года раньше, чем выявляются симптомы ИБС [32]. Мужчины с ЭД имеют повышенный риск коронарных, цереброваскулярных, периферических сосудистых заболеваний. В 2005 г. был опубликован «2-й Принстонский консенсус» – клинические рекомендации по лечению ЭД у больных ИБС [56]. В них определен алгоритм ведения пациентов с ЭД в зависимости от ССЗ. Все больные подразделяются на 3 группы риска: низкого, среднего и высокого в зависимости от наличия факторов риска и степени выраженности ССЗ.
Лечение АГ – сложный и длительный процесс. Его основная цель – максимальное снижение и поддержание АД (достижение целевых уровней АД), предупреждение развития осложнений, защита органов-мишеней и уменьшение смертности. Доказанная тесная взаимосвязь АГ и ЭД вызывает дилемму: АГ как заболевание вызывает ЭД или препараты, используемые для снижения высокого АД, повреждают сексуальную функцию? Несмотря на то, что решению этого вопроса было посвящено несколько исследований, ответ до сих пор не получен [16].
За последние десятилетия в практику лечения АГ внедрено достаточно большое, количество антигипертензивных препаратов. Крупномасштабные метаанализы подтверждают, что основные классы антигипертензивных препаратов (диуретики, иАПФ, блокаторы кальциевых каналов, антагонисты рецепторов к ангиотензину, β-блокаторы и блокаторы α-адренорецепторов) достоверно не различаются по своей способности снижать АД при гипертензии [33]. В то же время, по данным ряда авторов, ЭД – это частое осложнение лечения гипертензии. Фармакотерапия сопутствующих заболеваний является причиной 25% случаев развития ЭД [34, 35]. Важнейшая заповедь врача «Nonnocere!». Поэтому кардиологу необходимо учитывать вероятность возникновения ЭД при назначении многих лекарственных средств, прежде всего используемых для профилактики и лечения ССЗ, включая АГ. Клиническими признаками медикаментозной ЭД считают относительно быстрое ее развитие; четкую временную связь с приемом препарата, способного вызывать ЭД; уменьшение выраженности расстройства (или полное его исчезновение) после отмены этого лекарственного средства.
Проблемы с эрекцией среди возможных побочных эффектов гипотензивных препаратов оказывают наибольшее воздействие на состояние здоровья в целом и качество жизни. Несколько исследований, в совокупности занявших более 30 лет, показали, что от 2,4 до 58% мужчин с АГ отмечают один или более симптомов нарушения половой функции той или иной степени тяжести во время приема антигипертензивных препаратов. Именно развитие ЭД является причиной низкой приверженности мужчин к гипотензивному лечению и, в конечном счете, ухудшает прогноз этих пациентов.
Известно, что некоторые группы антигипертензивных препаратов (диуретики, бетаблокаторы, препараты центрального действия) негативно влияют на эректильную функцию. Так, в пятилетнем исследовании Medical Researched Council, включавшем 17 354 пациентов с АГ, показано, что нарушения половой функции являются частой причиной несоблюдения больными режима приема гипотензивных средств. Преждевременное прекращение лечения в связи с ЭД достоверно чаще наблюдалось у пациентов, принимавших тиазидный диуретик либо β-адреноблокатор, по сравнению с пациентами, получавшими плацебо (12,6; 6,3 и 1,3% на 1000 человеко-лет соответственно) [36].
На сегодняшний день имеется масса сообщений о возникновении ЭД на фоне терапии β-адреноблокаторами, последние исследования подтвердили наличие этого осложнения даже при приеме карведилола – нового вазодилатирующего β-адреноблокатора [16]. В метаанализе D.T. Ко и соавт. [37] по оценке безопасности применения этой группы препаратов при АГ и ИБС показано, что применение β-адреноблокаторов связано с небольшим, но статистически значимым риском развития сексуальной дисфункции (один дополнительный случай на каждых 199 пациентов, получавших лечение β-адреноблокаторами в течение года). Бетаадреноблокаторы первых поколений чаще вызывают ЭД, чем современные препараты, и их способность вызывать ЭД не зависит от степени липофильности. В этой связи половые дисфункции, связанные с приемом лекарственных препаратов, сегодня являются предметом активного исследования. В большинстве исследований доказано, что ЭД наблюдается на фоне применения двух препаратов данной группы – пропранолола и атенолола. Частота нарушений половой функции у пациентов, получавших пропранолол, составляет 9–11% [38, 39], а атенолол – 11–17% [40]. В качестве возможных патофизиологических механизмов нарушений эректильной функции считают действие пропранолола на β-адренергические рецепторы пещеристых тел, что приводит к релаксации кавернозных тел [41], а также угнетающее влияние пропранолола на уровень половых гормонов и серотонинергические рецепторы мозга [42, 43]. В свою очередь атенолол снижает уровень тестостерона в плазме крови [44, 45]. Хотя существует и другая точка зрения, что частота возникновения ЭД на фоне приема атенолола в значительной мере зависит от того, насколько пациент информирован о возможных побочных эффектах данного препарата [46]. В ряде исследований не доказано, что прием метопролола, бисопролола, небиволола вызывает ЭД [47–49]. В некоторых исследованиях показано, что бисопролол благоприятно влияет на эректильную функцию и повышает удовлетворение от полового акта [50]. По опубликованным данным, сочетанное применение бисопролола в дозе 2,5–10 мг/сут и гидрохлортиазида в дозе 6,25 мг/сут не провоцирует развитие ЭД [51].
Проведен ряд исследований, показавших негативное влияние на эректильную функцию тиазидных диуретиков [52, 53]. Доказано, что подобное действие наиболее выражено в течение первых месяцев лечения, а в дальнейшем уменьшается [48]. Неясны и патофизиологические механизмы влияния тиазидных диуретиков на сексуальную функцию. По мнению ряда авторов, возможной причиной развития подобных нарушений является избыточное выведение из организма ионов цинка, приводящее к нарушению синтеза тестостерона, однако это не подтверждено результатами других исследований [54]. Спиронолактон обладает эстрогеноподобным влиянием, снижает уровень андрогенов, снижет эрекцию и либидо. В то же время петлевые диуретики и индапамид не ассоциируются с возникновением половых расстройств [48].
Тем не менее в арсенале врача есть гипотензивные препараты, как минимум, с доказанным нейтральным или благоприятным действием на эрекцию. В первую очередь это блокаторы кальциевых каналов и иАПФ [16]. Интерес представляет широко используемый в мире амлодипин. По данным исследования ASCOT, частота развития ЭД на фоне базовой терапии норваском (амлодипином, Pfizer) была достоверно ниже, чем в группе базовой терапии атенололом [33].
На сегодняшний день нет убедительных данных о негативном влиянии терапии иАПФ на сексуальную функцию. По данным исследования TOHMS, частота возникновения ЭД на фоне приема эналаприла и плацебо была сопоставимой [55]. Аналогичные данные получены в отношении лизиноприла [40]. Более того в исследованиии T.G. Speel и соавт. было доказано, что лечение в течение 6 мес. иАПФ квинаприлом достоверно улучшило кровообращение в пещеристых телах, сексуальную активность и эректильную функцию мужчин с прогрессирующим атеросклерозом [27].
Недавно было проведено исследование по проверке гипотезы, что лечение β-блокатором карведиолом и антагонистом II-рецепторов к ангиотензину валсартаном может различным образом влиять на половую функцию мужчин-гипертоников. Несмотря на сходную гипотензивную активность, валсартан продемонстрировал некоторые преимущества в показателях качества сексуальной жизни [27]. Отмечено, что применение блокаторов ангиотензиновых рецепторов достоверно уменьшает патологические изменения кавернозной ткани, развившиеся при АГ.
Широко известно, что статины кроме липидснижающего действия обладают другими благоприятными, так называемыми плейотропными эффектами. Это улучшение функции эндотелия, снижение воспаления и тромбогенеза, стабилизация атеросклеротической бляшки. Недавно проведенное исследование по влиянию статинов на эректильную функцию у мужчин с ЭД продемонстрировало, что добавление аторвастатина в схему терапии улучшает сексуальную функцию и ответ на прием силденафила. В другом исследовании было показано длительное улучшение сексуальной активности после приема аторвастатина (спустя 4 мес. терапии), что проявлялось в улучшении количества и качества ночных эрекции [27].
Таким образом, риск развития ЭД у пациентов с гипертензией может быть повышен из-за некорректного выбора препарата для лечения. Сообщалось, что доля мужчин с ЭД среди принимающих антигипертензивные препараты выше, чем среди нелеченых гипертоников [27]. Следовательно, при выборе препаратов больному гипертензией врач должен быть уверенным в том, что данный препарат обладает наименьшим возможным риском развития ЭД как побочного действия. В случае если это впервые выявленный пациент, важно достичь наилучшего баланса между терапевтической эффективностью и качеством сексуальной жизни. Это повысит приверженность лечению мужчины в дальнейшем. Во многих случаях просто изменение режима приема препаратов поможет больному преодолеть негативные изменения в сексуальной сфере, наблюдающиеся при некоторых видах лечения. В этой ситуации предпочтение отдают амлодипину, иАПФ, блокаторам рецепторов к ангиотензину II и аторвастатину, которые в меньшей степени влияют на половую сферу, и даже могут несколько повышать сексуальную активность мужчин [36].
Более того, доказано, что после начала лечения иФДЭ-5 пациенты-гипертоники с ЭД эффективнее соблюдали схему антигипертензивного лечения, и достигались целевые значения АД [33]. McLaughlin и соавт. определяли приверженность лечению (использовался показатель приверженности лечению – medicine possession ratio, MPR) после начала приема виагры (силденафила, Pfizer,) среди больных, уже принимающих антигипертензивные препараты, антидепрессанты, гиперлипидемические и противодиабетические средства. Большинство пациентов (64%) до начала приема силденафила не были привержены лечению. После начала лечения ЭД было достигнуто достоверно улучшение приверженности лечению среди всех групп больных: показатель приверженности лечению в группах исследования вырос на 10–18% [55]. И в то же время фармакотерапия иФДЭ-5, в частности силденафилом – это простой, эффективный и достаточно безопасный способ лечения ЭД.
Очевидно, что с учетом возможного развития ЭД лечащие врачи должны стремиться избегать неоправданного назначения соответствующих лекарств и тщательно подбирать дозы. Вместе с тем существует опасность индуцировать тревогу больных по этому поводу. Показано, что информирование пациентов о возможности ЭД при применении лекарства часто вызывает тревожность и психогенную ЭД [57]. Поэтому выявлять возможные нежелательные эффекты фармакотерапии у пациентов-мужчин необходимо, но делать это следует обдуманно и деликатно.
Таким образом, за последние годы произошли радикальные перемены в представлениях об ЭД. Прежде всего, стало очевидным, что этот симптом весьма распространен и в большинстве случаев связан с наличием факторов риска ССЗ, в том числе АГ. В ряде случаев ЭД является причиной нерационального использования лекарственных средств. Поэтому врач должен быть предельно внимателен при выборе препаратов.
Л И Т Е Р А Т У Р А
1. Stein R.A. // Rev. Urol.– 2003.– Vol.5, suppl. 7.– P.S21–S27.
2. Chua R., Keogh A., Miyashita M. // J. Heart Lung Transplant. – 2005. – Vol. 24, N4. – P. 498–500.
3. Lee A.J., Chiao T.B., Tsang M.P. // Ann. Pharmacother. – 2005. – Vol. 39, N5. – P.869–884.
4. Roscugarten B., Schermuly R.T., Voswinckel R. et al. // Cerebrovasc. Dis. – 2006. – Vol. 21, N3.– P. 194–200.
5. БакшеевВ.И., КоломиецН.М. // Клин. медицина. – 2007. – №3. – С. 4–10.
6. Bhatia S., Frantz R.P., Severson C.J. et al. // Mayo Clin. Proc. – 2003.– Vol.78.– P.1207–1213.
7. Ghofrani H.A. // Am. Coll. Chest Phys. – 2004.
8. Ghofrani H.A., Rose F., Schermuly R.T. et al. // J. Am. Coll. Cardiol. – 2003.– Vol.42.– P.158–164.
9. Wilkcus H., Guth A., Konig J. et al. // Circulation.– 2001.– Vol. 104. – P. 1218–1222.
10. Jochmann N., Kiecker F., Borges A.C. et al. // Cardiovasc. U1-trasound.– 2005.– Vol.3.– P.26.
11. Takimoto E., Champion H.C., Li M. et al. // Nat. Med.– 2005.– Vol. 11.– P. 214–222.
12. Das A., Xi L., Kukreja R.C. // J. Biol. Chem. – 2005.– Vol.280, N3.– P.12944–12955.
13. Fisher P., Salloum F., Das A. et al. // Circulation.– 2005.– Vol.111.– P.1601–1610.
14. Kloner R.A. // Am. J. Cardiol. – 2000. – Vol. 86.– P.57.
15. Mostafa T. // J. Sex. Med. – 2008. – Vol.5. – P.2502–2518.
16. Manolis A., Doumas М. // J. Hypertens. – 2008.– Vol.26. – P.2074–2084.
17. ВИАГРА. Информация для специалиста, утв. МЗ РБ.
18. Padma-Nathan H., Stecher V.J., Sweeney M. et al. // Urology. – 2003. – Vol.62.– P.400–403.
19. Gingell C., Sultana S., Wuff M. et al. // J. Sex. Med.– 2004. – Vol 1, Issue 2.– P.179–184.
20. Feldman R. // Am. J. Hypertension. – 1998. – Vol.11.– P.10A–22.
21. Kloner R.A. // J. Urol. – 2003. – Vol. 170 (2Pt.2).0– P. 46–50.
22. Kloner R.A., Brown M., Prisant L.M. et al. // Am. J. Hypertens. – 2001. – Vol. 14. – P. 70–73.
23. Giuliano F. // Eur. Urol. – 2000. – Vol. 37. – P. 80.
24. Nusbaaum M.R. // I. Am. Osteopath. Accos. – 2002.– Vol. 102, suppl. 12. – P. 1–6.
25. Bivalacyna T.I., Usta M.F., Champion H.C. et al. // I. Androl. – 2003. – Vol.24, suppl. 6. – S. 17–37.
26. Solomon H., Man J.M., Jackson G. // Heart. – 2003.– Vol. 89. – P. 251–253.
27. Aversa A. // European Urology Supplements.– 2009.– Vol.8.– P.71–79.
28. Goldstein I. // Am. J. Cardiol. – 2000. – Vol.86 (2A).– P.41F–45F.
29. Greenstein A., Chen I., Miller H. et al. // Int. I. Impot. Res. – 1997. – Vol. 9, N 3. – P. 123–126.
30. Hackett G. // Int. J. Clin. Pract. – 2009.– Vol.63, N8.– P.1205–1213.
31. De Berardis G et al. // J. Sex. Med.– 2009.– Vol.6.– P.1127–1134.
32. Heidelbaugh J.J. // Am. Fam. Physician. – 2010. – Vol.81, N3.– P.305–312.
33. Mancia G., Laurent S., Agabiti-Rosei E. et al. // J. Hypertens. – 2009.– Vol.27.– P.2121–2158.
34. Slag M.F. // JAMA. – 1983. – Vol. 249, N13.– P.1736–1740.
35. Wespes E. Impuissante organique masculine. – Paris, 1989.
36. Fogari R., Zoppi A. // Curr. Hypertens. Rep. – 2002. – Vol. 4, N3. – P. 202–210.
37. Ko D.T., Hebert P.R., Coftcy C.S. et al. // Jama.– 2002. – Vol. 288, N3. – P. 351–357.
38. Groog S.H. // Areh. Intern. Med. – 1988. – Vol. 148, N4. – P. 788–794.
39. Due D.H. // Clin. Ther. – 1986. – Vol.8, N6.– P. 624–631.
40. Fogari R. // Am. J. Hypertens. – 1998. – Vol. 11, N10. – P. 1244–1247.
41. Ferini-Strambi L. // Eur. Urol. – 1992. – Vol. 21, N4.– P. 332–334.
42. Rosen R.C. // Arch. Sex. Behav. – 1988. – Vol. 17, N3. – P. 241–255.
43. Smith E.R. // Pharmacol. Biochem. Behan. – 1995.– Vol. 52, N3. – P. 541–546.
44. Andersen P. // J. Cardiovasc. Pharmacol. – 1998.– Vol. 5. – P. 667–683.
45. Fogari R. // Eur. J. Clin. Pharmacol. – 2002. – Vol. 58, N3. – P. 177–180.
46. Silvestri A. // Eur. Heart. J. – 2003. – Vol. 24, N21.– P. 1928–1932.
47. Franzenn D. // Intern. J. Import Res. – 2001. – Vol. 131. – P. 348–351.
48. Prisant L.M. // J. Clin. Hypertens. – 1993. – Vol. 1, N1. – P. 22–26.
49. Prisant L.M. //J. Hypertens. – 2002. – Vol. 20, N1. P.11–19.
50. Brockman C.P. // J. Sex. Maritol. Ther. – 1992.– Vol. 18, N4. – P. 325–331.
51. Bansal S. // Hypertension. – 1988. – Vol. 29.– P. 1–10.
52. Chang S.W. // Areh. Intern. Med. – 1991. – Vol. 151, N12. – P.2402–2408.
53. Fogari R., Zoppi A. // Drugs Aging. – 2004. – Vol. 21, N6. – P. 377–393.
54. Geissler A.H. // Drug Nutr. Interact. – 1986. – Vol. 4, N3. – P. 275–283.
55. Grimm R.H. // Hypertension. – 1997. – Vol. 29 (Pt. l). – P. 8–14.
55. Scranton R., Lawler E., Botteman M. // Am. J. Cardiol. – 2007.– Vol.100.– P.459–463.
56. Kostis J.B. // Am. J. Cardiol. – 2005. – Vol.96.– P.313–321.
57. Salloum F.N., Ockaili R.A., Wittkamp M. et al. // J. Mol. Cell. Cardiol. – 2006. – Vol.40, N3. – P.405–411.
58. Silvestri A., Galle H.P., Cerquetani E. et al. // Eur. Heart. J. – 2003. – Vol. 24. – P. 1928–1933.
Медицинские новости. – 2010. – №10. – С. 6-13.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.