
По мировым данным, уролитиазом страдает 1–3 % населения; 12 % мужчин и 5 % женщин хотя бы раз в течение жизни переносят почечную колику, как правило, обусловленную мочекаменной болезнью (МКБ). Больные нефролитиазом составляют 30–40 % пролеченных в урологическом стационаре. В развитых странах мира из каждых 10 млн человек 400 тыс. страдают мочекаменной болезнью. Ежегодно более 1 млн американцев госпитализируют по поводу камней почек и мочевых путей. Уровень заболеваемости нефролитиазом у взрослых в России составляет 460 случаев на 100 тыс. населения. Преобладающий пол – мужской (2:1). Преобладающий возраст – 30–50 лет. Мочекаменная болезнь не имеет тенденции к снижению уровня заболеваемости и составляет около 40 % госпитализаций в урологические отделения Беларуси. В табл. 1 представлены данные о количестве больных с МКБ и методах лечения по Беларуси за 2009 г. Только около 10–15 % конкрементов имеют шансы к самостоятельному отхождению, рецидивы после отхождения или удаления камней в течение 5 лет составляют 15–40 %.
Таблица 1. Сводная таблица о количестве больных и методах лечения мочекаменной болезни в Республике Беларусь в 2009 г., по данным главных областных урологов, чел.
|
Метод лечения МКБ
|
Количество пациентов
|
|
Всего
|
г. Минск
|
Минская обл.
|
г. Брест и обл.
|
г. Гродно и обл.
|
г. Витебск и обл.
|
г. Могилев и обл.
|
г. Гомель и обл.
|
|
Всего
|
25582
|
4121
|
3021
|
2570
|
4568
|
2785
|
3600
|
4917
|
|
Открытые оперативные вмешательства
|
1049
|
244
|
173
|
92
|
87
|
67
|
55
|
331
|
|
Только ДЛТ
|
5743
|
915
|
646
|
693
|
906
|
741
|
814
|
1028
|
|
Оперативное вмешательство + ДЛТ
|
113
|
43
|
24
|
10
|
11
|
21
|
0
|
4
|
|
Консервативное лечение
|
17376
|
2413
|
2050
|
1588
|
3496
|
1879
|
2678
|
3272
|
|
Нефролапаксия
|
27
|
10
|
2
|
–
|
6
|
–
|
9
|
|
|
Контактная литотрипсия
|
825
|
356
|
126
|
197
|
62
|
37
|
47
|
|
Камни могут образоваться в результате процессов, нарушающих отток мочи из мочевыводящей системы. В этих случаях камнеобразование считается вторичным, т.е. осложнением. Для формирования конкремента необходима основа – белково-мукополисахаридная матрица камня, которая вырабатывается почкой и может выделяться с мочой. Причиной образования матрицы могут быть обменные нарушения в дистальных отделах нефрона, а также расстройства внутрипочечной гемодинамики. Будучи в 10 раз перенасыщенным раствором солей, нормальная моча является стабильной средой, в которой благодаря защитным коллоидам спонтанная кристаллизация не наступает. Даже временные нарушения внутрипочечного кровообращения, связанные с расстройствами уродинамики, микробные факторы и воспаление могут уменьшать их продукцию и количество, что способствует кристаллизации и росту камня.
Э.К. Яненко было установлено, что коралловидный нефролитиаз – самостоятельное заболевание, имеющее только ему свойственные патогенез и клиническую картину [8, 9]. Частота коралловидного нефролитиаза в структуре мочекаменной болезни составляет от 3 до 20 % [2, 8]. До начала 1960-х годов врачи придерживались консервативных методов лечения больных коралловидным нефролитиазом. Нередко больные поступали в клинику с пионефрозом, со сморщенной почкой или в терминальной стадии хронической почечной недостаточности. В 1970 г. в Японии состоялся Международный конгресс, посвященный изучению коралловидного нефролитиаза. Он способствовал более тщательному изучению данного заболевания, тактика была расширена в сторону оперативного лечения.
Коралловидный нефролитиаз проходит две стадии развития. В первой стадии (латентной) не отмечается выраженной клинической симптоматики. В следующей стадии заболевания могут повышаться температура тела и артериальное давление, возможно появление тупых болей в поясничной области, гематурии, дизурии, признаков почечной недостаточности [2].
В настоящее время большинство авторов придерживаются активной тактики ведения больных данной категории, так как стало очевидным, что при наличии окклюзии и воспалительного процесса коралловидный камень ведет к глубоким изменениям всех структур почки и нарушению ее функций [12, 16]. Новые технологии, своевременная диагностика, совершенствование методов анестезии и открытых оперативных вмешательств, в частности перкутанной нефролитолапаксии (ПНЛЛ) и дистанционной литотрипсии (ДЛТ), позволили до минимума сократить показания к нефрэктомии. Функциональные последствия органосохраняющего оперативного вмешательства определяются активностью воспалительного процесса и последствиями травмы, нанесенной паренхиме при лечении.
Перкутанная нефролитолапаксия проводится с предварительной катетеризацией мочеточника, что дает возможность визуализации чашечно-лоханочной системы почки [11, 18]. Успешный результат перкутанной нефролитолапаксии по освобождению почки от конкремента отмечался в 46–85 % наблюдений [16, 19].
Дистанционная литотрипсия применяется как альтернативный метод в лечении коралловидного нефролитиаза, особенно высока его эффективность у детей [1, 2, 6, 8]. Проведение ДЛТ у больных коралловидным нефролитиазом эффективно при камнях в лоханке внутрипочечного типа и функциональном дефиците не более 25 %, сохранной уродинамике, при ремиссии хронического пиелонефрита [21]. Основное осложнение при проведении дистанционной литотрипсии – обострение хронического пиелонефрита, вызванное травмой почки и обструкцией фрагментами конкремента. С целью профилактики этого осложнения дробление камней, как правило, проводится на фоне дренирования почки стентом после предоперационной антибактериальной подготовки [2, 19]. Сочетание перкутанной нефролитотрипсии и дистанционного разрушения камней может применяться в различной последовательности в зависимости от показаний [9].
С развитием мини-инвазивных методов лечения все более широкое применение получает комбинация перкутанной нефролитотрипсии с ДЛТ [7, 8]. Они используются при лечении нефролитиаза как монотерапия [1, 3, 13]. При наличии крупных коралловидных камней эти виды лечения комбинируются. При удалении коралловидного конкремента отпадает необходимость в создании дополнительных доступов к оставшимся фрагментам, – для их удаления в послеоперационном периоде используется дистанционная литотрипсия. Многие зарубежные авторы утверждают, что комбинированная терапия в виде перкутанной нефролитотрипсии и ДЛТ является оптимальной для большинства пациентов с коралловидными камнями [12, 14, 15]. Показания к использованию такой комбинации – камни объемом более 5000 мм3, функциональный дефицит, не превышающий 50 %, что в первую очередь относится к камням, расположенным в аномальных почках, и рецидивный характер нефролитиаза [16].
При наличии резидуальных фрагментов необходимо проведение дистанционной литотрипсии в послеоперационном периоде. Экстракорпоральная литотрипсия осуществляется в среднем через 14–20 суток после первого этапа лечения [2, 6]. Рентгеноэндоскопическая хирургия в большинстве наблюдений не оказывает влияния на функцию почки, несмотря на повторные вмешательства, дополнительные доступы и ДЛТ в послеоперационном периоде [7, 9]. По данным А.Г. Мартова и соавт. [5], в 87,2 % наблюдений с помощью комбинации таких методов лечения, как перкутанная нефролитотрипсия и дистанционная литотрипсия, происходит стабилизация или улучшение функции почки. Показатели почечных функций не зависят от исходного дефицита секреции, числа этапов перкутанной нефролитолапаксии, чрескожных доступов и дополнительных сеансов ДЛТ.
Ухудшение функции почки связано с наличием в послеоперационном периоде осложнений в виде кровотечений, развития шока и отхождения нефростомического дренажа. Количество осложнений при проведении данного вида лечения составляет 36,4 %, количество вторичных незапланированных процедур – 17,3 % [7]. Продолжительность лечения составляет в среднем от 13 до 44 койко-дней [3, 12, 15]. С учетом высокой эффективности, невысокого процента осложнений подобная тактика является методом выбора при лечении больных коралловидным нефролитиазом.
Одна из важных проблем обеспечения эффективности лечения – оптимальное использование рентгеноконтрастных веществ. Контрастные вещества (рентгеноконтрастные средства) применяются для искусственного контрастирования таких органов, которые при обычном рентгенологическом исследовании не дают достаточной плотности тени и поэтому плохо дифференцируются от окружающих их органов и тканей [4, 5, 11]. Поглощение рентгеновского излучения различными веществами возрастает прямо пропорционально четвертой степени их атомного числа. В зависимости от степени поглощения все контрастные вещества делят на легкие и тяжелые (низкоатомные и высокоатомные), или на негативные, поглощающие рентгеновское излучение в меньшей степени, чем ткани организма, и позитивные, характеризующиеся более высокой, чем ткани организма, поглощающей способностью. Наряду с контрастными веществами, которые при введении непосредственно в те или иные органы контрастируют их, имеются и такие, применение которых основано на свойствах ряда органов накапливать их и выделять. Таковы контрастные вещества, применяемые при исследовании мочевыводящей системы.
Основные требования ко всем контрастным веществам [5]:
1) безвредность, то есть минимальная токсичность для организма (не должно наблюдаться выраженных местных и общих реакций, побочных явлений и осложнений как в процессе введения, так и в дальнейшем);
2) изотоничность по отношению к жидким средам организма, с которыми они должны хорошо смешиваться, что особенно важно при введении тех или иных контрастных веществ в кровяное русло;
3) легкое и полное выведение из организма в неизмененном виде;
4) способность в необходимых случаях избирательно (селективно) накапливаться и выделяться определенными органами и системами (желчный пузырь, мочевыводящая система);
5) относительная простота изготовления, хранения и применения [5].
В медицинской практике разрешается использовать контрастные вещества, утвержденные Фармакологическим комитетом Министерства здравоохранения РБ. Использование контрастного вещества должно быть обосновано в каждом отдельном случае.
Препарат «Визипак»®вызывает меньшую степень дискомфорта пациентов по сравнению с другими низкоосмолярными средствами. Сбалансированные добавки к йодиксанолу важнейших электролитов (натрия и кальция) придают Визипаку® уникальные свойства, ведущие к уменьшению частоты аритмий и фибрилляции желудочков, а также к меньшей выраженности изменений сократимости миокарда [16]. Отмечено, что побочные реакции на введение препарата имели обычно легкую степень выраженности и были сопоставимы с таковыми при использовании неионных мономеров. Йодсодержащие контрастные вещества могут быть причиной преходящего нарушения функции почек или почечной недостаточности [13, 16, 19, 20]. Риск развития этих осложнений повышен у пациентов с уже имеющейся дисфункцией почек, в частности диабетической нефропатией, а также у больных с миеломатозом [10, 21]. Следует мониторировать функцию почек на протяжении минимум трех дней [4, 5].
За 2007–2009 гг. в урологическом отделении Могилевской областной больницы пролечено 7793 пациента, из них с мочекаменной болезнью – 2645 (33,95%). У 73 (3%) пациентов осуществлялось разрушение коралловидных камней. Основным методом лечения больных мочекаменной болезнью (в том числе и коралловидных камней) был метод дистанционной литотрипсии (рисунок). Колебание средней плотности коралловидных камней, подвергнутых дистанционной литотрипсии, в единицах Хаунсфилда составило 350–1200. 27 пациентам с коралловидным нефролитиазом выполнялась перкутанная нефролитолапаксия. Всем больным, подвергшимся ДЛТ и ПНЛЛ, выполнялось предварительное рентгеноконтрастное обследование, а также контрастирование во время операции. Рентгеноконтрастные вещества использовались также при ДЛТ рентгеннегативных конкрементов.
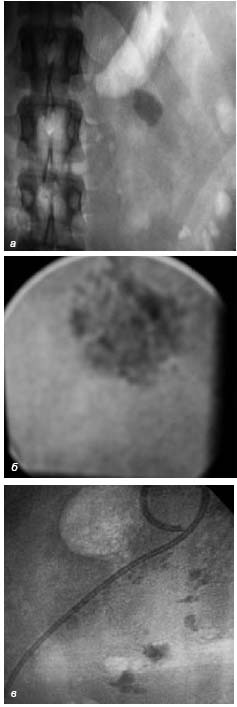
Рисунок. Коралловидный камень почки. Этапы ДЛТ: а – конкремент, выполняющий лоханку левой почки (до начала лечения); б – фрагментированный конкремент после двух сеансов ДЛТ; в – через 8 дней после последнего сеанса ДЛТ. На фоне внутреннего стента визуализируются оставшиеся фрагменты конкремента
При исследовании функции почек методом динамической нефросцинтиграфии до начала лечения у 26 человек с коралловидными камнями отмечено снижение функции пораженной почки на 15–25 %, у 21 пациента – на 5–15 %, у 6 – на 50 %. При выполнении пробы Реберга снижение клубочковой фильтрации отмечено у 42 больных (60–80 мл).
Хронический пиелонефрит был у всех пациентов с коралловидными камнями.
Для контрастирования использовались урографин, ультравист, омнипак и визипак.
Проба Реберга выполнялась до операции и ДЛТ, на следующий день после ДЛТ или ПНЛЛ и через 7 и 30 дней соответственно. Динамическая нефросцинтиграфия выполнялась через 2–3 мес. после окончания лечения.
Из 2645 больных с мочекаменной болезнью:
– прооперированы 251 (9,5%) человек: выполнены открытые операции, контактная литотрипсия (КЛТ), ПНЛЛ;
– пролечено методом ДЛТ – 2126 (80,3%) чел.;
– проведено 102 сеанса ДЛТ 46 пациентам с коралловидными камнями;
– нефролитолапаксия выполнена 27 пациентам;
– нефролитолапаксия и ДЛТ сочетались у 3 пациентов.
Рентгенпозитивными было 56 (76,7%) коралловидных камней, рентгеннегативными – 17 (23,3%).
В числе пролеченных было 3 детей в возрасте 10–12 лет, остальным пациентам было от 34 до 73 лет.
Стентирование выполнялось у всех (27) больных, пролеченных методом ПНЛЛ и у 18 больных, пролеченных методом ДЛТ. Обострение пиелонефрита на фоне лечения отмечено у 61 человека, выраженное (повышение температуры, изменение формулы крови) – у 2, у остальных ухудшились анализы мочи. Обострения купированы консервативной терапией.
При выполнении стандартного рентгенобследования с диагностической целью расходовалось от 40 до 100 мл рентгеноконтрастного вещества, при выполнении ДЛТ – от 100 до 200 мл, при нефролитолапаксии – от 150 до 300 мл. Часть контрастного вещества вводится внутривенно, часть – в полость почки. Из-за повреждения паренхимы и сосудов почки во время ПНЛЛ или ДЛТ, а также повышенного внутриполостного давления во время нагнетания жидкости в полостную систему контрастное вещество попадает в клубочковый и канальцевый аппарат почки. Такое количество контрастного вещества, вводимого внутрь, не могло не оказывать влияния на мочевыводящую систему пациента, к тому же подвергающуюся агрессии. Все водорастворимые рентгеноконтрастные вещества выделяются в основном почками.
Побочные действия и осложнения при использовании рентгеноконтрастных веществ отмечены у 2 пациентов (3 %) при использовании урографина 76 %-ного. Проявления были нетяжелыми (сыпь), купировались введением антигистаминных препаратов. Почечные эффекты были изучены в клинических исследованиях, которые показали, что Визипак® оказывает менее выраженное токсическое воздействие на клетки почечных канальцев, чем другие контрастные средства (табл. 2).
Таблица 2. Влияние рентгеноконтрастных веществ на функцию почек в лечении коралловидного нефролитиаза
|
Контрастное вещество
|
Клубочковая фильтрация, мл
|
Динамическая нефросцинтиграфия*, %
|
|
До лечения
|
1-е сутки после лечения
|
7-е сутки
|
30-е сутки
|
До лечения
|
Через 3 мес
|
|
Урографин (8 чел.)
|
80–120
|
65–80
|
70–85
|
75–95
|
25 ± 7
|
25 ± 15%
|
|
Ультравист (18 чел.)
|
70–120
|
65–80
|
70–80
|
70–120
|
25 ± 15%
|
25 ± 10%
|
|
Омнипак (21 чел.)
|
50–120
|
45–90
|
50–90
|
55–120
|
25 ± 15%
|
25 ± 10%
|
|
Визипак (26 чел.)
|
50–90
|
50–90
|
55–100
|
55–120
|
45 ± 15%
|
20 ± 10%
|
Риск серьезных осложнений, связанный с использованием Визипака®, оценивается нами как очень незначительный. Следует избегать дегидратации организма пациента перед введением контрастного средства. Клиренс контрастного средства будет снижен у пациентов с дисфункцией почек. Особую осторожность следует соблюдать у больных с выраженным сочетанным нарушением функции печени и почек, так как клиренс контрастного средства у них может быть значительно замедлен. У пациентов с нормальной функцией почек передозировка маловероятна. Визипак® приводит к меньшим изменениям параметров почек, чем другие контрастные средства.
Улучшение функции почек после элиминации коралловидного конкремента зависит и от снижения повреждающего действия контраста на почку, что видно из табл. 2.
В последние годы отмечается прогресс в лечении больных коралловидным нефролитиазом благодаря внедрению и совершенствованию новых технологий, применению комбинированного лечения.
Выводы
1. Применение перкутанной нефролитотрипсии и дистанционного разрушения камней, а также сочетание этих методов может применяться в различной последовательности в зависимости от показаний.
2. Йодсодержащие контрастные вещества могут быть причиной преходящего нарушения функции почек или почечной недостаточности. Риск развития этих осложнений повышен у пациентов с уже имеющейся дисфункцией почек. Большое количество вводимого внутрь контрастного вещества (100–300 мл) снижает функцию почек, к тому же подвергающихся агрессии (ДЛТ, ПНЛЛ, обострение пиелонефрита).
3. Все больные мочекаменной болезнью нуждаются в мониторировании функции почек после рентгеноконтрастного обследования или лечения с использованием контрастных веществ.
4. Визипак® оказывает менее выраженное токсическое действие на клетки почечных канальцев, чем другие контрастные средства. У больных с нарушенной функцией почек оптимальным препаратом для рентгеноконтрастного исследования является изоосмолярный Визипак®.
Литература
1. Алиев М.Г. Дистанционная литотрипсия в комплексном лечении резидуальных камней почек: автореф. дис. ... канд. мед. наук. – М., 2001.
2. Дзеранов Н.К. Дистанционная ударно-волновая литотрипсия в лечении мочекаменной болезни: автореф. дис. ... д-ра мед. наук. – М., 1994.
3. Дутов В.В. Современные способы лечения некоторых форм мочекаменной болезни: дис. ... д-ра мед. наук. – М., 2001.
4. Лопаткин Н.А. Почечная ангиография: автореф. дис. ... д-ра мед. наук. – М., 1959.
5. Мартов А.Г. Рентгеноэндоскопические методы диагностики и лечения заболеваний почек и верхних мочевых путей (суправезикальная урология): дис. ... д-ра мед. наук в форме науч. докл. – М., 1993.
6. Олефир Ю.В. Оптимизация выбора метода лечения коралловидного нефролитиаза: дис. ... канд. мед. наук. – М., 1998.
7. Хурцев К.В. Современные методы лечения и прогноз функционального состояния почек больных коралловидным нефролитиазом: дис. ... канд. мед. наук. – M., 1993.
8. Яненко Э.К. Коралловидный нефролитиаз: дис. ... д-ра мед. наук. – М., 1980.
9. Яненко Э.К., Кульга Л.Г., Константинова О.В. / Современные методы диагностики и лечения мочекаменной болезни: сб. науч. тр. – M., 1991. – С. 135–138.
10. Assimos D.G., Boyce W.H., Harrison L.H. et al. // J. Urol. – l989 – Vol. 142, N 2. – P. 263–268.
11. Bossch M.V., Simon J., Schulman C.C. // Eur. Urol. – 1990. – Vol. 17, N 1. – P. 1–6.
12. Dickinson J.K. // Br. J. Urol. // 1986. – Vol. 58, N 6. – P. 581–584.
13. Dushinski J.W., Lingeman J.E. // J. Urol. – 1997. – Vol. 158, N 6. – P. 2065–2068.
14. Gerber G.S. // Tech. Urol. – 1999. – Vol. 5. – P. 155–158.
15. Joseph W., Segura J.W., Glenn M., Dean G. et al. // J. Urol. – l994. – Vol. 151, N 3. – P. 1648–1651.
16. Kahn R.J. // J. West Med. 1983. – Vol. 138, N 5. – P. 681–685.
17. May N. // J. Br. Med. – 1988 – Vol. 297, N 6643. – P. 253–258.
18. Meretyk Sh., Gofrit O.N., Gafni O. et al. // J. Urol. – 1997 – Vol. 157, N 3. – P. 780–786.
19. Pode D., Verstanding A., Shapiro A. // J. Urol. – 1988. – Vol. 140, N 2. –P. 260–265.
20. Robertson W.G. // Urol. Int. – l986. – Vol. 41, N 5. – P. 329–333.
21. Yamaguchi A. // Eur. Urol. – 1994. – Vol. 25, N 2. – P. 110–115.
Медицинские новости. – 2010. – №8. – С. 68-71.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.