Значение тестостерона для мужского организма трудно переоценить. Этот гормон оказывает действие на андроген-чувствительные клетки, вызывая различные эффекты, выраженность которых обусловлена количеством специфических рецепторов и активностью 5-α-редуктазы. Основные воздействия тестостерона в мужском организме следующие:
- стимулирующее влияние на половые органы (предстательную железу, семенные пузырьки, придатки яичек, половой член):
- маскулинизирующее влияние на развитие и выраженность вторичных половых признаков (строение скелета, состояние мышечной и костной систем, характер оволосения, голосовой аппарат, кожный покров);
- активизация метаболических процессов (влияние на обмен жиров, белков, углеводов, холестерина, микроэлементов, а также эритропоэз);
- активация сперматогенеза;
- стимуляция сексуальных проявлений.
Фармакокинетические характеристики тестостерона
На сегодняшний день установлено, что так называемый биодоступный тестостерон представлен свободным тестостероном (содержание которого не превышает 1–2%), а также связанным с альбуминами плазмы крови (25–65%). При этом тестостерон в своем неактивном комплексе с глобулином, связывающем половые стероиды, определяется до 35–75%.
Oettel M. и соавт. (2004) отметили более выраженное снижение свободного, несвязанного тестостерона с возрастом при оценке общей концентрации тестостерона сыворотки и индекса свободных андрогенов у 1014 мужчин различных возрастных групп.
В работах Vermeulen A. (1980) обсуждается пограничный гипогонадотропный уровень на уровне 12 нмоль/л (3,46 нг/мл), определяющий минимальную физиологическую концентрацию тестостерона в плазме крови.
Концентрация тестостерона в плазме крови – параметр непостоянный. Greep R.O. и соавт. (1980) описывают синусоидную кривую физиологической концентрации тестостерона в периферической крови у мужчин в различное время жизненных циклов в пределах 200–800 нг. Исследователи выделяют ежегодные, ежедневные и пульсовые (в течение нескольких часов) выбросы этого мужского полового гормона. У развивающегося плода мужского пола можно зарегистрировать стремительный подъем концентрации тестостерона в 1–2 триместре беременности. Затем, к моменту рождения, наблюдается его стремительное (практически до нулевых отметок) падение с последующим постепенным ростом и пиковыми значениями в пубертатном и младшем взрослом возрасте и достаточно длительно протекающей инволюцией вплоть до старческого возраста.
Гипогонадизм
Первыми учеными, сопоставившими результаты биопсий с данными гормонального профиля, были Heller G. и Nelson W. В 1945 г. они опубликовали результаты своих исследований, основанных на двух диагностических тестах: оценке данных биопсии яичка и определении в моче 17-кетостероидов и гонадотропинов. Полученные ими данные стали важной вехой в изучении данной проблемы. На основании результатов исследования ими была предложена первая обширная классификация эндокринных расстройств мужской половой системы.
Несколько классификаций сомато-половых расстройств у мужчин предложили в 1950 г. Howard R., Sniffen R., Simmons F. Но только в 1957 г. Tillinger К. представил более полную классификацию, в основу которой были положены результаты анамнестического, клинического, эндокринологического и гистологического анализа 80 больных. В зависимости от сомато-полового развития мужчины были разделены на две группы: 1) с гипофизарным гипогонадизмом; 2) с негипофизарным гипогонадизмом (Кулакова В.И., 2005.).
Гипогонадизм (hypogonadismus; греч. hypo- + позднелат. gonas, gonadisполовая железа, от греч. goneрождение, семя + adenжелеза; синоним: гипогенитализм, гонадная недостаточность) – патологическое состояние, причинами которого являются функциональная недостаточность половых желез и уменьшение продукции половых гормонов; характеризуется недоразвитием внутренних и наружных половых органов и нечеткой выраженностью вторичных половых признаков.
Согласно Oettel M. (2004), формы мужского гипогонадизма с нарушением секреции тестостерона различают по клинической картине и причинам. Вторичный гипогонадизм, обусловленный специфической гипофункцией гипофиза, представлен при этом идиопатическим гипогонадотропным гипогонадизмом и синдромом Кальмана, синдромом Prader – Labhart – Willi, синдромом Laurence – Moon – Bardet – Biedl, семейной мозжечковой атаксией, обусловленными конституциональным нарушением секреции гонадотропин-рилизинг гормона. Другие клинические проявления вторичного гипогонадизма – конституциональная задержка пубертата при замедлении биологических часов, а также вторичные нарушения секреции гонадотропин-рилизинг гормона при наличии опухоли, инфильтрата, травмы в области гипофиза, при воздействии радиации, при хроническом недоедании, при наличии сосудистой недостаточности, а также при приеме некоторых лекарств и наркотиков.
Первичный гипогонадизм обусловлен недостаточным уровнем секреции эндогенного тестостерона за счет гипофункции ткани яичка. Различают врожденный (в результате эмбриональных нарушений) и приобретенный (травма, перекрут, опухоль яичка, при кастрации) анорхизм, дисгенезию гонад, аплазию клеток Лейдига, мужской псевдогермафродитизм, синдром Кляйнфельтера, синдром ХХ-мужчины, синдром Noonan.
Особое внимание Oettel M. уделяет вопросу рассмотрения системных заболеваний, клинические проявления которых могут привести к развитию первичного гипогонадизма. Это почечная недостаточность, серповидно-клеточная анемия, гемосидероз, цирроз печени, СПИД, хронические обструктивные заболевания легких, сонное апноэ, лепра, эпидемический паротит, сахарный диабет, миотоническая дистрофия, белковое голодание. К вредным воздействиям окружающей среды авторы относят экзогенное и эндогенное (лихорадка) воздействия жары, давления, вибрации и радиации. Негативно влияют на секрецию тестостерона также вещества, отравляющие окружающую среду, пищевые яды, а также некоторые лекарства (включая антиандрогены).
По данным Vermeulen A. (1995), в широкой популяции у мужчин в 40–60 лет гипогонадизм выявляется в 7% случаев, в 60–80 лет – 21 %, у лиц старше 80 лет частота его выявляемости достигает 35%.
До сих пор не улеглась полемика по поводу более удачного и емкого названия синдрома возрастного снижения уровня андрогенов у мужчин. Только за последние 10 лет в научной литературе предлагалось множество вариантов: «приобретенный мужской гипогонадизм», «андропауза», «мужской климактерий», «частичное возрастное снижение андрогенов у мужчин (PADAM)». Все больше отечественных и зарубежных авторов в своих работах употребляют термин «возрастной андрогенодефицит (гипогонадизм)».
При исследовании большого клинического материала (302 пациента старше 40 лет) Tan and Philip (1999) в 46% случаев зарегистрированы жалобы на эректильную дисфункцию, 41% пациентов отмечали наличие периодических приступов слабости, нарушения памяти были выявлены в 36% случаев, признаки остеопороза – в 7% случаев.
Oettel M. среди клинических проявлений возрастного андрогенодефицита, кроме ослабления либидо и эректильной функции, отмечает астению, приливы, снижение мышечной массы (саркоптоз), остеопороз, снижение гемопоэза, нарушения обмена липидов и глюкозы, формирование инсулинорезистентности рецепторов (включая сахарный диабет 2 типа), развитие абдоминального ожирения, прогрессирование сердечно-сосудистых заболеваний. В связи с этим в настоящее время рекомендации международных компетентных научных органов, занимающихся проблемами тестостерондефицитных состояний, включают необходимость проведения скринингового обследования пациентов с эректильной дисфункцией для выявления гипогонадизма.
В последних публикациях Harkonen К. et al. (2003) показана статистически достоверная корреляция симптоматики возрастного андрогенодефицита с уровнем свободного тестостерона плазмы крови.
Влияние тестостерона на половую функцию мужчин
Половая функция во многом определяется эндокринной системой, осуществляющей секрецию половых гормонов, поступающих с кровью к органам-мишеням (Бондаренко В.А. и соавт, 1983; Гладкова А. И., 1998; Kato Y. et al., 1992). Даже в чрезвычайно малых дозах эти вещества оказывают биологическое действие и являются материальными субстратами передаваемой информации.
Стимулирующее влияние тестостерона на эрекции реализуется, по-видимому, через активацию психогенных факторов. Показано стимулирующее влияние тестостерона на интенсивность оргастических переживаний (Jordan W. и соавт, 1998). Интересно отметить более выраженное влияние этого гормона на оргазм, чем на эякуляцию.
Изучение воздействия тестостерона на отдельные составляющие копулятивного цикла показало, что наиболее выраженная положительная корреляция прослеживается между его концентрацией в крови и половым влечением. Предполагается, что андрогены усиливают влечение путем повышения чувствительности определенных центров в лимбической системе и гипоталамусе, а также посредством повышения общей активности и витальности организма вследствие стимулирующего влияния андрогенов на обмен веществ. Это подтверждается тем, что препараты тестостерона являются наиболее эффективными лекарственными средствами для повышения либидо. Имеются данные, что тестостерон повышает агрессивность и чувствительность эрогенных зон. Также прослежена четкая связь между содержанием тестостерона и частотой и выраженностью ночных эрекций.
По данным Andersson K. (1995), у мужчин с нормальной функцией яичек не было выявлено корреляции между уровнем тестостерона и степенью сексуального интереса, активностью и эректильной функцией. Clopper R. (1993) заключил, что основное влияние андрогенов на сексуальную функцию осуществляется через центральные механизмы регуляции. По данным Gouchie C. (1991), высвобождение окиси азота в кавернозной ткани является тестостеронзависимым и прямо пропорционально уровню дегидротестостерона.
Взгляды на значение уровня тестостерона в плазме крови у мужчин в связи с сексуальной активностью различны. Большинство авторов усматривают положительную связь между концентрацией гормона и возникновением полового возбуждения с последующей реализацией в форме коитуса. Они полагают, что достаточный уровень тестостерона необходим в качестве фона, обеспечивающего осуществление копулятивного цикла и создающего достаточный уровень активности лимбической системы, принимающей активное участие в регуляции сексуальной функции.
Schiavi R. и соавт. (1991) обнаружили, что содержание биологически активных фракций тестостерона положительно коррелирует с интенсивностью полового влечения и частотой возникновения ночных эрекций. Аналогичные результаты получены и в исследовании Burris A. и соавт. (1992). Имеются предположения о существовании пороговых концентраций общего тестостерона (Davidson et al., 1983) и свободного тестостерона (Granata AR et al., 1997), которые определяют состояние копулятивной функции.
Таким образом, тестостерон играет важную роль в мужском организме, модулируя широкий круг физиологических реакций, влияя на физическую, сексуальную и эмоциональную активность.
Недостаток тестостерона приводит к снижению сексуального влечения и нарушениям эрекции у мужчин. Информация о роли андрогенов у мужчин поступает преимущественно в результате исследований случаев гипогонадизма и кастрации. Недостаток андрогенов ведет к снижению половой заинтересованности и активности. Влияние же на эректильную функцию более сложно (Kwan et al., 1983)*. Поэтому эрекции могут наблюдаться на протяжении многих лет (Heim, 1981) после кастрации. Аналогичным образом постепенное восстановление мужского сексуального поведения при хронической андрогенной недостаточности происходит под влиянием заместительной терапии тестостероном не сразу.
Исследование группы мужчин с гипогонадизмом показало, что на возникающие при просмотре эротических фильмов эрекции не влияют ни отмена андрогенов, ни заместительная терапия ими (Bancroft, Wu, 1983). В противоположность этому от андрогенов зависело, сопровождались ли у этих мужчин эрекции сексуальными фантазиями: наблюдалось ли уменьшение спровоцированных фантазиями эрекций после отмены андрогенов и увеличение их количества в результате заместительной терапии. Эти данные свидетельствуют о большем влиянии андрогенов на системы мозга, связанные с когнитивными и эмоциональными аспектами сексуальной реакции, чем с нервными структурами, контролирующими сосудистые механизмы эрекции.
Как бы то ни было, отмена андрогенов ослабляет ночные эрекции (Cunningham et al., 1982). Более того, назначение тестостерона здоровым мужчинам увеличивает ригидность ночных эрекций, не влияя на их частоту (Carani et al., 1990). Это предполагает действие тестостерона на моторные нейроны, снабжающие поперечнополосатые мышцы полового члена, сокращение которых и придает половому члену ригидность.
Действие тестостерона на выраженность полового поведения мужчины обеспечивается многими анатомическими образованиями. Сюда входят участки переднего мозга, особенно медиальная преоптическая область и передний гипоталамус, а также спинной мозг. Некоторые эффекты тестостерона являются результатами действия не его самого, а, скорее, его метаболитов – эстрадиола и дегидротестостерона. Например, есть данные, что нервные клетки ароматизируют тестостерон в эстрадиол, который в дальнейшем стимулирует клеточные процессы, активизирующие копулятивное поведение мужчин (Watson et al., 1989). Таким образом, тестостерон действует и как гормон, и как прогормон, а его специфические влияния зависят от ферментативной активности ткани-мишени. Это также значит, что тестостерон наряду с влиянием через рецепторы андрогенов действует в тканях с высоким уровнем ароматизации и через рецепторы эстрогенов – как эстроген. Более того, другой основной метаболит тестостерона – дегидротестостерон также связывается с рецепторами эстрогенов и, таким образом, может служить ингибитором действия женских половых гормонов (Mooradian et al., 1987). Вероятно, различные метаболиты тестостерона влияют на различные компоненты сексуального поведения, воздействуя на различные структуры (Michael et al., 1987).
Мозговые рецепторы стероидных гормонов гонад локализованы в специфических, хорошо очерченных зонах с одинаковым расположением у всех позвоночных. Рецепторы андрогенов и эстрогенов зачастую локализованы в одних и тех же участках. Среди них передняя область гипоталамуса и другие зоны с высокой плотностью стероидных рецепторов, имеющие отношение к сексуальному поведению, в частности медиальные и кортикальные миндалевидные тела (преимущественно рецепторы эстрогенов), и гиппокамп (преимущественно рецепторы андрогенов). Их обнаруживают и в других ядрах гипоталамуса, связанных с регуляцией выделения гонадотропинов.
Быстрое стимулирующее действие тестостерона на пенильные рефлексы крыс предположительно осуществляется этим вторым типом нейронных рецепторов, поскольку подавление синтеза белков их не понижает (Meisel et al., 1986). Кроме того, приведены электрофизиологические доказательства быстрого действия тестостерона на активность бульбокавернозных мышц (Sachs, Leipheimer, 1988). Это может способствовать объяснению действия тестостерона на ригидность ночных эрекций, поскольку сокращение бульбокавернозных мышц увеличивает давление в пещеристых телах эрегированного полового члена и таким образом усиливает его ригидность.
Терапия препаратами тестостерона
В современной литературе имеются данные об улучшении качества эрекции и либидо у пациентов со снижением уровня тестостерона в плазме крови. Показано, что эти параметры улучшаются уже в течение первых двух недель заместительной терапии пероральными андрогенными препаратами и их действие вполне обратимо при отмене (Davidson et al., 1983). Более того, продемонстрирована зависимость эффекта от дозы (O’Carrol et al., 1984). Измерение эректильного ответа посредством регистрации ночных пенильных тумесценций показало зависимость его от заместительной терапии андрогенами (Kwan et al., 1983; O’Carrol et al., 1984). Однако при учете зависимости эрекций от внутренних и внешних эротических стимулов результаты оказались непостоянными. Так, Bancroft и Wu (1983) отметили влияние эротических фантазий на качество эрекций, a Kwan и соавт. (1983) не смогли выявить такой зависимости.
Выраженное снижение сексуальной активности в сочетании с пониженным уровнем тестостерона хорошо поддается заместительной терапии андрогенами (Maisey et al., 1981). В нескольких работах по лечению пожилых мужчин препаратами тестостерона было достигнуто улучшение общего самочувствия и полового влечения (Marin et al., 1995; Tenover, 1992, 1997; Tremblay, Morales, 1998). Отмечено также, что связь между уровнем тестостерона в крови и способностью к эрекции имеет достаточно сложный характер, особенно у пожилых мужчин. Этот вывод согласуется с результатами заместительной терапии андрогенами у мужчин с дефицитом тестостерона, продемонстрировавшими, что андрогены имеют большее значение для поддержания полового влечения, а также возникновения ночных эрекций [Bancroft, 1989].
Накоплен огромный опыт применения заместительной гормональной терапии препаратами андрогенов при гипогонадизме. В зависимости от пути введения современные препараты подразделяются на пероральные, трансдермальные (пластыри, кремы, гели) и инъекционные формы. Появление новых современных препаратов и форм их введения, проведение большого количества крупных международных исследований в этой области обеспечивают постоянный интерес к данной тематике и вносят существенные коррективы в показания и противопоказания к проведению заместительной гормональной терапии.
В настоящее время широко используется пероральный препарат – ундеканоат тестостерона. При попадании в желудочно-кишечный тракт он хорошо всасывается и с током лимфы попадает к органам-мишеням: яичкам, костной ткани, мышцам, коже и волосам, головному мозгу. Отмечается (Schurmeyer et al., 1983), что эта форма тестостерона не создает гиперконцентраций, но в течение 25% времени действия препарата максимальный уровень тестостерона находится ниже 10 нмоль/л. Короткий период полувыведения (2 часа) диктует необходимость приема таблеток 3 раза в сутки. Кроме того, непостоянная абсорбция и относительно высокая стоимость препарата существенно ограничивают его широкое применение.
Широкомасштабные научные исследования проводятся в области разработки современных трансдермальных средств гормональной терапии. Ежегодно на рынке появляются новые гели, кремы, мази, пластыри. В одной из работ (Swerdloff R.S. et al., 2000) дана сравнительная характеристика эффективности и безопасности применения тестостерон-содержащего геля и пластыря. Авторы отмечают равную безопасность пластыря и геля, но пальму первенства в эффективности отдают гелю. Несомненно, в ближайшее время нас ожидает появление большое количество научных публикаций, посвященных применению трансдермальных тестостероновых препаратов.
Однако ежедневное применение местных препаратов тестостерона имеет существенное ограничение по причине неудобства для пациентов. Не рекомендуется принятие душа, посещение сауны, бассейнов после нанесения гелей в течение 6 часов. У пациентов, применяющих гель, ограничивающими факторами являются жаркий климат, повреждения или высыпания на коже. Пациентам, использующим гель, рекомендуется прикрывать место нанесения геля одеждой, чтобы снизить вероятность передачи. У партнерш пациентов риск контакта с гелем несколько выше, поэтому их следует наблюдать на предмет выявления симптомов вирилизации. Также следует избегать контактов кожи с нанесенным гелем с кожей детей. Ежедневное нанесение гелей в утренние часы ограничивает возможность их длительного применения из-за значительного неудобства.
Общефармакологические исследования показали, уже через несколько месяцев 30% пациентов нарушают режим терапии при ежедневном применении лекарств, что снижает эффективность терапии. В частности, при монотерапии эректильной дисфункции эффективность показал только препарат тестостерона длительного действия Небидо (A. Yassin), но не гели из-за нарушений режима приема и нестабильной концентрации тестостерона в крови.
На отработанной и доказанной модели заместительной терапии тестостероном энантатом (внутримышечные инъекции 250 мг каждые 3 недели) Nieschlag et al. (1976) изучали динамику концентраций общего тестостерона с течением времени (рис. 1).
Рисунок 1. Динамика общего тестостерона плазмы крови на фоне заместительной гормональной терапии
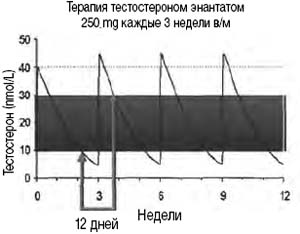
Авторы обращают внимание на то, что 66% всего цикла лечения тестостерон находится в пределах референсных значений. Клинически это может проявляться так называемым «синдромом американских горок» (в англоязычной литературе «синдромом русских горок»), связанным с неравномерным всасыванием активного вещества препарата-депо.
Наглядно динамика общего тестостерона в зависимости от интервала между инъекциями препарата представлена на рис. 2 (Nieschlag and Behre, 2000). Таким образом, несмотря на предложенные многочисленные доработки схем лечения, до 50% времени действия препарата его концентрации располагаются вне физиологической нормы.
Рисунок 2. Динамика общего тестостерона в зависимости от интервала между инъекциями
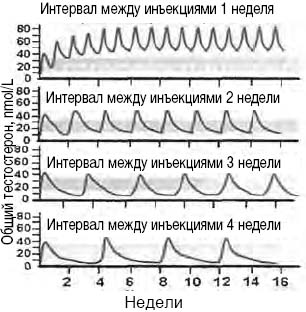
В связи с этим особого внимания заслуживает препарат «Небидо»® (пролонгированная инъекционная форма тестостерона ундеканоата), который был разработан по рекомендации Всемирной организации здравоохранения в качестве перорального средства еще в 1972 году.
Тестостерона ундеканоат – это эфир природного тестостерона, который постепенно высвобождается из депо и расщепляется сывороточными эстеразами на тестостерон и ундекановую кислоту. Повышение сывороточного тестостерона может быть зафиксировано выше исходного уровня уже на следующий день после инъекции. Фармакодинамические свойства тестостерона ундеканоата при этом идентичны физиологическому действию тестостерона. Период полувыведения препарата – 34 дня.
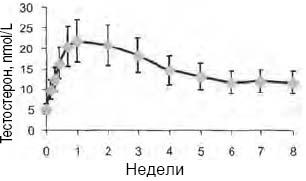
Разработчики пошли по пути пролонгации времени действия лекарственного вещества до 10–12 недель (новая инъекционная форма 1000 мг тестостерона ундеканоата в 4 мл касторового масла) при физиологических концентрациях общего тестостерона в плазме крови (Behre H. et al., 1999) (рис.3).
Рисунок 3. Колебания общего уровня тестостерона после однократной дозы тестостерона ундеканоата (1000) мг у 14 мужчин с гипогонадизмом
Открытое исследование 2-й фазы среди 13 мужчин с гипогонадизмом, получающих 4 инъекции тестостерона ундеканоата с 6-недельным интервалом (Nieschlag E. et al., 1999), показало, что повторные инъекции Небидо способствуют постепенному росту общего тестостерона плазмы крови в пределах физиологических значений (рис. 4).
Рисунок 4. Колебания общего уровня тестостерона после периодических инъекций тестостерона ундеканоата (1000) мг у 14 мужчин с гипогонадизмом
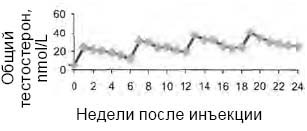
Авторы указывают, что при повторных инъекциях тестостерона ундеканоата регистрируется нормализация концентраций дигидротестостерона, а также эстрадиола и глобулина, связывающего половые гормоны. При этом пациенты отмечали субъективное улучшение общего самочувствия и сексуальной функции, особенно отмечена эмоциональная стабильность при выраженном снижении жалоб на перепады настроения и проявлений тревожно-депрессивного синдрома.
Jockenhovel et al. (2005) в широкомасштабном исследовании, проведенном в г. Херн, при сроках наблюдения до 24 месяцев проводили терапию препаратом «Небидо»® с 12-недельными интервалами. В выводах авторы указывают, что за все время исследования уровень тестостерона всегда оставался в пределах нормы, не было супрафизиологических пиков тестостерона, пациенты были эмоционально стабильны по сравнению с пациентами, получавшими тестостерона энантат; отмечено улучшение настроения и сексуальной функции, не было отрицательного влияния на простату и гематологические параметры, требовалось значительно меньшее количество инъекций, чем при лечении тестостероном энантатом (4–5 и 17–26 инъекций в год соответственно). Jockenhovel et al. (2004), а также Zitzmann M. et al. (2005) приводят данные о том, что на фоне постоянного применения препарата Небидо наблюдается постепенное, но стабильное снижение уровней не только эстрадиола и глобулина, связывающего половые гормоны, но и гипофизарных гормонов (ФСГ и ЛГ) при умеренном повышении в физиологических рамках концентрации сывороточного гемоглобина. Авторы наглядно демонстрируют снижение жировой и увеличение мышечной массы пациентов на фоне проводимой терапии, снижение уровней общего холестерина и липопротеидов низкой плотности, а также увеличение минеральной плотности костной ткани при отсутствии отрицательных воздействий на предстательную железу.
Динамику параметров, определяющих сексуальную жизнь пациентов, получающих заместительную гормональную терапию тестостероном ундеканоатом в течение 30 недель, детально изучили Hubler, Jockenhovel et al. (2002). Выявлена достоверная активизация либидо, улучшение эректильной функции, а также повышение субъективной удовлетворенности половой жизнью.
В одном из исследований Yassin et al. (2002) рассматривают спектр сопутствующих заболеваний у пациентов, не ответивших положительно на терапию эректильных расстройств препаратами ингибиторов фосфодиэстеразы 5-го типа (18–37% в зависимости от заболевания). Данные, характерные для гипогонадизма, были выявлены в 50% случаев, признаки сахарного диабета – в 35%, доброкачественная гиперплазия простаты – в 22%, артериальная гипертензия – в 23% случаев.
При этом некоторые авторы указывают на актуальность и целесообразность проведения лечения препаратами тестостерона [Yassin et al., 2003], так как до 50% пациентов, не страдающих сахарным диабетом и не поддающихся лечению ингибиторами фосфодиэстеразы 5-го типа (ФДЭ-5) имеют гипогонадизм, а у 42% пациентов с сахарным диабетом уже имеется снижение секреции тестостерона до выявления сахарного диабета. Более того, известно, что у 44% пациентов с сахарным диабетом 2 типа имеется гипогонадотропный гипогонадизм [Dhindsa et al., 2004]. Поэтому для таких пациентов, а также для больных, у которых не наблюдается эффект от монотерапии препаратами тестостерона или у которых необходимо быстро достичь результата, следует проводить сочетанное лечение как гормональными препаратами, так и ингибиторами фосфодиэстеразы 5-го типа.
Выводы
1. Международные рекомендации придают особое значение необходимости проведения скринингового обследования пациентов с эректильной дисфункцией для выявления гипогонадизма.
2. Во всех исследованиях было показано, что длительное лечение с использованием препарата Небидо (тестостерона ундеканоат) хорошо переносится и является безопасным.
3. Применение Небидо (тестостерона ундеканоата) в качестве заместительной андрогенной терапии позволяет поддерживать уровень тестостерона сыворотки и его метаболитов в пределах нормальных значений при отсутствии супрафизиологических пиков или падений концентрации тестостерона ниже нормы.
4. Центральная роль в физиологии эрекции принадлежит метаболизму оксида азота, который является тестостерон-зависимым. Поэтому терапия тестостероном у пациентов с эректильной дисфункцией и гипогонадизмом улучшает не только эректильную функцию, но и ответ на терапию ингибиторами ФДЭ-5.
Таким образом, подход к лечению эректильной дисфункции и гипогонадизма тестостероном в последнее время эволюционировал от монотерапии к совместной терапии с ингибиторами ФДЭ-5.
Л и т е р а т у р а
1. Oettel M. // Naturwissenschaften .–2004. – N. 91.– P. 66.
2. Vermeulen A. // Horm Res. – 1995. – N43. – P. 25.
3. Greep R.O., ed. International Review of Physiology. – Vol. 22. – Baltimore: University Park Press; 1980. – P. 41.
4. КулаковаВ.И. Бесплодный брак: рук. для врачей. – М.: ГОЭТАР-Медиа, 2005. – С. 307–309.
5. Tan and Philip // Arch Androl. – 1999. – N43. – P. 97–103.
6. Harkonen К. et al. // Int. J. Androl. – 2003. –N26. – P. 187.
7. Бондаренко В.А., Луценко А.Г., Сердечная Л.И. Нейрогормональные изменения при различных формах гипогонадизма // В кн.: Диагностика и лечение сексуальных расстройств. – Харьков, 1983.
8. Гладкова А.И. Гормональная регуляция половой функции у мужчины. – Харьков, 1998.
9. Kato Y., Nomura A., Stemmermann Y.N. et al. // J. Clin. Epidemiol. – 1992. – Vol.45, N12. – P. 1417–1421.
10. Jordan W. Rnkelstein, Elizabeth J. Susman, et al. // J. Clin. Endocrinol. Metab. – 1998. – Vol.83, N 7. – P. 2281–2285.
11. Andersson K.-E., Wagner G.-P. // Physiol. Rev. – 1995. – N 75. – P. 191–236.
12. Clopper R.R., Voorhess M.L. et al. // Psychoneuroendocrinology. – 1993. – N 18. – P. 149–161.
13. Gouchie C, Kimura D. // Psychoneuroendocrino-logy. – 1991. –Vol.16, N 4. – P. 323–334.
14. Schiavi R.C., Schreiner-Engel P., White D., Mandeli J. // Psychosom. Med. – 1991. – N 53. – P. 363–374.
15. Burris A.S., Banks S.M., Carter C.S et al. // J. Androl. – 1992. – Vol.13, N4. – P. 297.
16. Davidson J.M., Chen J.J., Crapo L. et al. // J. Clin. Endocrinol. Metab. – 1983. – N57. – P. 71–77.
17. Granata A.R., Rochira V., Lerchl A. et al. // J. Androl. – 1997. – Vol.18, N5. – P. 522–527.
Полный список литературы Вы можете найти на сайте http.://www.rmj.ru
Статья предоставлена Представительством АО «Bayer Shering Pharma Aktiengesellschaft» (ФРГ) в Республике Беларусь
Медицинские новости. – 2010. – №8. – С. 33-38.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.