Основным (а при ряде нозологических форм и локализаций и единственным) методом лечения доброкачественных опухолей и опухолеподобных поражений у детей и подростков является хирургический. Удаление внутрикостно расположенного патологического очага осуществляется в пределах неизмененной костной ткани; чаще всего выполняются краевая, секторальная резекции или расширенная экскохлеация (чрез- или внутриочаговая резекция). В соответствии с современными стандартами оперативного вмешательства пострезекционный дефект должен быть замещен. Целью костной пластики является обеспечение оптимальных условий для скорейшего восстановления геометрии и прочностных характеристик пораженной кости. Особенно важное значение это имеет при поражении сегментов нижних конечностей как несущих максимальную физиологическую нагрузку.
Костные цементы, а также иные искусственные материалы и изделия (эндопротезы), не подверженные замещению костной тканью, при лечении доброкачественных опухолей и опухолеподобных поражений у детей и подростков практически не применяются. Причиной является то, что эти заболевания не приводят к снижению ожидаемой продолжительности жизни пациентов, а неизбежная «секвестрация» материалов, являющихся для организма инородным телом, в будущем может приводить к развитию осложнений (асептическая нестабильность, лизис кости, патологический усталостный перелом, разрушение суставных поверхностей при околосуставной локализации очага, позднее нагноение и т.п.), с трудом поддающихся лечению [3, 12, 13–16].
С учетом указанных факторов, оправданным является применение только тех материалов, которые в процессе репаративного остеогенеза могут замещаться собственной новообразованной костной тканью. К ним относятся собственная кость (аутопластика), консервированная одним из известных методов донорская кость, деминерализованный костный матрикс, а также искусственные материалы, изготовленные на основе костной ткани глубокой переработки, гидроксиапатитов, сульфата кальция и др. [1, 2, 4–7].
С точки зрения ортопеда-хирурга, нет принципиальной разницы результатов при применении консервированной донорской кости и искусственных костно-пластических материалов. Так, и консервированная донорская кость, и искусственные материалы являются матрицей, которая в процессе репаративного остеогенеза замещается новообразованной костной тканью, в дальнейшем претерпевающей структурную перестройку.
Все отличия заключаются в скорости протекания этих процессов и, что немаловажно, в вероятности развития различных осложнений. Наиболее значимыми являются раннее и позднее нагноение, а также перенос инфекционных заболеваний (гепатиты, сифилис, ВИЧ и др.). Вероятность гнойных осложнений, по данным производителей искусственных пластических материалов, существенно ниже, а контаминация – практически исключена. Однако их применение в значительной мере ограничивается относительно небольшим ассортиментом доступных физических форм и размеров, а также значительной, по сравнению с консервированной донорской костью, стоимостью [3, 5–7, 20].
Общепризнанно, что оптимальные клинико-рентгенологические результаты можно получить при аутопластике. Но и этот метод не лишен ряда недостатков: возможности забора достаточно массивных аутотрансплантатов, особенно у детей и подростков, ограничены; возможно развитие осложнений в месте заготовки аутокости. Для применения аутотрансплантатов на сосудистой ножке (как свободных, так и несвободных) необходима микрохирургическая техника и соответствующее обеспечение. Альтернативой этим двум методам аутопластики является пересадка костного фрагмента на питающей мышечной ножке. Однако чем длиннее питающий мышечный лоскут, тем хуже кровоснабжение костного фрагмента и, соответственно, результаты [7, 17–21].
Поражения в области дуги Адамса (с ее вовлечением в патологический процесс), по нашим данным, встречаются не менее чем у 19% детей и подростков с доброкачественными опухолями и опухолеподобными заболеваниями. К сожалению, ранняя диагностика новообразований в этой области оставляет желать лучшего – у значительной части больных (не менее чем в 45% случаев) диагноз устанавливается относительно поздно, когда очаг достигает значительных размеров или при патологическом переломе. Вместе с тем дуга Адамса является основной «несущей конструкцией», обеспечивающей прочность шейки и вертельной области бедренной кости. В связи с этим вопросы костной пластики после удаления патологического очага приобретают особо важное значение. Не вдаваясь в детали, отметим, что восстановление функции конечности прямо зависит от результатов костной пластики пострезекционного дефекта – сроков и полноценности восстановления анатомии и структуры кости [9].
Цель работы – изучить особенности оперативных вмешательств при доброкачественных опухолях и опухолеподобных поражениях в области дуги Адамса у детей и подростков, результаты применения различных способов замещения пострезекционного дефекта.
Материалы и методы
Нами были изучены особенности оперативных вмешательств и костной пластики в области дуги Адамса у 62 больных с доброкачественными новообразованиями, находившихся на лечении в детском ортопедическом отделении РНПЦТО (БелНИИТО) с 1991 г. по 2009 г. Изучались клинические данные (жалобы, анамнез, особенности проводимых диагностических и лечебных мероприятий), результаты рентгенологического обследования, КТ и МРТ.
Распределение больных по возрасту, полу, нозологической форме поражения и типу резекции
|
Нозологическая форма
|
0-4 года
|
5-9 лет
|
10-14 лет
|
15-18 лет
|
Тип резекции
|
Всего
|
|
м
|
ж
|
м
|
ж
|
м
|
ж
|
м
|
ж
|
Краевая
|
Секторальная
|
Внутриочаговая
|
|
Остеохондрома
|
-
|
-
|
2
|
-
|
-
|
2
|
1
|
2
|
7
|
-
|
-
|
7
|
|
Хондрома
|
-
|
1
|
1
|
-
|
2
|
-
|
-
|
-
|
-
|
3
|
1
|
4
|
|
Хондробластома
|
-
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
-
|
-
|
1
|
1
|
|
Остеоид-остеома
|
-
|
-
|
1
|
1
|
3
|
2
|
1
|
1
|
9
|
-
|
-
|
9
|
|
Костные кисты
|
2
|
-
|
5
|
3
|
9
|
5
|
5
|
3
|
-
|
4
|
28
|
32
|
|
Фиброзная дисплазия
|
1
|
-
|
2
|
-
|
2
|
1
|
1
|
-
|
-
|
4
|
3
|
7
|
|
Эозинофильная гранулема кости
|
-
|
-
|
1
|
1
|
-
|
-
|
-
|
-
|
-
|
-
|
2
|
2
|
|
Всего
|
3
|
1
|
12
|
5
|
17
|
10
|
8
|
6
|
16 (25,8%)
|
11 (17,7%)
|
35 (56,5%)
|
62
|
|
4
|
17
|
27
|
14
|
Как видно из представленных в таблице данных, чаще всего встречались костные кисты (51,6%); остеоид-остеома, остеохондрома и фиброзная дисплазия поражали область дуги Адамса примерно с одинаковой частотой; прочие доброкачественные опухоли и опухолеподобные поражения наблюдались в единичных случаях. Почти в половине случаев (43,5%) патология выявлялась в возрасте 10–14 лет; до 5-летнего возраста эти заболевания диагностировались редко (6,4%). На наш взгляд, это связано как со скудной клинической картиной на ранних стадиях развития патологического процесса, так и с невозможностью достоверно выяснить у больных младшего возраста наличие, характер жалоб и хотя бы приблизительную локализацию возможного поражения. Обращает на себя внимание преобладание мальчиков – в наших наблюдениях во всех возрастных группах они составляли около 2/3.
Патологический перелом наблюдался у 11 детей, т.е. приблизительно у 1/3 всех больных с костными кистами (рис. 1), рентгенологические признаки вовлечения в опухолевый (опухолеподобный) процесс структурных элементов дуги Адамса – у 17 (27,4%) пациентов (рис. 2).
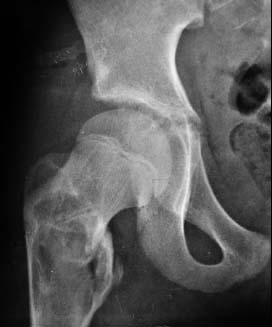
Рисунок 1. Рентгенограмма больной К., 11 лет. Диагноз: Костная киста. Выявлена при патологическом переломе, наступившем в результате прыжка с высоты менее 1 м. До травмы каких-либо жалоб не предъявляла
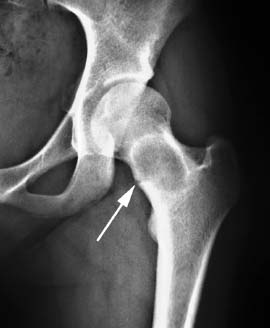
Рисунок 2. Рентгенограмма больной Б., 8 лет. Диагноз: Фиброзная дисплазия. Жалобы в течение 2-3 мес. на боли после нагрузки. Целостность дуги Адамса нарушена (стрелка)
Результаты и обсуждение
Краевая резекция была выполнена в 16 случаях (25,8%), секторальная – в 11 (17,7%) и внутриочаговая резекция (расширенная экскохлеация) – в 35 (56,5%). У пяти больных при выполнении вмешательства было произведено частичное иссечение дуги Адамса (из 45 пациентов, у которых она изначально разрушена не была). Детальные сведения о примененном типе резекции при различных видах опухолевого (опухолеподобного) поражения приведены в таблице.
Как видно из представленных в таблице данных, краевая резекция применялась при экстраоссальном (остеохондрома) или поверхностном, непосредственно под кортикальной пластинкой (остеоид-остеома), расположении опухоли. Секторальная резекция использовалась при доброкачественных новообразованиях, имеющих относительно небольшие размеры или склонных к рецидивированию (хондрома, фиброзная дисплазия, аневризмальная костная киста). Внутриочаговая резекция (расширенная экскохлеация) выполнялась, как правило, при костных кистах; вмешательство при эозинофильной гранулеме кости носило диагностический характер [10].
Ввиду относительно малых размеров пострезекционного дефекта костная пластика при краевой резекции не применялась, больным рекомендовалась частичная разгрузка конечности и пользование костылями (тростью) в течение 3–6 недель; внешняя иммобилизация или иные способы компенсации потери проч-ности кости не применялись. У одной больной с множественной экзостозной хондродисплазией удалить оплетающую остеохондрому удалось только после выполнения подвертельной остеотомии бедра (рис. 3). Какие-либо осложнения, повлиявшие на исход лечения, в этой группе больных не зарегистрированы, рецидивов патологического процесса не было.
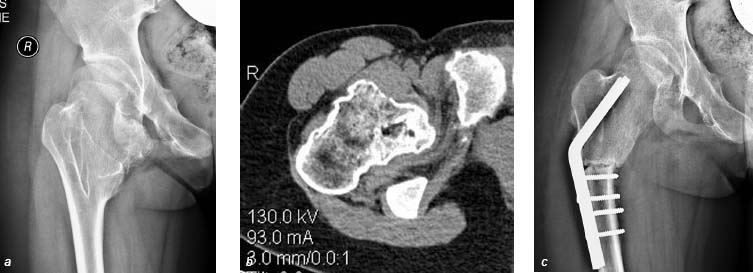
Рисунок 3. Рентгенограммы и КТ больной Я., 14 лет. Диагноз: Множественная экзостозная хондродисплазия. Оплетающая остеохондрома вертельной области правого бедра. Остеохондрома выявлена при плановом обследовании (a, b), ограничивает объем движений в тазобедренном суставе. Для ее удаления потребовалось выполнить подвертельную остеотомию бедра (c)
При расширенной экскохлеации (35 случаев, 56,5%) чаще всего (31) применялась пластика кортикальными («костная щебенка») и спонгиозными трансплантатами различной степени измельчения.
В последние годы мы предпочитаем тугую пломбировку пострезекционной полости измельченной на «костной мельнице» спонгиозной костью; для предупреждения миграции костной массы в окружающие мягкие ткани трепанационное отверстие закрываем тонкой кортикальной пластинкой, которую фиксируем чрескостными швами (рис. 4d). У 7 больных для компенсации потери прочности кости в результате выполнения резекции был применен «превентивный» остеосинтез клинковыми пластинами AO (рис. 4d) [11].
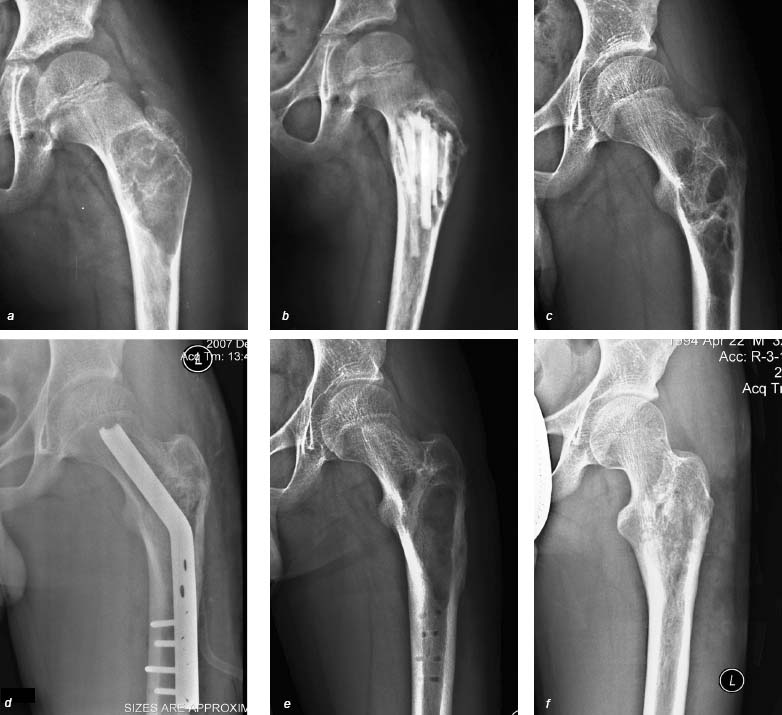
Рисунок 4. Рентгенограммы больного К., 13 лет. Диагноз: Костная киста: а– до начала лечения; b – после первичного вмешательства в ортопедическом стационаре по месту жительства, пластика дефекта «вязанкой хвороста»; c – рецидив через 1 год, поступление в РНПЦТО; d – повторное вмешательство – расширенная экскохлеация, «превентивный остеосинтез» клинковой пластиной AO, пластика дефекта измельченными спонгиозными аллотрансплантатами, трепанационное отверстие закрыто кортикальной «створкой». Через 1,5 мес. в связи с нагноением произведена ревизия с удалением металлоконструкции и трансплантатов, налажено промывное дренирование; e – через 4 мес. после купирования воспалительного процесса; f – исход через 2 года – излечение
В двух случаях в раннем послеоперационном периоде развились гнойно-воспалительные осложнения, которые у одного больного купированы консервативными мероприятиями. У одного мы были вынуждены выполнить ревизию раны с удалением трансплантатов и металлоконструкций и наладить ее промывное дренирование. Однако это осложнение не повлияло на исход лечения (рис. 4c-f).
Рецидив патологического процесса был зарегистрирован в 3 случаях (костные кисты), что, вероятно, связано с недостаточной радикальностью вмешательства. У этих больных спустя 8–18 мес. после первичной была выполнена повторная резекция, во всех случаях наступило излечение (рис. 4).
У 4 больных обширный костный дефект после расширенной экскохлеации костной кисты был замещен кортикально-спонгиозным моноблоком (алло). Каких-либо осложнений или рецидива в этих случаях зарегистрировано не было.
При секторальной резекции (11 случаев, 17,7%) дефект замещался аллогенным кортикально-спонгиозным моноблоком (4), аутотрансплантатом из крыла подвздошной кости на питающей мышечной ножке (4) и аутотрансплантатом на питающей мышечной ножке из вертельной области (3) по разработанной нами методике [8].
Кортикально-спонгиозный моноблок изготавливался непосредственно во время вмешательства из спонгиозной аллокости в соответствии с реальными размерами дефекта таким образом, чтобы кортикальная пластинка трансплантата после его установки на место располагалась снаружи как продолжение кортикальной пластинки бедренной кости. Остаточные полости вокруг трансплантата туго пломбировались измельченной спонгиозной аллокостью; моноблок фиксировался к ложу одним из известных методов (рис. 5). Этот вид пластики применен у 3 больных с фиброзной дисплазией и 1 – с хондромой; какие-либо осложнения, повлиявшие на исход лечения, у них не зарегистрированы, рецидивов не было.
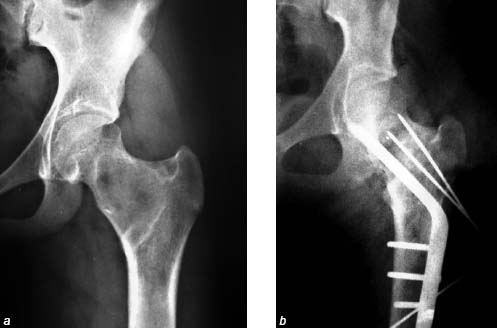
Рисунок 5. Рентгенограммы больной Г., 14 лет. Диагноз: Фиброзная дисплазия. a – до операции; b – после секторальной резекции, аллопластики кортикально-спонгиозным моноблоком, фиксации трансплантата спицами, превентивного остеосинтеза клинковой пластиной АО
В 4 случаях (хондрома – 2, киста – 1, фиброзная дисплазия – 1) использована комбинированная пластика – пострезекционный дефект заполнен аутотрансплантатом из подвздошной кости на питающей мышечной ножке, а остаточные полости – измельченной на «костной мельнице» спонгиозной аллокостью. Послеоперационный период во всех случаях протекал без особенностей, осложнений со стороны «донорской» области не было. У больной с фиброзной дисплазией спустя 3 года наступил рецидив, что потребовало выполнения повторного оперативного вмешательства (рис. 6). Ребенок продолжает лечение.
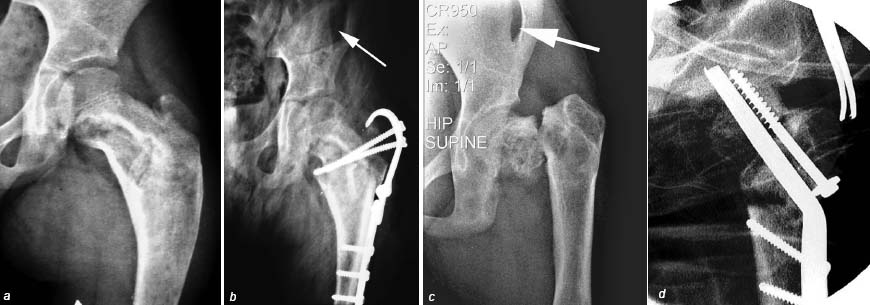
Рисунок 6. Рентгенограммы больной С., 8 лет. Диагноз: Фиброзная дисплазия: a – до начала лечения; b – после секторальной резекции, комбинированной аутоаллопластики (аутотрансплантат из подвздошной кости на питающей мышечной ножке, место забора указано стрелкой; остаточные полости вокруг аутотрансплантата заполнены измельченной спонгиозной аллокостью) и остеосинтеза вертельной пластиной; c – рецидив через 3 года, патологический перелом; d – повторное вмешательство: остеосинтез патологического перелома, секторальная резекция, аллопластика, вальгизирующая остеотомия
Трем больным (костная киста – 2, фиброзная дисплазия – 1) был применен разработанный нами способ костной аутопластики [8]. Его отличительной особенностью является то, что трансплантат формируется в межвертельной области на питающей мышечной ножке, включающей часть vastusintermediusm. quadricepsfemoris. Аутотрансплантат ротируется, смещается медиально и плотно внедряется в пострезекционный дефект, без существенного натяжения или скручивания мышечной ножки; по своей костной структуре он максимально соответствует ложу. Трансплантат фиксируется к ложу 2–3 спицами, остаточные полости вокруг него дополнительно туго пломбируются губчатой аутокостью, также забранной в вертельной области бедренной кости. Положение аутотрансплантата и полнота заполнения дефекта контролируются рентгенологически, после чего рана дренируется и ушивается по общим правилам. Схема выполнения операции представлена на рис. 7. В одном случае вмешательство было дополнено превентивным остеосинтезом пластиной АО [11], и у одного больного (отсутствовала уверенность в соблюдении пациентом предписанного нагрузочного режима) мы применили внешнюю иммобилизацию кокситной гипсовой повязкой в течение 4 недель (рис. 8). Послеоперационный период у всех больных протекал без особенностей, признаков рецидива патологического процесса не зарегистрировано.
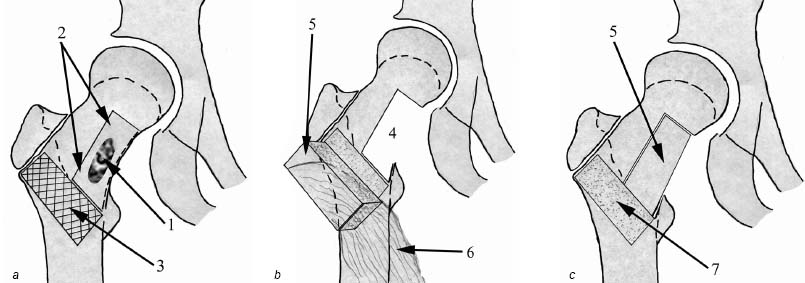
Рисунок 7. Схема выполнения «Способа хирургического лечения очагового поражения бедренной кости в области дуги Адамса» (патент РБ №10856): a – до выполнения вмешательства (1 – патологический очаг, 2 – границы секторальной резекции, 3 – область забора аутотранс- плантата); b – после секторальной резекции и забора аутотрансплантата (4 – пострезекционный дефект, 5 – заготовленный аутотрансплантат, 6 – мышечная ножка); c – после перемещения аутотрансплантата и заполнения пострезекционного дефекта (5 – перемещенный в пострезекционный дефект аутотрансплантат, 7 – место забора аутотрансплантата)
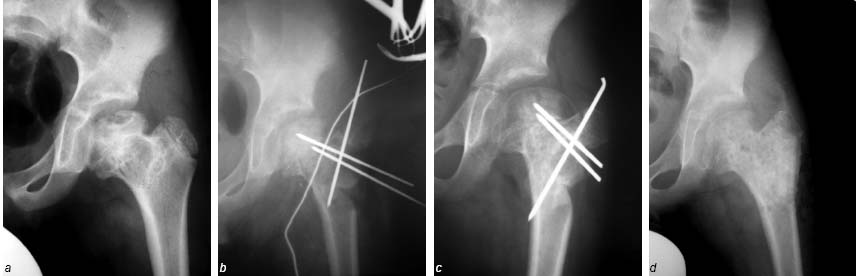
Рисунок 8. Рентгенограммы больного П., 9 лет. Диагноз: Костная киста. a – через 1 год после патологического перелома шейки бедра – литический очаг в области дуги Адамса, признаки асептического некроза головки; b – интраоперационный контроль – выполнена секторальная резекция, дефект замещен ротируемым аутотрансплантатом из вертельной области на мышечной ножке; фиксация спицами; с – через 5 мес. после вмешательства – консолидация аутотрансплантата, спицы удалены; d – через 1 год после вмешательства – неполная структурная перестройка аутотрансплантата
Динамика перестройки костных трансплантатов контролировалась рентгенологически, полная нагрузка на конечность разрешалась после восстановления непрерывности кортикальной пластинки на всем протяжении дефекта, а при применении превентивного остеосинтеза – при начальных признаках остеоинтеграции трансплантатов (рис. 9).
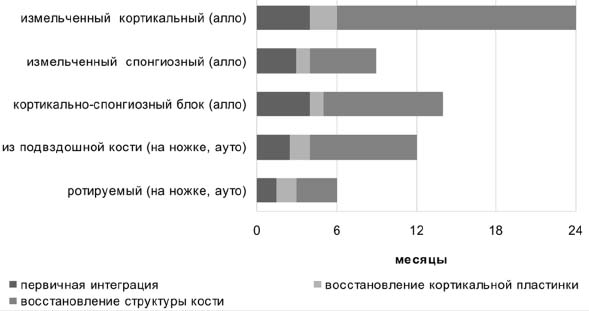
Рисунок 9. Сроки интеграции и перестройки костных трансплантатов
Сроки первичной интеграции трансплантатов – появление тени от «костной мозоли», заполняющей щели между трансплантатами и материнским ложем и замыкающей дефект кортикальной пластинки – составили от 1,5 мес. (ротируемый аутотрансплантат) до 4 мес. (измельченные кортикальные и массивный кортикально-спонгиозный аллотрансплантаты). Сроки восстановления непрерывности кортикальной пластинки были наименьшими при применении ротируемого аутотрансплантата (3 мес.) и наибольшими – при аллопластике измельченными кортикальными трансплантатами (6 мес. после вмешательства). Полная интеграция ротируемого аутотрансплантата наступала через 6 мес. после операции; на наш взгляд, в этом случае можно говорить о его приращении к ложу. Дольше всего процессы перестройки трансплантатов протекали при применении измельченных кортикальных (до 2 лет) и массивного кортикально-спонгиозного (более года) аллотрансплантатов. Достаточно большой срок перестройки аутотрансплантата из крыла подвздошной кости на питающей мышечной ножке (до 12 мес.), видимо, свидетельствует об отсутствии сколько-нибудь значимого кровоснабжения трансплантата.
Выводы
1. Превентивный остеосинтез клинковой пластиной АО после удаления патологического очага показан при нарушении целостности дуги Адамса (опухолевым процессом или при выполнении резекции). Использование превентивного остеосинтеза позволяет отказаться от применения внешней иммобилизации, связанных с нею ограничений и неоправданного снижения качества жизни пациентов.
2. При выполнении краевой резекции кости костная пластика не показана. Замещение пострезекционного дефекта необходимо при секторальной резекции и расширенной экскохлеации (74,2% всех случаев). Восстановление костной структуры в наиболее сжатые сроки может быть получено при использовании измельченных спонгиозных аллотрансплантатов и ротируемого аутотрансплантата из вертельной области.
3. Аутотрансплантат из подвздошной кости на питающей мышечной ножке существенных преимуществ перед кортикально-спонгиозным моноблоком и измельченными спонгиозными аллотранс-плантатами не имеет.
4. Ротируемый аутотрансплантат из вертельной области на питающей мышечной ножке позволяет получать оптимальные результаты, однако он может быть применен только в том случае, если патологический очаг (зона резекции) не выходит за пределы шейки бедренной кости.
Л и т е р а т у р а
1. Грабовский М.Б. Использование композиционных биосовместимых материалов для заполнения костных дефектов в детской ортопедии (эксперим.-клин. исслед.: автореф. дис. … канд. мед. наук. – М., 1995. – 14 с.
2. Жердев К.В. Применение имплантата КОЛЛАПАН-ГЕЛЬ в детской костной патологии: автореф. дис. ... канд. мед. наук. – М.: 2007. – 16 с.
3. Злобина Ю.С., Зоря В.И. // Вiсник ортоп., травм. та протез. – №2 (57). – 2008. – С.49–52.
4. Метод лечения костных кист у детей / В.Д.Шарпарь, С.Д.Литвинов и др. // Актуальные вопросы детской травматологии и ортопедии: М-лы науч.-практ. конф. детских травматологов-ортопедов России. – СПб., 2005. – С. 399–400.
5. Полторацкая Т.В., Псянчин Т.С. // Актуальные вопросы травматологии и ортопедии детского возраста: Материалы науч.-практ. конф. детских травматологов-ортопедов России, 2009. – С. 349-351.
6. Применение препарата OSTEOSET для заполнения костных полостей / С.А.Линник, П.П.Ромашов и др. // Травматол. и ортоп. России. – 2009. – №3. – С.155–156.
7. Реконструктивные операции при доброкачественных опухолях и опухолеподобных заболеваниях скелета / А.А.Раззохов, Н.Ф.Салимов и др. // Здравоохранение Таджикистана. – 2009. – №1. – С.31–35.
8. Способ хирургического лечения очагового поражения бедренной кости в области дуги Адамса / Соколовский А.М., Соколовский О.А. и др. // Патент РБ №10856.
9.Тумаян А.О. Хирургическое лечение очаговых поражений шейки, дуги Адамса и малого вертела: автореф. дис. ... канд. мед. наук. – Харьков, 1984. – 18 с.
10. Шпилевский И.Э., Пашкевич Л.А., Соколовский А.М. // Мед. новости. – 2006. – №4. – С.95–98.
11. Шпилевский И.Э., Соколовский А.М., Соколовский О.А. // Мед. новости. – 2006. – № 3. – С. 102–106.
12. Эндопротезирование при опухолевом поражении длинных костей / В.В.Тепляков, В.Ю.Карпенко и др. // Онкол. журн. – 2009. –№ 5. – С.11-15.
13. A clinical guide to primary bone tumors / J.Levesque, R.G.Marx et al. – Baltimore: Williams and Wilkins, 1998. – 301 p.
14. Campanacci M. Bone and soft tissue tumors: Clinical features, imaging, pathology and treatment. – New York: Springer, 1999. – 1319 p.
15. Gibbs C.P., Weber K., Scarborough M.T. Malignant bone tumors // JBJS. –2001 – Vol. 3-A, №11. – P.1728.
16. Kenan S. Long-term results of total femur replacement in children with malignant bone tumors // 70th Annual meeting of American Academy of Orthopaedic Surgeons, 2003. – N 223.
17. Leung P.C., Chow Y.Y.N. Reconstruction of proximal femoral defects with vascular-pedicled graft // JBJS.–1984. – Vol. 66-B, N1. – P. 32–37.
18. Reconstruction of massive femur defect with free vascularized fibula graft following tumor resection / K.Muramatsu, K.Ihara et al. // Anticancer Res. – 2006. – Vol. 26(5B). – P.3679–3683.
19. Summers B.N., Eisenstein S.M. Donor site pain from the ilium: A complication of lumbar spine fuaion // JBJS-B, 1989. – Vol. 71-B, N 4. – P.677–680.
20. Surgery of bone and soft-tissue tumors / ed. M.A.Simon.– Phildelphia: Lippincott-Raven, 1998. – 756 p.
21. Treatment of femoral head necrosis with vascularized iliac crest transplants / A.Eisenschenk, M.Lautenbach et al. // Clin. Orthop. Relat. Res. – 2001. – Vol.386. – P.100–105.
Медицинские новости. – 2010. – №5-6. – С. 60-66.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.