|

Н.В. Карлович
Возможности визуализации паращитовидных желез
Республиканский центр медицинской реабилитации и бальнеолечения
Паращитовидные железы (ПЩЖ) были впервые описаны Sandström в 1880 г. и по имени открывшего их ученого были названы тельцами Сандстрёма. Их роль в организме была установлена только в 1923 г., а первая операция по удалению увеличенной ПЩЖ у пациента с фиброзным остеитом была произведена в Вене в 1925 г. Для визуализации ПЩЖ и успешного оперативного лечения необходимо знание анатомии и эмбриологии.
ПЩЖ (обычно их четыре – две верхние и две нижние) развиваются из жаберных карманов. В период внутриутробного развития происходит опускание нижних ПЩЖ из 3-го жаберного кармана, а верхних – из 4-го. Нарушения этого процесса обусловливают вариабельность локализации ПЩЖ. Верхние ПЩЖ обычно выявляются на задней поверхности щитовидной железы (ЩЖ), в средней части верхних полюсов ЩЖ, приблизительно в 1 см над пересечением возвратного нерва и нижней щитовидной артерии. Увеличенные ПЩЖ могут опускаться кзади в трахеоэзофагеальный канал. Локализация нижних ПЩЖ более вариабельна, однако наиболее часто они расположены у нижних полюсов ЩЖ. При увеличении нижние ПЩЖ могут обнаруживаться в ткани щитовидной железы или тимуса [13, 20]. В норме ПЩЖ представляют собой овальные однородные темные тельца, средние размеры которых, по данным аутопсии, составляют 5х3х1 мм, вес – 30–50 мг. При гиперпаратиреозе размеры ПЩЖ увеличиваются до 30 мм и более, а вес – от 100 до 7150 мг [6, 13, 22]. Нарушение эмбриогенеза ПЩЖ может привести к формированию добавочных или эктопированных ПЩЖ. По данным аутопсии, добавочные ПЩЖ встречаются в общей популяции в 3–5% случаев (от 2,5 до 13%, по данным разных авторов), примерно у 3% число ПЩЖ менее четырех [6, 12, 13, 22].
Увеличение ПЩЖ происходит в случае развития первичного (ПГПТ) или вторичного (ВГПТ) гиперпаратиреоза. Характер увеличения и гистологическая картина увеличенных ПЩЖ при ПГПТ и ВГПТ различны. При ПГПТ наиболее часто выявляется моноклональная аденома одной ПЩЖ. При ВГПТ, основными причинами формирования которого являются нарушение фосфорно-кальциевого обмена и дефицит кальцитриола при уремии, чаще происходит гиперплазия всех ПЩЖ, причем морфологические изменения с течением времени прогрессируют. Ранние изменения включают уменьшение числа стромальных жировых клеток и их частичное замещение расширенными тяжами и очагами шиффовых клеток. Далее эти изменения прогрессируют в диффузную поликлональную гиперплазию. Поздние стадии характеризуются трансформацией диффузной гиперплазии в узелковую моноклональную пролиферацию. Узелковая гиперплазия сопровождается очень высокими уровнями ПТГ и выраженными костными симптомами, плохо поддается медикаментозной терапии и требует оперативного лечения [16, 24]. При ВГПТ чаще происходит увеличение всех ПЩЖ, но этот процесс не всегда симметричен. У 30% пациентов возможно неадекватное увеличение ПЩЖ, т.е. уровень ПТГ очень высок, тогда как размеры гиперплазированных ПЩЖ относительно невелики. Неадекватное увеличение может быть объяснено присутствием узелковой гиперплазии или аденоматозных изменений, т.е. формированием третичного гиперпаратиреоза [22]. Ряд исследований, выполненных с целью выяснения частоты встречаемости разных мест эктопии ПЩЖ, позволил установить, что при ВГПТ у диализных пациентов частота эктопированных ПЩЖ составляет от 15–20 до 45,7%. Чаще всего происходит эктопия нижних ПЩЖ, что объяснимо с точки зрения эмбриогенеза ПЩЖ. Показано, что наиболее частыми локализациями эктопии ПЩЖ являются (в порядке уменьшения): тиреоидная паренхима (33,3%), щитовидно-тимусная трубка (18,5%), тимус (14,8%), футляр сонной артерии (7,4%), верхнее средостение (7,4%), по ходу пищевода (7,4%), латерально к ЩЖ (3,7%), позадиглоточное пространство (3,7%), по ходу возвратного нерва (3,7%) [6]. Во время хирургического вмешательства выявлено, что 3–10% всех опухолей ПЩЖ эктопировано в ткань щитовидной железы [18], а 10–15% – в область тимуса [17].
Визуализация ПЩЖ не является обязательной процедурой в процессе диагностики гиперпаратиреоза, как первичного, так и вторичного. До последнего времени даже в случае планируемой операции предварительная визуализация ПЩЖ не имела принципиального характера, поскольку известно, что опытный хирург в процессе оперативного вмешательства в большинстве случаев (92–98%) может найти все измененные ПЩЖ. В оставшихся 2–8% случаев невозможность выявления ПЩЖ во время операции объясняется их количеством (более четырех) или эктопией [6, 12, 13, 20]. Споры о целесообразности визуализации ПЩЖ ведутся и в настоящее время. Появляется все больше и больше аргументов в пользу выполнения данной процедуры. Во-первых, точная дооперационная визуализация увеличенных ПЩЖ позволяет сократить время оперативного вмешательства и размеры операционного поля в связи с отсутствием необходимости широкой ревизии областей возможной локализации ПЩЖ. Во-вторых, относительно часто (до 15%) встречаются добавочные и (или) эктопированные ПЩЖ, пропуск которых во время оперативного вмешательства может привести к персистенции или рецидиву ВГПТ после операции. Показано, что 1/3 прооперированных по поводу ВГПТ пациентов имеет рецидив в течение 5-летнего периода наблюдения, часть этих случаев может быть предотвращена при точной дооперационной визуализации ПЩЖ [12]. Кроме того, визуализация ПЩЖ производится при одновременном исследовании щитовидной железы, что имеет значение, поскольку сопутствующая патология ЩЖ вносит свои коррективы в протокол хирургического лечения. Дооперационная визуализация ПЩЖ может быть полезной при выборе наименьшей ПЩЖ в случае выполнения субтотальной паратиреоидэктомии. Так, D. Fuster et al. показано, что при субтотальной паратиреоидэктомии, если дооперационная локализация ПЩЖ не была выявлена, рецидив ВГПТ возникает в 19% случаев и составляет 2 и 10%, если при выполнении операционного вмешательства учитываются данные сцинтиграфии и ультрасонографии ПЩЖ соответственно [5]. Эти аргументы особенно значимы в связи с появлением методик малоинвазивной, в том числе эндоскопической, хирургии органов шеи.
Важность визуализации ПЩЖ не ограничивается только предоперационной подготовкой. Так, у пациентов с ВГПТ определение размеров и структуры ПЩЖ в динамике позволяет оценить степень прогрессии ВГПТ, прогнозировать его дальнейшее течение и определять тактику ведения пациентов [18, 21, 22]. Визуализация ПЩЖ помогает также предсказать успешность применения терапевтических вмешательств и оценивать эффективность медикаментозной коррекции ВГПТ. Так, М. Fukagawa et al. показано, что у лиц с ВГПТ и отсутствием увеличенных ПЩЖ, по данным ультрасонографии, результаты применения кальцитриола наилучшие, в то время как у пациентов с выявленными ПЩЖ, размеры которых не уменьшились в ходе терапии кальцитриолом, быстро развилась резистентность к медикаментозной терапии, и понадобилось оперативное вмешательство [4]. Визуализация ПЩЖ может быть полезной и при необходимости установить, явился ли ПГПТ причиной почечной недостаточности, или почечная недостаточность вызвала развитие ВГПТ. В первом случае будет выявляться единичный очаг гиперфункциональной паратиреоидной ткани, во втором случае – несколько очагов [12].
На сегодняшний день с целью визуализации ПЩЖ могут быть использованы различные методы, включая ультрасонографию (УЗИ), сцинтиграфию, компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ) [2, 12]. Каждая методика обладает своими преимуществами и недостатками и имеет различную диагностическую чувствительность и специфичность.
Ультразвуковое исследование успешно используется для визуализации ПЩЖ с начала 80-х гг. ХХ в. Необходимо отметить, что нормальные ПЩЖ в большинстве случаев не выявляются даже при использовании современных аппаратов с высоким разрешением и датчиком 10 МГц. Это связано как с малыми размерами желез в норме, так и с тем, что в норме структуру ПЩЖ составляют шиффовы клетки, фиброваскулярная строма и адипоциты. Такая структура обеспечивает ПЩЖ эхогенность, сходную с ЩЖ. Характерную гипоэхогенность ПЩЖ приобретают при формировании аденомы или гиперплазии, когда количество клеток ПЩЖ начинает преобладать над стромой и жировой тканью [13, 22].
В типичных случаях ПЩЖ сонографически представляют собой образования округлой или овальной формы, размерами менее 3 см в любом направлении, с ровными четкими контурами, гипоэхогенные, чаще однородной структуры, расположенные у задней стенки верхних и нижних полюсов ЩЖ [22]. Почти всегда отмечается отсутствие васкуляризации, однако с увеличением размеров ПЩЖ может регистрироваться внутренний кровоток (в 32% случаев при среднем размере желез 21х10 мм) [7]. В случае паратиреоидной аденомы при использовании допплера можно выявить кровеносный сосуд, питающий аденому, который входит в нее в одном из полюсов, образуя дугу. При сканировании видна асимметричная периферическая васкуляризация одного из полюсов ПЩЖ в виде ободка [13]. Кальцификация является патогномоничной для образований ЩЖ и практически не встречается в ПЩЖ. Такая картина встречается в большинстве случаев (84,6%) [17]. В остальных случаях визуализируются следующие морфологические варианты: паратиреоидная киста (0,4%), кистозные изменения в солидной опухоли (3,8%), гигантские размеры ПЩЖ – как минимум один из них превышает 30 мм (4,6%), мультилобулярная конфигурация (2,1%), негомогенные железы (2,1%) и кальцифицированные железы (2,5%). Паратиреоидная киста сонографически не отличается от тиреоидных кист и представляет собой эхонегативное образование с толщиной стенки менее 1 мм и дорзальным усилением сигнала. Кистозные изменения в солидной опухоли выявляются как солидные или гомогенные массы с одним или более эхонегативным участком с дорзальным усилением сигнала. Мультилобулярные железы представляют собой большие гомогенные опухоли с внутренними перегородками, неоднородные ПЩЖ – очаги гипер- и гипоэхогенности в одном образовании. Необходимо отметить, что в случае гипоэхогенных образований встречаются случаи ошибочной интерпретации солидных образований как кистозных [17, 22]. Типичная картина увеличенных ПЩЖ у пациента с ВГПТ представлена на рисунке.
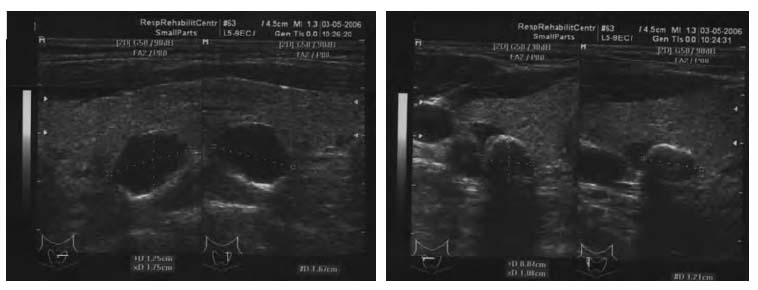
Сонографически не представляется возможным отличить аденомы ПЩЖ от их гиперплазии, однако существуют некоторые признаки, позволяющие с той или иной степенью уверенности предположить гистологический тип увеличенной ПЩЖ. Так, в пользу диффузной гиперплазии свидетельствует присутствие нескольких увеличенных ПЩЖ с гипоэхогенной однородной структурой. Для узелковой гиперплазии характерна неоднородная структура железы, менее гипоэхогенная, чем при гиперплазии. Наличие аденомы можно предположить в случае единичной неоднородной железы, иногда с мультилобулярной структурой [17, 22]. C. Vulpio et al. при помощи УЗИ оценивали число ПЩЖ, максимальный диаметр, структуру (гипоэхогенная, несколько гетерогенная, очень гетерогенная, нодулярная) и характер васкуляризации (нет, незначительная, значительная). Показана корреляция количества ПЩЖ, их максимального диаметра и сонографического образца с уровнем ПТГ. Отмечено, что при диффузной гиперплазии размеры ПЩЖ минимальны, структура однородная, гипоэхогенная, васкуляризация отсутствует, а уровень ПТГ невысок. Тяжелый ВГПТ характеризовался гетерогенной структурой ПЩЖ, наличием васкуляризации, при этом максимальный диаметр ПЩЖ превышал 9 мм [23].
Для вычисления объема измененной ткани ПЩЖ пользуются следующей формулой [24]: объем ПЩЖ (см3) = π/6хaхbхc; где a, b, c – три размера ПЩЖ (см). При объеме менее 0,5 мл ПЩЖ считаются малыми, более 0,5 мл – большими.
Преимуществами УЗИ являются доступность, низкая стоимость и отсутствие лучевой нагрузки. Диагностическая чувствительность и специфичность метода, по данным разных авторов, варьирует в широких пределах, составляя 48–90% и 75–95% соответственно [12, 17, 18, 21, 22]. Такая широкая вариабельность чувствительности обусловлена влиянием ряда факторов. Так, чувствительность ультрасонографии выше при ПГПТ, чем при ВГПТ. При ПГПТ диагностическая чувствительность является максимальной при солитарной аденоме (до 90%), при гиперплазии и двойной аденоме она значительно ниже: 30–40% и 16–40% соответственно [13]. Ложноотрицательные результаты возможны в связи с малыми размерами ПЩЖ или необычной сонографической картиной, варианты которой рассмотрены выше. Значительно ухудшает диагностическую чувствительность УЗИ наличие сопутствующей узловой патологии щитовидной железы, которая встречается, по данным E. Gomes et al., в 51,4% случаев [6]. При этом могут быть как ложноположительные, так и ложноотрицательные результаты в связи с возможной схожестью сонографической картины увеличенных ПЩЖ и узловых образований ЩЖ (коллоидная киста, аденома, многоузловой зоб), локализованных в местах, типичных для ПЩЖ. Возможна также неправильная интерпретация нормальных анатомических структур (длинная мышца шеи, левая стенка пищевода) [18]. Кроме того, затруднен дифференциальный диагноз ПЩЖ и лимфатических узлов при их локализации в местах, типичных для ПЩЖ [17]. Вышеописанные факторы отчасти носят субъективный характер, поскольку в значительной мере зависят от опыта специалиста, выполняющего исследование, и от качества ультразвукового аппарата. Подтверждением этому служит тот факт, что чувствительность и специфичность метода, оцененные в 80–90-е г. ХХ в., ниже, чем в работах, опубликованных недавно, что связано с прогрессирующим улучшением качества ультразвуковых аппаратов. Так, по данным E. Gomes et al., чувствительность УЗИ составляет 48,3% [6], а в работе S. Takebayashi et al. показано, что УЗИ с использованием датчика 7,5–10 МГц позволяет выявлять 85–90% нарушений ПЩЖ [22].
Объективной причиной, ухудшающей чувствительность УЗИ, является эктопия ПЩЖ. Причем если при интратиреоидной и некоторых других видах эктопии определение ПЩЖ затруднено, но все же возможно, то в 10–15% случаев ПЩЖ локализованы в местах, недоступных для визуализации с помощью УЗИ (ретрофарингеальная, ретроэзофагеальная, ретротрахеальная, медиастинальная области) [17].
Несмотря на имеющиеся минусы, УЗИ является методом первого выбора для визуализации увеличенных ПЩЖ как для дооперационного выявления измененных ПЩЖ, так и для оценки степени тяжести процесса и эффективности терапевтических вмешательств. В случае несоответствия полученных данных УЗИ и других клинико-лабораторных результатов показано применение дополнительных методов.
Так, в сомнительных случаях возможно выполнение тонкоигольной аспирационной пункционной биопсии под обязательным ультразвуковым контролем, поскольку опухоли ПЩЖ в большинстве случаев не пальпируются, локализуются глубоко и окружены нервами и кровеносными сосудами. Паратиреоидные клетки легко идентифицируются в аспирате, что позволяет проводить дифференциальный диагноз с узловыми образованиями щитовидной железы и лимфатическими узлами. Однако с помощью данного метода практически невозможно различить аденому и гиперплазию ПЩЖ. В работе L. Solbiati et al. показано, что пункционная биопсия имеет определенную диагностическую и клиническую значимость в случае, когда при УЗИ заподозрено увеличение ПЩЖ с нетипичной локализацией, структурой и эхогенностью или в случае сопутствующей патологии щитовидной железы. Некоторые авторы рекомендуют использовать тонкоигольную аспирационную биопсию во всех случаях плановых оперативных вмешательств по поводу гиперпаратиреоза. Чувствительность метода составляет 81,5%, специфичность – 100%, точность – 86,5% [18].
Широко используется для визуализации ПЩЖ сцинтиграфия. При этом существует несколько методик выполнения сцинтиграфии ПЩЖ, и до сих пор идут дебаты о том, какая из них наилучшим образом позволяет визуализировать ПЩЖ. Методики сцинтиграфии ПЩЖ в первую очередь различаются используемыми радиоизотопными метками, а также могут выполняться по двухфазному протоколу с одной меткой и вычитательному протоколу с двумя метками. Принцип протокола с использованием двух меток основан на том, что в вену последовательно вводят два изотопа, после введения каждого делают снимок. Поскольку элиминация изотопа из щитовидной и паращитовидной желез происходит с разной скоростью (медленнее из ПЩЖ), при вычитании изображения, полученного при использовании второй метки, которая накапливается только в щитовидной железе, из первого изображения получают искомое изображение гиперфункциональных паращитовидных желез.
Двухфазный протокол является более простым и экономичным. Его принцип основан на том, что элиминация радиофармпрепарата из гиперфункциональной увеличенной ПЩЖ происходит медленнее, чем из нормальной тиреоидной ткани. После внутривенного введения радиофармпрепарата выполняют два снимка шеи и верхней части грудной клетки в прямой планарной проекции: через 10–15 мин (ранняя фаза) и через 2–3 ч (отсроченная фаза). Во время ранней фазы происходит накопление радиоизотопа в тканях щитовидной железы, нормальных и измененных паращитовидных железах. В отсроченную фазу накопление изотопа сохраняется только в измененных ПЩЖ, поскольку из щитовидной железы и неизмененных ПЩЖ изотоп достаточно быстро элиминируется.
Первыми изотопными метками, которые использовалась для визуализации ПЩЖ, были 201Tl и 99mTc-пертехнетат. Метаанализ 19 исследований, в которых применялась 201Tl-99mTc-вычитательная сцинтиграфия, показал, что данный метод позволил визуализировать 308 из 675 измененных ПЩЖ, чувствительность метода составила 45,6% [1]. В 1989 г. показано, что сцинтиграфия с 99mTc-methoxyisobutylisonitrile (99mTc-sestamibi) имеет большую ценность для локализации ПЩЖ, чем традиционно используемая сцинтиграфия с 201Tl-99mTc-пертехнетатом, поскольку ПЩЖ имеют большую аффинность к sestamibi в связи с высоким содержанием митохондрий и высоким уровнем аэробного клеточного метаболизма [12]. Несмотря на то что в 1995 г. предложена сцинтиграфия с 99mTc-tetrofosmin для идентификации измененных ПЩЖ, чувствительность которой при ПГПТ составила 95% [10], а при ВГПТ – 80,6% [11], в настоящее время наиболее часто используется 99mTc-sestamibi. Чувствительность двухфазного протокола с sestamibi варьирует от 60 до 90% [24]. При выполнении вычитательной сцинтиграфии в качестве первой метки используют 99mTc-sestamibi, а второй – 99mTc-пертехнетат или 123I, причем предпочтительнее использовать 123I. Ряд авторов считает, что вычитательная сцинтиграфия обладает большей чувствительностью, чем двухфазный протокол. Так, показана более высокая чувствительность вычитательной сцинтиграфии по сравнению с двухфазным протоколом у пациентов с рецидивом гиперпаратиреоза [3] и у пациентов с ПГПТ до хирургического лечения [9]. Однако на сегодняшний день данных, подтверждающих преимущества вычитательного протокола, недостаточно. В то же время неудобствами этого протокола, помимо необходимости введения двух меток, являются невозможность получения множественных снимков и возможные артефакты при движениях пациента, а также при вычитании одного изображения из другого [15]. Поэтому в связи с меньшей стоимостью, относительной простотой выполнения и достаточно высокой диагностической чувствительностью двухфазный протокол с 99mTc-sestamibi является наиболее популярной методикой сцинтиграфии ПЩЖ [13].
Так же, как и при УЗИ, чувствительность сцинтиграфии выше при ПГПТ и зависит от размеров увеличенных желез. У пациентов с ПГПТ чувствительность 123I и 99mTc-sestamibi-вычитательной сцинтиграфии составляет 94%, при ВГПТ она несколько ниже – 80%. При ПГПТ максимальная диагностическая чувствительность отмечена в случае солитарной аденомы (88%), при гиперплазии и двух аденомах диагностическая чувствительность, как и при УЗИ, значительно ниже: 44 и 30% соответственно [13]. Более низкая чувствительность при ВГПТ обусловлена тем, что первично гиперплазированные ПЩЖ по размерам обычно меньше, чем аденомы. А чем больше число измененных ПЩЖ и меньше их вес, тем меньше вероятность их визуализации при сцинтиграфии [12, 16]. Так, чувствительность двухфазного протокола с sestamibi в случае больших ПЩЖ составляет 90%, а малых ПЩЖ – 40,7% [24]. Васкуляризация желез, которая присутствует в случае аденомы, несколько повышает вероятность их выявления при сцинтиграфии [12]. Радиофармпрепарат, в частности sestamibi, аккумулируется в оксифильных клетках, которые содержат много митохондрий и количество которых увеличивается при узелковой гиперплазии, поэтому повышенный захват данного изотопа ПЩЖ позволяет предположить наличие узелковой гиперплазии [16]. При исследовании пациентов с уремией и ВГПТ показано, что чувствительность двухфазного протокола с sestamibi для визуализации узелковой гиперплазии значительно выше и составляет 76,2%, в то время как для диффузной – 28,6% [16]. Однако, несмотря на различия в визуализации ПЩЖ при аденоме и гиперплазии, точно дифференцировать различные гистологические типы увеличения ПЩЖ не представляется возможным [12, 16].
Как и в случае УЗИ, ложноположительные результаты сцинтиграфии наиболее часто связаны с сопутствующим многоузловым зобом, а ложноотрицательные – с малыми размерами ПЩЖ [19, 20]. Несомненным преимуществом сцинтиграфии перед УЗИ является возможность визуализировать эктопированные ПЩЖ, включая эктопию в средостение [13]. Кроме того, результаты сцинтиграфии позволяют косвенно судить об уровне ПТГ, поскольку захват 99mTc-sestamibi пропорционален функциональной активности ПЩЖ, отражением которой является уровень ПТГ. Для оценки степени тяжести ВГПТ P. Ambrosoni et al. предложен тест подавления: после однократной внутривенной инъекции 2 мкг кальцитриола в случае ВГПТ средней степени тяжести через 2 недели ПЩЖ не будут выявляться сцинтиграфически (положительный тест). При тяжелом ВГПТ подобного подавления функциональной активности не будет, что говорит о необходимости ПТЭ или инъекции этанола [2].
Преимуществом сонографии является возможность более точно определить анатомическую локализацию увеличенной ПЩЖ по отношению к ЩЖ [13]. Кроме того, в случае ВГПТ чувствительность УЗИ одинакова как для узелковой, так и для диффузной гиперплазии, в то время как при сцинтиграфии лучше выявляется узелковая гиперплазия [16].
В 90-е гг. ХХ в. большинство исследователей сходились во мнении, что УЗИ ПЩЖ обладает меньшей чувствительностью и специфичностью, нежели сцинтиграфия, и очень редко позволяет выявить гиперплазированные ПЩЖ, которые не были визуализированы сцинтиграфически [12]. На наш взгляд, при использовании современных ультразвуковых аппаратов и наличии опытного специалиста различия в чувствительности этих двух методов могут быть нивелированы.
В ряде работ показано, что одновременное использование УЗИ и сцинтиграфии увеличивает диагностическую чувствительность до 81–98%. Поэтому большинство авторов считают, что наилучшей стратегией дооперационного определения ПЩЖ является использование обоих методов, особенно если применение одного из них не позволяет выявить ПЩЖ или размеры визуализированных ПЩЖ не соответствуют уровню ПТГ, а также в случае сопутствующей тиреоидной патологии [5, 8, 13, 14, 19].
Аксиальная компьютерная томография с контрастным усилением позволяет достаточно точно оценить размеры и локализацию ПЩЖ как в случае их нормального числа и расположения, так и при наличии добавочных ПЩЖ и их эктопии, в том числе в средостение. Диагностическая чувствительность КТ составляет 46–87% [13, 18]. Недостатками метода являются относительно низкая доступность и высокая стоимость, а также значимая лучевая нагрузка. Кроме того, исследование со стандартным шагом 5 мм возможно только при наличии желез весом 5 г и более, ошибка в данном случае не превышает 5%. В остальных случаях необходим более мелкий шаг снимков, что еще больше увеличивает лучевую нагрузку [21].
Современная методика 4D КТ включает КТ-ангиографию с шагом снимков 1 мм и оценкой перфузии крови в ПЩЖ в единицу времени. Такая оценка далее может использоваться как суррогатный индикатор функции железы. Поэтому наряду с анатомической локализацией преимуществом такого исследования является возможность оценить функции ПЩЖ [20].
Использование однофотонной эмиссионной КТ–SPECT (single photon emission computed tomography) может иметь преимущества для выявления локализации эктопии ПЩЖ в трахео-эзофагеальный желоб. Данный вид эктопии невозможно увидеть на УЗИ, а другие планарные методики (сцинтиграфия, КТ) не позволяют точно визуализировать аденому [15].
Магнитно-резонансная томография (МРТ), как и КТ, является хорошим методом визуализации ПЩЖ, включая случаи эктопии. МРТ может быть выполнена вместо КТ в случае аллергии на внутривенный контраст. Однако следует учитывать, что это наиболее дорогое исследование и по показателю цена–качество МРТ уступает другим рассмотренным методикам [20]. Используются аксиальные Т1- и Т2-взвешенные снимки. Измененные ПЩЖ визуализируются как средне- или низкоинтенсивный Т1-сигнал, а на Т2-взвешенных снимках – как сигналы высокой интенсивности. На традиционных T2WI четкость изображения зачастую страдает из-за присутствия окружающей жировой ткани. Для того чтобы различить ПЩЖ и жировую ткань, используется метод супрессии жировой ткани (STIR) для T2WI [13, 24].
Чувствительность метода составляет от 69 до 95% и зависит от размеров и гистологического типа увеличенных желез, а также от используемой методики МРТ. В случае больших желез чувствительность достигает 95%, в случае малых – 74% [24]. Чувствительность метода для визуализации узелковой гиперплазии составляет 76,2%, диффузной – 42,9% [16]. Ложноотрицательные результаты наиболее часто связаны с изоинтенсивными аденомами на Т1- и Т2-снимках. В этом случае необходимо контрастное усиление сигнала. Недостатком МРТ является также сложность дифференциальной диагностики лимфатических и тиреоидных узлов и увеличенной ПЩЖ в связи со сходными характеристиками сигнала [13, 20].
Как КТ, так и МРТ обычно используется при неудачной паратиреоидэктомии или в случаях нарушенной анатомии органов шеи.
Таким образом, визуализация паращитовидных желез, хотя и не имеет принципиального значения для диагностики гиперпаратиреоза, важна при планировании оперативного вмешательства, для прогноза дальнейшего течения и выбора стратегии ведения заболевания в каждом конкретном случае, а также для оценки динамики болезни и эффективности терапевтических вмешательств. В связи с доступностью, дешевизной и отсутствием лучевой нагрузки методом выбора является ультрасонография при условии наличия опытного специалиста и современного ультразвукового аппарата с высоким разрешением. При получении спорной сонографической картины, не соответствующей клинико-лабораторным данным, показано выполнение сцинтиграфии ПЩЖ. Тонкоигольная аспирационная биопсия, КТ и МРТ являются методами третьего выбора и могут быть использованы при недостаточной информативности ультрасонографии и сцинтиграфии. Все рассмотренные методы демонстрируют более высокую диагностическую чувствительность и специфичность при ПГПТ, в случае больших ПЩЖ и при отсутствии сопутствующей патологии ЩЖ.
1. Adalet I., Hawkins T., Clark F. et al. // Eur. J. Nucl. Med. – 1994. – Vol. 21. – P. 509–513.
2. Ambrosoni P., Olaizola I., Heuguerot C. et al. // Amer. J. Med. Sci. – 2000. – Vol. 320. – P. 90–95.
3. Chen C.C., Skarulis M.C., Fraker D.L. et al. // J. Nucl. Med. – 1995. – Vol. 36. – P. 2186–2191.
4. Fukagawa M., Kitaoka M., Yi H. et al. // Nephron. – 1994. – Vol. 68. – P. 221–228.
5. Fuster D., Ybarra J., Ortin J. et al. // Eur. J. Nucl. Med. Mol. Imaging. – 2006. – Vol. 33. – P. 467–473.
6. Gomes E.M., Nunes R.C., Lacativa P.G. et al. // Acta Cir. Bras. – 2007. – Vol. 22. – P. 105–109.
7. Gooding G.A., Clark O.H. // Amer. J. Surg. – 1992. – Vol. 164. – P. 51–56.
8. Haber R.S., Kim C.K., Inabnet W.B. // Clin. Endocrinol. (Oxf.). – 2002. – Vol. 57. – P. 241–249.
9. Hindie E., Melliere D., Jeanguillaume C. et al. // J. Nucl. Med. – 1998. – Vol. 39. – P. 1100–1105.
10. Hiromatsu Y., Ishibashi M., Nishida H. et al. // Intern. Med. – 2000. – Vol. 39. – P. 101–106.
11. Ishibashi M., Nishida H., Kumabe T. et al. // Clin. Nucl. Med. – 1995. – Vol. 20. – P. 902–905.
12. Jeanguillaume C., Ureña P., Hindié E. et al. // Radiology. – 1998. – Vol. 207. – P. 207–213.
13. Johnson N.A., Tublin M.E., Ogilvie J.B. // AJR. – 2007. – Vol. 188. – P. 1706–1715.
14. Kasai E.T., Silva J.W., Mandarim de Lacerda C.A. et al. // Rev. Esp. Med. Nucl. – 2008. – Vol. 27. – P. 8–12.
15. Lavely W.C., Goetze S., Friedman K.P. et al. // J. Nucl. Med. – 2007. – Vol. 48. – P. 1084–1089.
16. Nishida H., Ishibashi M., Hiromatsu Y. // Endocrinol. J. – 2005. – Vol. 52. – P. 223–228.
17. Randel S.B., Gooding G.A., Clark O.H. et al. // Radiology. – 1987. – Vol. 165. – P. 191–194.
18. Solbiati L., Montali G., Croce F. et al. // Radiology. – 1983. – Vol. 148. – P. 793–797.
19. Sukan A., Reyhan M., Aydin M. et al. // Ann. Nucl. Med. – 2008. – Vol. 22. – P. 123–131.
20. Suliburk J.W., Perrier N.D. // The Oncologist. – 2007. – Vol. 12. – P. 644–653.
21. Takagi H., Tominaga Y., Uchida K. et al. // Ann. Surg. – 1983. – Vol. 198. – P. 74–79.
22. Takebayashi S., Matsui K., Onohara Y. et al. // AJR. – 1987. – Vol. 148. – P. 911–914.
23. Vulpio C., Bossola M., De Gaetano A. // Amer. J. Nephrol. – 2008. – Vol. 28. – P. 589–597.
24. Wada A., Sugihara M., Sugimura K. et al. // Radiat. Med. – 1999. – Vol. 17. – P. 275–282.
Медицинские новости. – 2009. – №3. – С. 12-16.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|