|

А.Н. Барсуков, О.А. Пересада, Н.А. Одинцова, С.Л. Якутовская
Лечебная тактика при осложнении гестоза HELLP-синдромом
Белорусская медицинская академия последипломного образования, 3-я городская клиническая больница им. Е.В. Клумова, Минск
Клинические формы гестоза (водянка, нефропатия, преэклампсия, эклампсия) представляют собой стадии развития одного патологического процесса. До сих пор по поводу этиологии гестоза ученые продолжают спорить. В принципе первопричина гестоза кроется в плодном яйце, что и определяет это состояние как нарушение взаимоотношений между материнским организмом и плодом. Прекращение (прерывание) беременности является, по сути, этиотропной терапией гестоза. Но трудно согласиться с тем, что это единственный выход из ситуации. Поэтому терапия гестоза должна быть патогенетической, а прерывать беременность следует строго по показаниям.
Несмотря на то что данный раздел акушерства настойчиво изучается не одно десятилетие, патогенез гестоза до сих пор окончательно не выяснен. Существует около 30 теорий, пытающихся объяснить развитие гестоза («болезнь теорий»), но пока нет даже общепринятой классификации этого состояния.
Помимо типичных, выделяют атипичные формы гестоза. К последним относят HELLP-синдром, острую жировую дистрофию печени и холестатический гепатоз беременных.
HELLP-синдром – тяжелое осложнение беременности, возникающее чаще в ее третьем триместре и характеризующееся триадой симптомов: гемолизом, повышением печеночных ферментов и снижением уровня тромбоцитов. Название HELLP-синдром получил от английской аббревиатуры: H (hemolysis), EL (elevated liver enzimes), LP (low platelet count). Впервые он был описан G.A. Pritchard в 1954 г. В 1982 г. Weinstein предложил термин «HELLP-синдром» для определения особой группы беременных с преэклампсией, у которых отмечались гемолиз, гиперферментемия и тромбоцитопения. Многие клиницисты рассматривают HELLP-синдром как осложнение гестоза, однако он не всегда развивается на фоне типичного гестоза, при этом может отсутствовать типичная триада симптомов. При отсутствии гемолиза симптомокомплекс обозначается как ELLP-синдром, при невыраженной тромбоцитопении – как HEL-синдром [3].
Частота HELLP-синдрома составляет 2–15% у беременных с артериальной гипертензией (АГ), при тяжелой преэклампсии – эклампсии синдром встречается в 4–12% случаев [10,13] и характеризуется высокой материнской (до 75%) и перинатальной (79%) смертностью [15]. К тяжелой преэклампсии относят беременность с АГ 160/110 мм рт. ст. и более, сочетающейся с олигурией и (или) суточной потерей белка с мочой до 5 г/сут и более. Диагностически значимым критерием при гестозе является альбуминурия, так как протеинурия может наблюдаться в третьем триместре при нормально протекающей беременности [4].
Наиболее распространена теория, указывающая на то, что в патогенезе рассматриваемой патологии лежит нарушение метаболизма простаноидов (простациклина). Согласно данной теории, происходит генерализованный спазм сосудов в области плаценты с последующим повреждением их эндотелия, активацией тромбоцитов, высвобождением плацентарного тромбопластина и поступлением его в материнский кровоток. Следствием этого является активация адгезии и агрегации тромбоцитов в микроциркуляторном русле, что, в свою очередь, вовлекает в процесс фибрин, коллагеновые волокна, систему комплемента, IgG и IgM с последующей тромбоцитопенией [11, 12]. При пассаже эритроцитов через измененное микроциркуляторное русло развивается их гемолиз. Разрушение эритроцитов ведет к освобождению фосфолипидов, внутрисосудистому свертыванию (хроническому ДВС-синдрому), что, в свою очередь, приводит к смертельным акушерским кровотечениям [1, 2]. Обломки оболочек эритроцитов, агрегация и разрушение тромбоцитов способствуют высвобождению тромбоксанов, нарушению соотношения тромбоксан-простациклиновой системы, что усугубляет артериоспазм, артериальную гипертензию, приводит к отеку мозга, судорогам и коме [6, 14, 16]. Поврежденный эндотелий, фибрин и спазм сосудов микроциркуляторного русла ведут к образованию сладжей и стазу микроциркуляции, с последующим выключением отдельных бассейнов микроциркуляции (главным образом плаценты, печени, почек, мозга) из перфузии. Недостаточная перфузия печени приводит к повреждению и гибели гепатоцитов, в результате чего повышается уровень печеночных ферментов. Как следствие, развиваются очаги некроза паренхимы печени с образованием (до 40%) гематомы под капсулой [3].
Классификация HELLP-синдрома основана на лабораторных показателях, изменения в которых часто возникают гораздо раньше клинических проявлений [9]. Некоторые авторы разделяют больных на три группы: с явными, подозреваемыми и скрытыми признаками внутрисосудистой коагуляции [15]. Наиболее рациональная классификация, по нашему мнению, основана на количестве тромбоцитов в периферической крови. Она позволяет прогнозировать вероятность развития осложнений, перинатальных потерь и необходимости проведения плазмафереза: класс 1 – тромбоцитов менее 50·109/л; класс 2 –тромбоцитов 50–100·109/л; класс 3 – тромбоцитов (100–150)·109/л [3, 7].
Клинически HELLP-синдром проявляется с 33 по 36 неделю беременности, чаще при сроке 35 недель. В 30% случаев синдром развивается через 24–48 часов после родов – время максимального иммунного ответа после «гормональной бури» [11, 18], в то время как просто при тяжелом гестозе, наоборот, наблюдается регресс симптомов в первые сутки после родоразрешения. Следует отметить, что у 15% больных HELLP-синдромом в начале заболевания нет АГ.
Клиническая картина характеризуется катастрофическим нарастанием симптомов. Первоначальные проявления неспецифичны и включают головную боль, чувство тяжести в голове, слабость и утомление, мышечные боли в области плеч и шеи, нарушения зрения, тошноту и рвоту (86%), боли в животе, чаще локализующиеся в правом подреберье (86%), или диффузные выраженные отеки (67%) [3, 8, 13]. Затем присоединяются кровоизлияния в местах инъекций, кровотечения из носа и десен, рвота содержимым, окрашенным кровью, желтуха и печеночная недостаточность, судороги и кома. Нередко наблюдается разрыв печени (капсулы) с кровотечением в брюшную полость. HELLP-синдром может проявиться картиной тотальной отслойки нормально расположенной плаценты, сопровождающейся массивным коагулопатическим кровотечением с быстрым формированием печеночно-почечной недостаточности и отеком легких. В послеродовом периоде из-за нарушения гемостаза наблюдаются массивные маточные кровотечения.
Лабораторные показатели характеризуются:
1) повышением уровня трансаминаз в сыворотке крови (АсАТ – более 200 ЕД/л; АлАТ – более 70 ЕД/л; ЛДГ – более 600 ЕД/л);
2) тромбоцитопенией (менее 100·109/л);
3) внутрисосудистым гемолизом (свободный гемоглобин в сыворотке крови и в моче);
4) снижением уровня антитромбина III (менее 70%);
5) повышением уровня билирубина;
6) удлинением протромбинового времени и АЧТВ;
7) снижением уровня фибриногена, необходимого во время беременности (менее 2 г/л);
8) снижением уровня глюкозы (до гипогликемии);
9) повышением уровня азотистых шлаков.
Для предупреждения гипердиагностики HELLP-синдрома необходимо проводить дифференциальный диагноз с патологией, при которой может наблюдаться гемолиз, повышенная активность печеночных ферментов и тромбоцитопения: кокаиновой наркоманией, спонтанным разрывом печени у беременных, системной красной волчанкой, синдромами Дабина–Джонсона и Бадда–Киари, неукротимой рвотой беременных, патологией гепатобилиарной системы (внутрипеченочный холестаз, желчнокаменная болезнь, вирусный и токсический гепатит, цирроз печени), острой жировой дистрофией печени беременных (ОЖДПБ), идиопатической тромбоцитопенической пурпурой (ТП), гемолитико-уремическим синдромом (ГУС) (таблица).
Дифференциальная диагностика HELLP-синдрома с некоторыми заболеваниями, встречающимися у беременных
|
|
Особая форма конституциональной гипербилирубинемии, наследуемой по аутосомно-доминантному признаку, обусловленная генным дефектом, проявляющимся неспособностью печени экскретировать определенные вещества, преимущественно связанный билирубин и другие пигменты. Клинически заболевание проявляется в детском возрасте рецидивирующими желтухами без зуда и изменения цвета кала, незначительным увеличением печени. Субъективные симптомы незначительны. В крови – осмотическая резистентность эритроцитов нормальная, во время желтухи – гипербилирубинемия
|
|
|
Симптомокомплекс обусловлен тромбозом печеночных вен: в острых случаях наблюдаются внезапная тошнота, рвота кровью, развитие печеночной комы, в хронических – нарастающая боль в верхней части живота, увеличение печени, реже селезенки. Быстро развивается асцит, нарастают признаки нарушения функции печени, интермиттирующая субэктеричность, иногда гипогликемия и гипохолестеринемия. Клинические проявления зависят от локализации пораженных сосудов
|
|
|
Проявляется в третьем триместре беременности; в продромальном пери-оде наблюдаются головная боль, тошнота, боль в животе, в дальнейшем нарастают желтуха, почечная недостаточность, энцефалопатия, тромбоцитопения и гемолиз в финале заболевания
|
|
|
Наблюдается лихорадка, ранние неврологические нарушения, при этом прямая связь с беременностью отсутствует
|
|
|
Нет прямой связи с беременностью, преобладает острая почечная недостаточность, течение не скоротечно, нет лихорадки и симптомов поражения ЦНС
|
Нами представлен клинический пример HELLP-синдрома, развившегося в послеродовом периоде с благоприятным исходом для матери и плода.
Беременная П., 21 год, обратилась в акушерское отделение 3-й ГКБ г. Минска 03.08.07 г. в 10 ч 30 мин по направлению врача женской консультации от 02.08.07 г. Диагноз направившего учреждения – беременность 37–38 недель (по месячным), 36–37 недель (по УЗИ), ЗВУР I степени, сочетанный гестоз E2P1H2 на фоне хронического пиелонефрита вне обострения. Настоящая беременность вторая, первая в 2005 г. закончилась артифициальным абортом. Течение беременности осложнилось гестозом легкой степени с 33–34 недель гестации (АД 140/100 мм рт. ст.), в 36–37 недель (АД 150/110, 145/100 мм рт. ст.), при направлении в стационар АД 145/110, 125/90 мм рт. ст.; протеинурия 1,96 г/л. С учетом срока гестации (263 дня), длительного течения гестоза, готовности родовых путей решено провести родовозбуждение путем амниотомии. Роды проведены совместно с анестезиологом на фоне лечения гестоза, обезболивания наркотическими аналгетиками. АД в течение родового акта 150/100–130/90 мм рт. ст. В 17 ч 40 мин 03.08.07 г. родился живой ребенок мужского пола (масса 2150 г, рост 43 см, с оценкой по шкале Апгар 8/8 баллов). С лечебной целью в раннем послеродовом периоде проведено выскабливание слизистой полости матки. Общая продолжительность родов – 6 ч 50 мин. В связи с гестозом женщина переведена в реанимационное отделение. При переводе АД составляет 130/90, 130/80 мм рт. ст., пульс – 72/мин, протеинурия (моча взята катетером) – 5,92 г/л. На фоне проводимой комплексной терапии гестоза (включая магния сульфат 25% внутривенно 2 г/ч) через 33 часа после родов пациентка пожаловалась на чувство дискомфорта и боли в эпигастрии. У нее наблюдалось повышение АД 160/115, 170/120 мм рт. ст., непроизвольное подергивание мимической мускулатуры, тремор верхних конечностей. Женщина переведена на ИВЛ, одновременно отмечено падение уровня тромбоцитов крови с 233 до 67•109/л; увеличение АЛаТ с 34,8 до 404 е/л и АСаТ с 37,4 до 231 е/л; ЛДГ – 1648 е/л; общий билирубин – 42,0 мкм, прямой – 2,1 мкм, непрямой – 39,9 мкм; протеинурия –3,3 г/л, общий белок – 55 г/л, при суточном диурезе 4400 мл моча приобрела темно-вишневый цвет. Пациентка в коме. В сыворотке крови и моче определяется свободный гемоглобин. Наблюдалась кровоточивость из мест постановки периферических и центральных катетеров, слизистых носа и полости рта. Кровотечения по желудочному зонду и из родовых путей нет. При ультразвуковом исследовании выявлено, что печень незначительно увеличена (+1 см), контуры ровные, эхоструктура среднезернистая, диффузные изменения паренхимы умеренно выражены, ослабление ультразвукового сигнала в глубоких отделах паренхимы. Осуществлена комплексная терапия с участием реаниматологов, гематологов, неврологов, офтальмологов. Проведены плазмаферез, трансфузии свежезамороженной плазмы, тромбоцитарной и эритроцитарной массы. В течение двух суток купирован гемолиз и скорректированы показатели гемостаза. К концу четвертых суток пациентка вышла из комы и на пятые сутки экстубирована. Восстановительный период протекал благоприятно, МРТ головного мозга и энцефалограмма без патологии. Женщина выписана в удовлетворительном состоянии на 21-е сутки после родов.
Лечебная тактика при HELLP-синдроме направлена на:
1) быстрое и бережное родоразрешение. При отсутствии условий для родов через естественные родовые пути проводится абдоминальное родоразрешение, при развившемся HELLP-синдроме кесарево сечение является «золотым» стандартом;
2) профилактику тяжелой интра- и послеоперационной кровопотери (перевязка восходящих ветвей маточных артерий, ингибиторы фибринолиза);
3) стабилизацию поврежденных органов и систем, заместительную, гепатопротективную и антибактериальную терапию.
Рекомендуемые компоненты лечения:
1. Инфузионно-трансфузионная терапия с целью нормализации ОЦК, коллоидно-осмотического давления плазмы, реологических и коагуляционных свойств крови: альбумин 10–20%, объем и длительность инфузии определяются индивидуально; свежезамороженная плазма 20 мл/кг/сут в предоперационном и интраоперационном периодах, после операции 12–15 мл/кг/сут; гидроксиэтилированный крахмал (Хаес, Рефортан, Стабизол) 6–10%, объем и длительность инфузии определяются индивидуально; кристаллоидные растворы, тромбоконцентрат не менее 2 доз при уровне тромбоцитов менее 50•109/л. Объем инфузионно-трансфузионной терапии определяется гематокритом (не ниже 0,27 и не выше 0,35), почасовым диурезом (50–100 мл/ч), уровнем ЦВД (не менее 6–8 мм вод. ст.), показателями гемо-стаза (эндогенный гепарин не менее 0,07 ЕД/мл, АТIII не ниже 70%), общим белком крови (не менее 60 г/л), уровнем АД. В начале терапии скорость инфузии дожна превышать диурез в 2–3 раза, а количество мочи – скорость вводимой жидкости в 1,5–2 раза.
2. Мембранные стабилизаторы: глюкокортикоиды (до 1000 мг преднизолона в сутки).
3. Гипотензивная терапия (при систолическом АД > 140 мм рт.ст.).
4. Гепатопротекторы (декстроза 10%, витамин С до 10 г/сут, эссенциальные фосфолипиды в/в по 5 мл 3 раза в сутки).
5. Профилактика гнойно-септических осложнений: антибактериальная терапия (роцефин, тиенам, имипенем, меропенем, тиментин и др.)
6. Ингибиторы протеаз (транексамовая кислота 750 мг болюсно в/в).
7. Продленная ИВЛ до ликвидации внутрисосудистого гемолиза и коррекции гемостаза.
8. Повышает эффективность лечения плазмаферез (ультрафильтрация) с заменой удаляемой плазмы пациентки на донорскую в объеме 1,5–2 л.
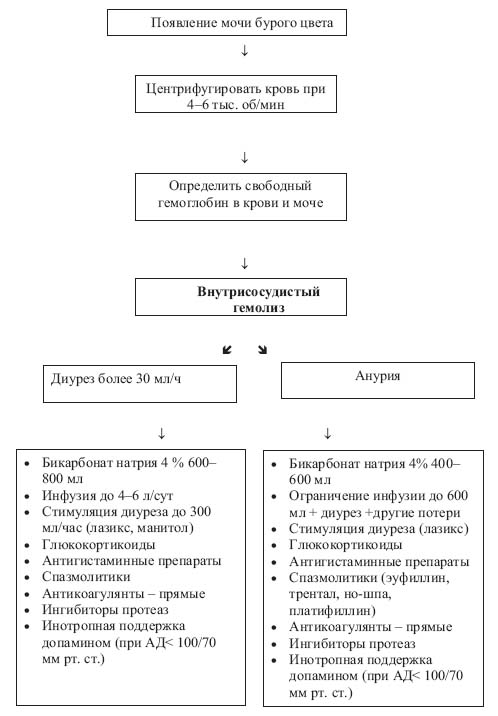
Алгоритм диагностических и лечебных мероприятий при развитии внутрисосудистого гемолиза с учетом функции почек представлен на рисунке.
Все клинические признаки HELLP-синдрома исчезают в течение 5–7 дней и, как правило, не повторяются при последующих беременностях.
В заключение обращаем внимание коллег на то, что успех терапии HELLP-синдрома зависит от своевременной его диагностики во время беременности, родов и в послеродовом периоде. Несмотря на крайне тяжелое течение патологии, своевременная и в полном объеме начатая патогенетически обоснованная терапия, направленная на устранение гемолиза, тромботической микроангиопатии и полиорганной недостаточности, позволяет улучшить эффективность интенсивного лечения и снизить материнскую смертность с 75 до 24,2–3,4% [3].
Алгоритм мероприятий при гемолизе
1. Баркаган З.С. // Вестник интенсивной терапии. – 1992. – № 1. – С.11–16.
2. Зильбер А.П., Шифман Е.М., Вартанова В.Я. // Вестник интенсивной терапии. – 1992. – № 1. – С. 28–31.
3. Рациональная фармакотерапия в акушерстве и гинекологии: руководство для практикующих врачей / под общ. ред. В.И.Кулакова, В.Н.Серова. – М.: Литтерра, 2005.
4. Edelson R.N.,Chernik N.L., Posner A.B. // Arch. Neurol. – 1974. – Vol. 31. – P. 134–137.
5. Esan K., Moniem T., Page I.J. // Brit. J. Gen. Pract. – 1997. – Vol. 47. – P. 441–442.
6. Fitzgerald D.J., Eutman S.S., Mulloy K. et al. // Circulation. – 1987. – Vol. 75. – P. 956–963.
7. Martin J.N., Files J.C., Blake P.G. et al. // Amer. J. Obstet. Gynecol. – 1990. – Vol. 162. – P. 126–137.
8. Martin J.N., Perry K.G., Blake P.G. et al. // Amer. J. Obstet. Gyneсol. – 1997. – Vol. 177. – P. 1011–1017.
9. Pritchard J.A., Weisman R., Ratnoff O.D. et al. // New Engl. J. Med. – 1954. –Vol. 250. – P. 89.
10. Rappaport V.J., Hirata G., Yapp H.K. et al. // Amer. J. Obstet. Gynecol. – 1990. – Vol. 162. – P. 138–146.
11. Sagava N., Kariya M., Kanzaki H. et al. // Obstet. Gynecol. – 1985. – Vol. 65. – P. 761–764.
12. Schwartz M.L. // Obstet. Gynecol. – 1986. – Vol. 67. – P. 136–137.
13. Sibai B.M., Ramadan M.K., Usta I. et al. // Amer. J. Obstet. Gynecol. – 1993. – Vol. 169. – P. 1000.
14. Thiagarajah S., Borgeosis A., Harbert G.M. // Amer. J. Obstet. Gynecol. – 1984. – Vol. 150. – P. 1–7.
15. Van Dam P.A., Renier M., Baekelandt M. et al. // Obstet. Gynecol. – 1989. – Vol. 73. – P. 97–102.
16. Walsh S.W. // Amer. J. Obstet. Gynecol. – 1985. – Vol. 152. – P. 335–340.
Медицинские новости. – 2008. – №14. – С. 40-43.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Содержание »
Архив »
|
|