Особенность современной медицины – быстрое внедрение в диагностический процесс новых технологий. Одна из них – допплеровская визуализация тканей (tissue Doppler imaging – TDI) – новое направление неинвазивной оценки функции миокарда. Сегодня это наиболее интересное и перспективное направление в кардиологии.
Согласно классической теории многослойного строения миокарда, мускулатура желудочков имеет три слоя: наружный косой, средний круговой и внутренний продольный. Наружный слой является общим для обоих желудочков, круговой и продольный – отдельные для каждого. Сокращение наружного косого слоя желудочков вызывает поворот всего сердца вокруг продольной оси вправо. В это время перекрещиваются продольные мышцы, и каждая из полостей желудочков отчетливо делится на два отдела: путь притока и путь оттока. Средний круговой слой мускулатуры желудочков образует в каждом из них ряд отдельных концентрически расположенных колец. При сокращении кругового слоя полости желудочков уменьшаются в диаметре и их наружные стенки движутся внутрь. Волокна внутреннего продольного слоя образуют сосочковые мышцы сердца. По классическим представлениям, функция миокарда заключается в сокращении и расслаблении. Сокращение миокарда приводит к сужению полости и изгнанию крови из желудочков, расслабление – к их расширению и наполнению.
Наряду с классической теорией существует новая концепция строения и функции миокарда, разработанная группой ученых из разных стран. Научно-исследовательская деятельность в данном направлении началась около 20 лет назад, когда испанский патологоанатом F. Torrent-Guasp обнаружил, что сердечная мышца представляет собой один слой миокарда, начало и конец которого образуют аорта и легочная артерия. «Полоса миокарда», свернутая в виде спирали, образует два цикла: базальный и верхушечный, каждый из которых делится на два сегмента. Поочередная активность каждого из четырех сегментов приводит к четырем основным движениям миокарда: сужению, сокращению, удлинению и расширению. При этом движение базальных отделов сердца происходит вверх и вниз вдоль полости желудочков, а верхушечный цикл остается практически неподвижным. Многие аспекты теории однослойного строения миокарда остаются спорными, однако большинство кардиохирургов признали основные положения теории доказанными и правомочными для внедрения в клиническую практику. Для оценки сложного движения сердца в целом, а также его отдельных структур и сегментов и была разработана технология TDI.
В 1961 г. для получения информации о движении сердца были применены допплеровские методы. K. Isaaz et al. в 1989 г. первыми показали возможности импульсно-волнового метода TDI в количественной оценке локальной сократимости миокарда. В 1995 г. M. Uematsu et al. впервые описали внутримиокардиальный градиент, расчет которого позволяет оценивать собственно локальную сократимость независимо от общего движения сердца. В середине 90-х гг. XX в. были созданы ультразвуковые и допплеровские технологии, позволяющие разработать количественный способ анализа движения миокарда. К числу более поздних и наиболее перспективных с клинической точки зрения относится создание режимов изучения локальной деформации миокарда – strain и strain rate, описанных в 1998 г. A. Heimdal.
Технология TDI базируется на принципах, применяемых в обычном допплеровском формировании изображения кровотока. При этом в технологии TDI используются два главных отличия между сигналами, получаемыми от крови и от ткани. Скорости кровотока в полостях желудочков и крупных сосудах сравнительно высоки – 100–150 см/с. В то же время скорость движения миокарда значительно меньше – 5–15 см/с и редко превышает 20 см/с. Кроме того, амплитуда отраженного от миокарда допплеровского сигнала значительно выше амплитуды сигнала скорости от внутрисердечного потока крови. Поэтому для изучения движения миокарда анализируются эхосигналы с низкой скоростью и высокой амплитудой, а эхосигналы от потоков крови с высокой скоростью и низкой амплитудой подавляются с помощью соответствующих фильтров. В TDI анализу подвергаются параметры амплитуды и сдвига частот. Сочетание этих параметров имеет два важных преимущества. Во-первых, их анализ позволяет отделить тканевые структуры от различных артефактов. Во-вторых, технология TDI из множества эхосигналов выделяет закодированное по цвету смещение непосредственно стенки сердца. Благодаря этим преимуществам методом TDI проводится оценка движения стенок сердца и визуально, и количественно с помощью анализа трех параметров: локальной асинхронности движения, направления вектора и скорости движения миокарда [5].
Основной формат изображения, которое анализируется визуально при исследовании пациента и является исходным материалом для дальнейшей обработки полученной информации, – двухмерная TDI (2D-TDI). Это цветовое допплеровское изображение ткани, наложенное на обычное двухмерное изображение в режиме серой шкалы. Цвет каждой точки, как и при обычном допплеровском режиме, кодируется в зависимости от направления движения по отношению к датчику, обладает высоким пространственным разрешением. Метод TDI наиболее информативен при исследовании движения из верхушечного доступа, что позволяет анализировать характер продольного движения миокарда в плоскости луча. TDI отражает суммарную скорость движения миокарда в каждый момент времени. Данная скорость слагается из нескольких разнонаправленных составляющих. Прежде всего это собственно сокращение и расслабление миокарда. В систолу базальные и средние сегменты левого желудочка движутся внутрь полости по направлению к верхушке. Апикальные сегменты также движутся внутрь, но не к основанию сердца, а к условной точке – его геометрическому центру, который расположен между второй и третьей частями длинной оси (69% расстояния от основания до верхушки). Все сегменты желудочка во время систолы движутся к этой точке под разными углами и с разной экскурсией. Наибольшее движение отмечается в основании сердца при почти полном отсутствии движения в апикальных сегментах. В диастолу все сегменты миокарда движутся от центра тяжести левого желудочка. Кроме собственного сокращения и расслабления миокарда, движение сердца обусловлено поступательным перемещением и ротацией в грудной клетке. В систолу сердце ротируется и движется в грудной клетке к датчику, в диастолу – от датчика, при этом верхушка сравнительно малоподвижна, а основание активно смещается к верхушке в систолу и опускается в диастолу [2].
Основные продольные срезы для анализа результатов TDI получают из верхушечного доступа, где стенки желудочков наиболее «параллельны» ультразвуковому лучу. Всего используют три верхушечных стандартных среза: четырехкамерный длинный, длинный левого желудочка с аортой, двухкамерный. Оцениваются движения апикальных и средних сегментов в вышеуказанных срезах, верхушка и прилежащие к ней части верхушечных сегментов не анализируются ввиду сложности получения и трактовки данных.
Все режимы TDI делятся на две группы. К первой относится импульсно-волновой режим TDI (PW TDI) – наиболее изученный и достаточно широко применяемый в практике, ко второй группе – режимы постпроцессинговой количественной обработки двухмерной кинопетли скоростей, полученных в TDI-режимах: Tissue Veloсity Imaging (TVI), Tissue tracking (тканевой след), Strain и Strain rate (деформация и скорость деформации), Tissue Synchronization Imaging (изображение синхронизации ткани).
Импульсно-волновой режим TDI (PW TDI). Как известно, стенка левого желудочка образована продольными и циркулярными мышечными волокнами, причем первые сокращаются раньше [5]. Сокращение миокарда в поперечном направлении осуществляется в основном за счет циркулярно расположенных волокон в среднем слое миокарда, а в продольном направлении – за счет продольных субэндокардиально расположенных волокон. Функция последних в первую очередь нарушается при ишемической болезни сердца (ИБС), так как субэндокардиальные слои миокарда находятся в наиболее неблагоприятных условиях коронарного кровоснабжения [2]. С созданием PW TDI появилась возможность оценить продольную функцию миокарда, выявить ее ранние нарушения. PW TDI позволяет получить количественную информацию о движении практически каждого сегмента миокарда и даже отдельных миокардиальных слоев каждого из сегментов в разных фазах сердечного цикла. Это дает возможность выявлять особенности движения отдельных сегментов сердца при различных патологических состояниях [2, 27]. Настоящим прорывом в диагностике ранних нарушений систолической и диастолической функций желудочков стало использование PW TDI фиброзных колец атриовентрикулярных клапанов (ФК АВК). В ряде научных исследований выявлена высокая корреляция систолической скорости (определяемой при помощи PW TDI) и амплитуды движения ФК АВК с глобальной сократимостью желудочков [1, 4, 13, 16, 17, 29]. Режим PW TDI позволяет также оценить диастолическую функцию желудочков. Доказано, что использование PW TDI не только дает возможность установить стадию диастолической дисфункции и отличить нормальный спектр диастолического наполнения желудочков от псевдонормального, но и помогает дифференцировать патологические нарушения диастолической функции от физиологических возрастных [3, 10, 24]. Совместная оценка кровотока через атриовентрикулярные клапаны и PW TDI фиброзных колец этих клапанов позволяет определить конечный диастолический объем левого желудочка, среднее давление заклинивания в легочной артерии и среднее давление в правом предсердии [10, 19, 21, 26]. Есть данные об использовании PW TDI фиброзного кольца митрального клапана для дифференциальной диагностики патологической и физиологической гипертрофии миокарда левого желудочка [28]. Другая область применения PW TDI фиброзного кольца митрального клапана – дифференцировка рестриктивной кардиомиопатии от констриктивного перикардита [12]. В ряде исследований показано, что при кардиомиопатиях различного генеза PW TDI позволяет выявить доклиническое вовлечение сердечной мышцы в патологические процессы, когда традиционно используемые эхокардиографические параметры находятся в пределах нормы [11, 22, 23]. Высокая чувствительность метода может быть полезна для ранней оценки функции миокарда у здоровых лиц при наличии в анамнезе семейных кардиомиопатий. Таким образом, PW TDI может применяться для диагностики разнообразных патологических состояний:
• ишемии и жизнеспособности миокарда у больных ИБС;
• диастолической дисфункции желудочков;
• физиологической и патологической гипертрофии левого желудочка;
• кардиомиопатий;
• системном поражений сердца (амилоидоз);
• дополнительных путей проведения;
• реакции отторжения пересаженного сердца.
Режимы постпроцессинговой количественной обработки двухмерной кинопетли. TVI. В режиме «off-line» в двухкамерном цветном допплеровском режиме TVI позволяет одновременно выставить необходимое количество контрольных объемов и получить реконструированные кривые изменения скорости движения миокарда на протяжении одного или нескольких последовательных сердечных циклов. Можно оценивать средние скорости движения как различных сегментов миокарда, так и его различных слоев. Основное преимущество режима TVI – возможность реконструирования кривых скорости движения нескольких сегментов или слоев миокарда для одного и того же сердечного цикла [2, 5].
Тканевой след (Tissue Tracking). Позволяет быстро оценить амплитуду продольного смещения миокарда желудочков и других сердечных структур по направлению к его верхушке во время систолы желудочков. Оценка производится из верхушечного доступа шкалой из различных цветов; каждый цвет кодирует определенную амплитуду продольного смещения в систолу желудочков с последующим ее увеличением от цвета к цвету. Данный режим позволяет визуально оценить систолическую функцию миокарда и выявить нарушения локальной сократимости [1, 2, 5].
Деформация и скорость деформации (Strain и Strain rate). Деформация любого трехмерного объекта возникает одновременно во всех трех плоскостях. В систолу желудочков происходит продольное укорочение, радиальное (поперечное) утолщение и циркулярное укорочение волокон. Соответственно стенки миокарда деформируются в трех направлениях: продольном, поперечном и круговом. Strain и Strain rate позволяют оценить состояние миокарда в каждом сегменте стенки сердца. Strain, простой маркер деформации, отражает систолическое изменение толщины или длины сегмента (в %). Strain rate – более сложный показатель. Особенностью этих режимов является их исключительно прикладное значение – только для измерения деформации, которая является функцией объема миокарда, и ее показатели зависят только от локальных изменений объема ткани. Значения Strain и Strain rate стабильны во всех сегментах (в отличие от значений средней скорости движения миокарда от базального до верхушечного сегмента). Данные параметры миокарда в наибольшей степени отражают его продольную сократимость. Использование этих режимов оказалось эффективным для диагностики ранних нарушений у больных артериальной гипертензией [25, 34], сахарным диабетом [8], при аритмогенной дисплазии правого желудочка [14] и амилоидозе [15]. Однако основное клиническое значение параметров деформации заключается в диагностике острой ишемии миокарда и разных форм ишемической дисфункции.
Режим изображения синхронизации ткани (Tissue Synchronization Imaging). Феномен внутрижелудочкового асинхронизма сокращения и релаксации, ранее определявшийся физиологами, в настоящее время оценивается и в клинике. У здоровых лиц имеет место физиологический внутрижелудочковый асинхронизм, так как амплитудные характеристики и временные интервалы движения всех четырех стенок левого желудочка (передняя, задняя, боковая, межжелудочковая перегородка), определяемые методом TDI, существенно различаются ввиду анатомических особенностей строения желудочков, обусловливающих их отличительные механические и насосные свойства. В норме продольное движение правого желудочка более выражено, чем левого, что связано с геометрическим строением правого желудочка и расположением его волокон. Межжелудочковое взаимодействие и межжелудочковый асинхронизм являются ключевыми моментами формирования насосной и сократительной дисфункции миокарда практически при любых сердечно-сосудистых заболеваниях. Понимание механизмов формирования и изменения межкамерных взаимодействий важно для оценки выраженности сердечной недостаточности. Общеизвестно, что асинхронность сокращения миокарда желудочков при нарушениях проводимости (блокады ножек пучка Гиса) приводит к существенному снижению насосной функции сердца с последующим ремоделированием желудочков, нескоординированному сокращению правого и левого желудочков, что ведет к прогрессированию хронической сердечной недостаточности (ХСН). Больным с тяжелыми проявлениями ХСН, выраженной снижением систолической функции и нарушением внутри- и межжелудочковой проводимости в последние годы предлагается проведение ресинхронизирующей терапии, заключающейся в программируемой электрической стимуляции желудочков. В связи с тем что ресинхронизация может быть эффективна только в тех случаях, если существует потенциально корригируемый асинхронизм сократимости, очевидна задача неинвазивной количественной оценки желудочкового асинхронизма [2, 3, 6]. Режим изображения синхронизации ткани позволяет в режиме реального времени с помощью определенной цветовой кодировки идентифицировать интервал от начала комплекса QRS до максимального систолического движения тканей сердца и проводить быстрые количественные измерения этого интервала и сегментарных максимальных систолических скоростей движения [2]. Для оценки внутри- и межжелудочкового асинхронизма с успехом применяются и другие режимы TDI: TVI, Strain и Strain rate [6].
Появление режимов постпроцессинговой обработки цветовой кинопетли стало шагом вперед в развитии метода TDI и открыло новые перспективы для совершенствования методик стресс-эхокардиографии (стресс-ЭхоКГ). Стресс-ЭхоКГ широко используется в клинической практике, однако имеет определенные недостатки: зависимость качества исследования от квалификации врача, качества визуализации эндокарда и, главным образом, субъективности оценки нарушений локальной сократимости миокарда. Предпосылками для использования TDI в стресс-ЭхоКГ являются:
• возможность количественной характеристики локальной диастолической функции миокарда, позволяющей обнаружить ранние признаки преходящей ишемии миокарда, предшествующие систолической дисфункции;
• возможность в ряде случаев улучшить качество визуализации миокарда;
• возможность преодолеть ограничения зрительного анализатора в оценке непродолжительных изменений движения миокарда [5].
Как указывалось выше, метод TDI направлен преимущественно на оценку продольной сократительной функции миокарда, а ведь от ишемии в первую очередь страдают субэндокардиальные волокна, ответственные за продольную сократимость. Стресс-Эхо-КГ зарекомендовала себя как недорогой, достаточно надежный функциональный метод для диагностики в первую очередь ИБС. Количественная оценка нарушений локальной сократимости (НЛС) – одна из многих возможностей метода TDI. В ряде научных исследований показана возможность использования стресс-ЭхоКГ и метода TDI для количественной оценки ишемии миокарда, при этом одни специалисты использовали чреспищеводную стимуляцию сердца как стресс-агент [5], другие – добутамин [9, 32, 33]. При развитии индуцированной ишемии миокарда наблюдаются следующие изменения параметров TVI:
• снижение систолических скоростей движения миокарда;
• появление выраженного постсистолического движения миокарда;
• отсутствие прироста или уменьшения ранней диастолической скорости движения миокарда (ранний признак ишемии).
Наиболее чувствительными оказались показатели режимов Strain и Strain ratе:
• снижение пика систолической скорости деформации или его реверсия;
• положительный компонент изоволюмического сокращения;
• отрицательный компонент изоволюмического расслабления;
• задержка систолического укорочения в фазу изоволюмического сокращения;
• постсистолическое укорочение миокарда;
• снижение пика раннего диастолического удлинения или его реверсия [2].
Для оценки НЛС также может быть использован режим тканевого следа: в сегментах с НЛС снижается амплитуда и, следовательно, скорость движения сегментов, что может быть оценено как визуально, так и количественно. Применение режима тканевого следа при стресс-ЭхоКГ целесообразно для оценки эффекта лекарственной терапии или реваскуляризации миокарда [5].
Диагностика жизнеспособного миокарда при помощи стресс-ЭхоКГ имеет ряд сложностей. В частности, возникают трудности при визуальной оценке сократимости миокарда в сегментах, расположенных на границе инфаркт – здоровый миокард. Движения эндокарда в этих зонах могут быть обусловлены активным сокращением, а также происходить пассивно вследствие подтягивания соседними нормально сокращающимися сегментами («tethering»-эффект) [7, 23]. Основные надежды в выявлении жизнеспособного миокарда и диагностике ишемии миокарда связаны с режимами Strain и Strain rate и заключаются в независимости показателей деформации от общего движения сердца и «tethering»-эффекта. Совместная оценка изменений деформации миокарда в покое и в ответ на введение добутамина позволяет дифференцировать трансмуральное поражение миокарда от нетрансмурального [33, 34]. По изменениям максимальной систолической деформации (Strain) во время стресс-ЭхоКГ с добутамином можно судить о резерве кровотока [2].
Подводя итог вышеописанным несомненным преимуществам применения метода TDI, можно считать его мощной поддержкой основным эхокардиографическим методам исследования функции сердца. Однако, как и любой метод, TDI имеет ряд недостатков и ограничений. Относительная неподвижность верхушки сердца по сравнению с его основанием не позволяет TDI адекватно оценивать движение верхушечных сегментов. Основными ограничениями PW TDI ФК АВК являются выраженные атриовентрикулярные регургитации, кальциноз фиброзных колец, протезированные клапаны. Ограничением режима PW TDI для оценки НЛС является возможность исследования лишь одного сегмента в единицу времени в режиме «on-line» [2, 5]. Существенное влияние общего движения сердца на результаты измерений в некоторых случаях ограничивает более широкое применение режимов тканевого следа и TVI для оценки НЛС. Зависимость от серошкального изображения, уголзависимость, возможность одномоментного анализа только продольной деформации – ограничения режима Strain и Strain rate.
Безусловно, основным недостатком метода TDI в повседневной практике на начальном этапе является трудоемкость измерений и обработки информации. Значения основных параметров TDI уже имеются в литературных источниках, предлагаются также алгоритмы использования различных режимов TDI для решения определенных клинических задач [1, 2, 4, 27]. На рисунке приведен алгоритм применения режимов TDI для оценки результатов стресс-ЭхоКГ, предложенный сотрудниками Левенского Университета (Бельгия) [27].
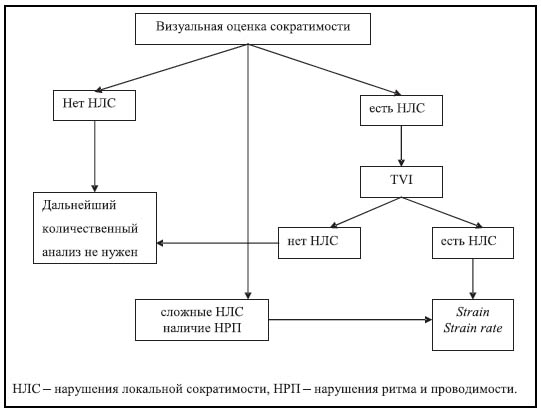
Рис. Алгоритм использования метода TDI для оценки результатов стресс-ЭхоКГ
Процесс внедрения любого диагностического метода в клинику всегда сложен. В случае с TDI он связан, в первую очередь, с техническим переоснащением диагностических отделений. TDI является переходным звеном от чисто функционального классического к новому технологическому уровню диагностики. Возвращаясь к истокам эхокардиографии , следует заметить, что метод TDI в своем становлении является особым этапом развития ЭхоКГ- исследования функции сердца, своеобразным «вторым спиральным уровнем» ультразвукового метода, который первоначально в алгоритме анализа сократимости использовал подходы для исследования радиальной сократимости. Анализ продольной сократимости стал продолжением изучения сократительной функции миокарда на новом уровне, где появляется новая технология и теоретическая база для исследования деформационных свойств миокарда.
В TDI многое еще не изучено. Но сегодня вполне определенно можно утверждать, что этот новый метод, являясь составной частью ЭхоКГ-исследования, дополнит его жизненно важной информацией о сократимости миокарда. Ему предстоит вместе с другими современными технологиями доказать и уточнить многие положения относительно строения и функции миокарда, вызывающие много споров.
1. Алехин М.Н., Сидоренко Б.А. // Кардиология. – 2007. – № 7. – С. 4–11.
2. Алехин М.Н. Тканевой допплер в клинической эхокардиографии. – М.: Инсвязьиздат, 2006.
3. Бокерия Л.А., Скопин И.Н., Голухова Е.С. // Вестник РАМН. – 2005. – № 4. – С. 31–37.
4. Бузнашвили Ю.Н., Гунджуа Ц.А., Асымбекова Э.У. и др. // Клиническая физиология кровообращения. – 2007. – № 1. – С. 33–38.
5. Врублевский А.В., Бощенко А.А.. Карпов Р.С. // Комплексная ультразвуковая оценка атеросклероза грудного отдела аорты и коронарных артерий. – Томск: STT, 2007. – С. 13, 157–159.
6. Никифоров В.С., Лебедев Д.С., Свистов А.С. // Ультразвуковая и функциональная диагностика. – 2006. – № 4. – С. 118–128.
7. Altinmakas S., Dagdeveren B., Uyan C. // Intern. J. Cardiol. – 2000. – Vol. 74. – P. 107–113.
8. Andersen N.H., Poulsen S.H., Eiskjaer H. et al. // Clinical Science. – 2002. – Vol. 105. – P. 59–66.
9. Bibra H., Tuchnitz A., Klein A. et al. // J. Amer. Coll. Cardiol. – 2000. – Vol. 36. – P. 444–452.
10. Bruch C., Marin D., Kunts S. et al. // Z. Kardiol. – 1999. – Vol. 88. – P. 353–362.
11. Dutka D.P., Donnely J.E., Palka P. et al. // Circulation. – 2000. – Vol. 102. – P. 1276–1282.
12. Garcia M., Rodrigues L., Ares M. et al. // J. Amer. Coll. Cardiol. – 1996. – Vol. 27. – P. 108–114.
13. Gulati V.K., Katz W.E., Follancsbee W.P. et al. // Amer. J. Cardiol. – 1996. – Vol. 77. – P. 979–984.
14. Hebrots L., Kovalski M., Vanhaeske J. et al. // Eur. J. Echocardiography. – 2003. – Vol. 4. – P. 101–107.
15. Koyama J., Ray-Sequin P.A., Falk R.H. // Circulation. – 2003. – Vol. 107. – P. 2446–2452.
16. Melusin J., Spiranova L., Bakala J. et al. // Eur. Heart J. – 2001. – Vol. 22. – P. 340–348.
17. Melusin G., Spiranova L., Dusek L. et al. // Eur. J. Echocardiography. – 2003. – Vol. 22. – P. 263–271.
18. Merli E., Sutherland G.R. // Eur. Heart J. – 2004. – Vol. 25. – P. 1477–1479.
19. Nageh M.F., Kopelen H.A., Zoghbi W.A. et al. // Amer. J. Cardiol. – 1999. – Vol. 84. – P. 1448–1451.
20. Nagueh S.F., Bachinski L.L., Meyer D. et al. // Circulation. – 2001. – Vol. 104. – P. 128–130.
21. Nagueh S.F., Middleton K.J., Kopelen H.A. et al. // J. Amer. Coll. Cardiol. – 1997. – Vol. 30. – P. 527–533.
22. Pieroni M., Chimenti C., Ricei R. // Circulation. – 2003. – Vol. 107. – P. 1978–1984.
23. Rambaldi R., Poldermans D., Bax J.J. et al. // Eur. Heart J. – 2000. – Vol. 21. – P. 1091–1098.
24. Sohn D.W., Chai J.H., Lee D.J. // J. Amer. Coll. Cardiol. – 1997. – Vol. 30. – P. 1474–1480.
25. Stoylen A., Slordahl S., Skjelvan G.K. // J. Amer. Soc. Echocardiology. – 2001. – Vol. 14. – P. 264–274.
26. Sundereswaran L., Nagueh S.F., Vardan S. et al. // Amer. J. Cardiol. – 1998. – Vol. 82. – P. 352–357.
27. Sutherland G.R., Hatle L., Rademakers F. E. et al. Doppler myocardial imaging. – Leuven University Press, 2003.
28. Vinereaunu D., Floresen N., Sculthorpe N. et al. // Amer. J. Cardiol. – 2001. – Vol. 88. – P. 53–58.
29. Vinereaunu D., Khokhar A., Tweddel A.L. et al. // Echocardiography. – 2002. – Vol. 19. – P. 177–185.
30. Voight J.U., Lindenmeier G., Exner D. et al. // J. Amer. Soc. Echocardiography. – 2003. – Vol. 16. – P. 415–423.
31. Weidemann F., Dommke C., Bijnenes B. et al. // Circulation. – 2003. – Vol. 107. – P. 2883–2888.
32. Wilkenshoff U.M., Sovany A., Wingstrom L. et al. // J. Amer. Soc. Echocardiography. – 1998. – Vol. 11. – P. 683–692.
33. Yamada E., Garcia M., Thomas J.D. et al. // Amer. J. Cardiol. – 1998. – Vol. 82. – P. 806–809.
34. Yuda S., Short L., Leano R. et al. // Clinical Science. – 2002. – Vol. 103. – P. 283–293.
Медицинские новости. – 2008. – №7. – С. 68-72.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.