Инфекции нижних отделов половых путей вызываются в большинстве случаев условно-патогенными микроорганизмами (включая грибы) при появлении условий для превалирования роста одного из видов, в норме колонизирующих слизистую влагалища. Несмотря на значительные успехи в диагностике и лечении урогенитальных инфекций, они продолжают занимать первые места в структуре акушерско-гинекологической заболеваемости и смертности, кроме того, часто приводят к инфицированию плодного яйца, плода и новорожденного.
Любое нарушение вагинального микроценоза с подавлением роста Lactobacillus или изменения, способствующие подавлению их кислотообразующей функции, могут привести к развитию неспецифического или кандидозного кольпита, бактериального вагиноза, общим и ведущим симптомом которых являются патологические бели.
Одним из основных барьеров на пути инфекции являются микробные ассоциации нормальной микрофлоры человека. Их роль заключается в создании биологической защиты от патогенных микроорганизмов. Нарушение баланса между представителями микробиоценозов приводит к возникновению источника инфекции в самом организме. В то же время полное подавление нормальной микрофлоры резко снижает колонизационную резистентность микроэкологических ниш и делает эти участки практически беззащитными перед любыми микроорганизмами.
Существование экосистемы влагалища предполагает наличие как в норме, так и при патологии нескольких видов микроорганизмов, представляющих его биотоп. Таким образом, классический постулат «один микроб — одно заболевание» не находит подтверждения даже при специфических инфекциях. При бактериологическом исследовании выявляются полимикробные ассоциации, включающие как бактерии, так и вирусы, меняющиеся на протяжении жизни женщины и при инфекционных заболеваниях. В понимании механизмов естественного барьера для инфекционных осложнений важен термин «колонизационная резистентность влагалищного биотопа». Это совокупность механизмов, поддерживающих стабильность популяционного и количественного состава компонентов нормального микробиоценоза.
Одним из наиболее сложных аспектов диагностики и лечения инфекций нижних отделов половых путей является полиморфизм возбудителей, частое наличие микст-инфекций и их вариабельность. В конце прошлого столетия в списке болезней, передаваемых половым путем, было свыше 20 наименований [1, 5].
В последние годы активно обсуждается вопрос о целесообразности недифференцированной терапии у больных с подозрением на заболевания, передаваемые половым путем, о способах ее проведения, выборе препаратов и дозы. Представляется рациональным при первом же обращении больных и взятии у них анализов назначать недифференцированную терапию, что позволяет сократить сроки не только обследования, но и достижения субъективного и клинического выздоровления. Вместе с тем, на наш взгляд, не менее важным является вопрос о предродовой недифференцированной терапии и профилактике инфекционных осложнений у беременных.
Заболевания, вызванные смешанной инфекцией, имеют более длительное течение, часто рецидивируют, при необходимости выполнения диагностических процедур на фоне микст-инфекции чаще возникают различные осложнения. При смешанной инфекции, особенно при хронизации процесса, добиться стойкого излечения довольно сложно. У 80% женщин, обращающихся в женскую консультацию с различными видами вульвовагинитов, цервицитов и уретритов, выявляется смешанная бактериально-грибково-вирусная инфекция. По различным данным [7], сочетание хламидиоза и анаэробной контаминации встречается в 14 — 24%, хламидиоза и трихомониаза — в 5 — 10% случаев. Микоплазменная инфекция в виде моноинфекции отмечается лишь в 12% случаев заболеваний, тогда как в ассоциации с вирусной и грибковой флорой — в 87 — 90%. Ассоциация хламидиоза и герпетической инфекции достигает 18 — 20%. Вагинальный кандидоз нередко сочетается с хламидиозом (13 — 15%).
Возбудителем инфекционно-воспалительных заболеваний мочеполовых органов является большая группа бактерий и вирусов. Кроме агентов, входящих в состав инфекций, передаваемых половым путем, наиболее значимыми являются условно-патогенные микроорганизмы. Такие строгие анаэробы, как бактероиды, фузобактерии, пептострептококки, эубактерии, вейлонеллы, в подавляющем большинстве случаев встречаются в ассоциациях с факультативно-анаэробными микроорганизмами, микроаэрофилами (коринебактериями, клебсиеллами, другими энтеробактериями, кампилобактериями). Микробные ассоциации являются поливалентными этиологическими агентами. В зависимости от количества и состава возбудителей, их доли среди других микроорганизмов, симбиотически-антагонистических отношений между различными представителями микрофлоры, факторов вирулентности значительно варьируют патогенность, клинические проявления и чувствительность к антибиотикам каждого конкретного набора возбудителей.
При этом нередко обнаруживается сочетанная инфекция нижних отделов половых путей, особенно у беременных женщин. Они очень уязвимы в плане проникновения и активации возбудителей хронической внутриматочной инфекции, так как при беременности отмечается тенденция к активации резидентных микроорганизмов из-за сдвига баланса половых гормонов. В результате изменения иммунного и гормонального статусов у беременных во влагалище создаются благоприятные условия для роста бактериальной флоры. При беременности наблюдается снижение активности фагоцитов, Т-клеток, снижение содержания антител (IgA) в цервикальном канале, что приводит к нарушению системы защиты от персистирующего высокого обсеменения бактериальной микрофлорой. Изменяется значение рН (>4,5), повышается содержание гликогена, накапливается в свободном виде глюкоза. Все эти факторы способствуют тому, что у беременных в 2—4 раза чаще, чем у небеременных, развиваются вульвовагиниты [2].
Если родоразрешение происходит на фоне вульвовагинита, то отечные, воспаленные ткани промежности и влагалища плохо поддаются растяжению — наблюдается высокая частота их травм (включая профилактические разрезы промежности: эпизио- и перинеотомии). В послеродовом периоде нередки инфекционные осложнения: нагноение, расхождение, вторичное заживление травм влагалища и промежности. Таким образом, лечение вульвовагинитов у беременных является важным фактором профилактики инфекционных осложнений травм промежности.
Своевременная санация беременной предотвращает инфицирование плода, его патологические состояния. Терапия должна проводиться с учетом характера возбудителя и его чувствительности к препарату, фармакокинетики применяемых средств, срока беременности на момент лечения.
Используемые при плановом обследовании беременных и госпитализации для родоразрешения бактериоскопические методы изучения характера флоры цервикального канала не всегда дают адекватную информацию.
Нами выполнен сравнительный анализ результатов частоты инфекционных и травматических осложнений после родов у 120 женщин. Перед родоразрешением проводилось традиционное обследование пациенток, дополнительно определялась степень чистоты влагалища.
При микроскопическом исследовании отделяемого половых путей только у 74 (62%) женщин в сроке беременности 37—39 недель с «хорошими» мазками была выявлена I—II степень чистоты влагалищного секрета. Высокая частота выявляемости III степени чистоты влагалищной флоры (IV степень определялась относительно редко: 6 случаев) связана, на наш взгляд, с выраженной частотой хронических воспалительных процессов половых органов. При таком характере течения воспаления число лейкоцитов оказалось невысоким, и результаты бактериоскопического исследования были отнесены к «хорошим» мазкам. Высокая частота выявляемости грибковой флоры подтверждает тенденцию к щелочной среде у этих пациенток.
Необходимо отметить, что подавляющее большинство осложнений имело место у женщин с III степенью чистоты влагалищной флоры при «хороших» мазках. Это свидетельствует о том, что используемые в повседневной практике методы обследования пациенток перед проведением внутриматочных манипуляций различного рода недостаточно информативны. Детальное обследование на весь спектр инфекций, передаваемых половым путем, стоит достаточно дорого и требует времени. Перед родами этого времени просто нет. В силу вышеперечисленных обстоятельств недифференцированная профилактика экономически обоснована как для пациентки, так и для бюджета в целом (если осложнения требуют лечения в условиях стационара).
Таким образом, к различным группам риска по развитию инфекционных осложнений после родов относятся около 40 % беременных женщин в сроке 37—39 недель гестации.
Проблема выбора метода лечения очень актуальна. Продолжается поиск наиболее клинически эффективных и безопасных средств для профилактики и терапии инфекционных заболеваний половых путей у беременных. Следует подчеркнуть, что своевременная профилактика и лечение нарушений микроценоза влагалища и кишечника способствуют формированию нормальной микрофлоры новорожденного и снижению в 2,5—4 раза частоты инфекционно-воспалительных заболеваний у детей в первые месяцы жизни.
Выбор «идеального» противомикробного препарата, рекомендуемого для лечения инфекций нижних отделов урогенитального тракта у беременных, базируется на ряде требований: препарат должен обладать широким спектром действия; не должен нарушать функциональную активность лактобацилл и подавлять их биологический цикл; в состав препарата не должны входить антибиотики, вызывающие системный эффект; применение препарата должно быть возможно в различные сроки беременности без побочных эффектов для матери и плода; препарат должен отличаться хорошей переносимостью.
При невозможности проведения полного комплекса диагностики и лечения необходима экстренная профилактика инфекционных осложнений перед родоразрешением в амбулаторных условиях.
Преобладание у женщин при воспалительных заболеваниях во влагалище микст-инфекции (смешанной флоры) предполагает применение препаратов широкого спектра действия. Безусловно, предпочтительным при решении проблемы профилактики восходящих вагинальных инфекций является местный или локальный путь использования санационных препаратов. Такой путь введения позволяет не только уменьшить фармакологическую нагрузку на организм женщины, но и избежать возникновения явлений непереносимости, в том числе аллергических реакций. Местное применение антисептических препаратов, эффективно деконтаминирующих слизистые, необходимо также при невозможности быстро верифицировать возбудителя воспалительного процесса.
Спектр микроорганизмов, выделенных из цервикального канала, соответствовал бактериальному спектру влагалища у каждой женщины [2]. Все бактерии относились как к патогенным, так и к условно-патогенным микроорганизмам. Подавляющее большинство бактерий выделено из нижней трети цервикального канала. Бактериальная обсемененность канала шейки матки резко снижалась по направлению к ее полости. Это свидетельствует о необходимости санации влагалища как источника возможного восходящего инфицирования при родоразрешении.
Нами был проведен анализ эффективности профилактики инфекционных осложнений средствами местной терапии перед родами. Для этих целей мы применяли препарат «Бетадин».
Бетадин представляет собой антисептик, который является комплексным соединением йода и поливинилпирролидона — инертного синтетического полимера, выполняющего роль носителя. Все фармакологические свойства препарата связаны с действием йода. Достигая клеточной стенки, комплекс повидон-йода высвобождает свободный йод, бактерицидное действие которого на прокариоты развивается в течение 10—60 с [9, 13]. Пролонгированный эффект бетадина хорошо контролируется клинически, так как образовавшийся на тканях тонкий окрашенный слой сохраняется до тех пор, пока из соединения не высвободится весь йод. Бактерицидный, фунгицидный и прочие механизмы его действия основываются на высокой окислительной способности свободного ионизированного йода. Интрацеллюлярно йод блокирует систему транспорта электронов в цитоплазматической мембране бактерий. Ферментативная активность бактериальных белков теряется в результате изменения их структуры после взаимодействия йода с аминокислотами, содержащими сульфгидрильные и гидроксигруппы.
История применения йодофоров насчитывает более 100 лет. В отличие от спиртовой настойки йода, которая может вызвать ожог, раствор повидон-йода отличается хорошей переносимостью и не характеризуется аллергизацией даже при длительном приеме [10, 14], не вызывает отека и раздражающего действия. Комплексная молекула повидон-йода имеет большой размер, поэтому плохо проникает через биологические барьеры. Благодаря этому системные эффекты йода практически не проявляются.
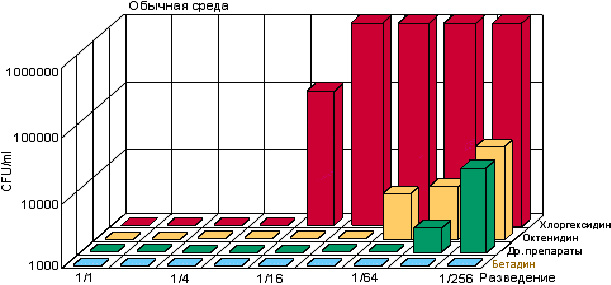
Бетадин вызывает асептический эффект даже при очень больших разведениях, в частности 1:256 (рис. 1). Поэтому его концентрации при применении могут варьировать в зависимости от чувствительности пораженных тканей. Без разведения, в виде оффицинального 10% раствора бетадин применяется для обработки кожи и слизистых перед инвазивными вмешательствами, родами; для обработки мелких ссадин, ожогов, пупочной ранки новорожденных с экспозицией 2 мин; при лечении гнойничковых заболеваний кожи; при асептическом ведении или лечении инфицированных ран в разведении 1:2 (5% раствор). Для местного лечения вирусных поражений применяется концентрированный 10 % раствор, слизистых оболочек глаз – по 2—3 капли в разведении 1:2 —1:4 (2,5 — 5% раствор).
 |
 |
|
Рис. 1. Влияние разведения на эффективность различных антисептиков [14]. CFU — Colony Forming Unit (колониеобразующие единицы)
|
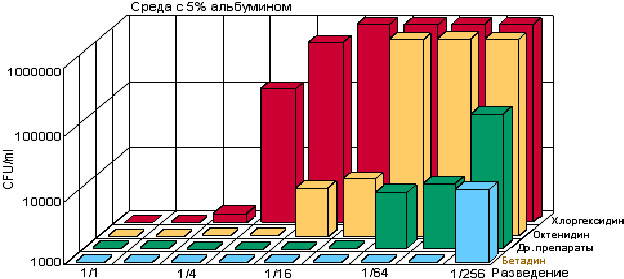
Рис. 2. Влияние разведения и 5% альбумина на эффективность различных антисептиков [14]
|
Физико-химические условия в ране и очаге воспаления (pH, белок, кровь, ферменты) мало влияют на действие бетадина (рис. 2).
Противомикробная активность бетадина охватывает весь значимый при генитальных инфекциях спектр микроорганизмов: грамотрицательные бактерии, включая Neisseria gonorroeae, кишечную палочку, грамположительные аэробные и многие анаэробные бактерии, микобактерии, различные виды грибов (вызывает спороцидный эффект), вирусы, трихомонады и Treponema pallidum (табл. 1). При этом бетадин не оказывает супрессивного влияния на лактобациллы [6, 14].
Спектр действия бетадина
Бактериальные микроорганизмы
|
Небактериальные микроорганизмы
|
Грамотрицательные бактерии
|
|
Aerobacter aerogenes
Bacteroides spp.
Citrobacter spp.
Edvardsiella spp.
|
Cryptococcus neoformans
Epidermophyton floccosum
Microsporon audouni
Nocardia
Penicillum
Pityrosporon ovale
Saccharomyces carlsbergensis
Trichophyton
|
Грамположительные бактерии
|
|
Corinebacterium
Diplococcus pneumoniae
Diphteroides
Micrococcus flavus
Sarcina lutea
Staphylococcus
|
Rubivirus Influenzaevirus
|
Кислоторезистентные бактерии
|
|
|
|
Entamoeba histolytica
Trichomonas vaginalis
|
|
|
|
|
Доказана высокая эффективность бетадина в местной терапии герпетических поражений слизистых оболочек [16]. Исследования в отношении папилломавируса, являющегося во многих случаях причиной дисплазии и неопластических процессов шейки матки, показали высокую активность повидон-йода в профилактике передачи вирусной инфекции половому партнеру [17]. Широкий спектр действия препарата, включающий энтеро- и аденовирусы, вирусы герпеса, грибы рода кандида, трихомонады, позволяет использовать его в акушерско-гинекологической практике при микст-инфекциях.
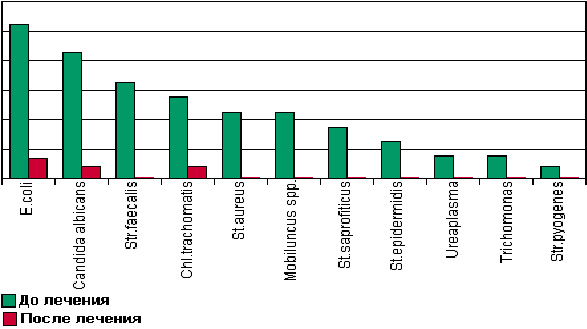
В течение многих лет различные формы бетадина используются в стационарной гинекологии. За это время накоплен большой опыт его клинического применения (рис. 3). Бетадин используют для монотерапии, как правило, в виде вагинальных суппозиториев 1 раз в сутки на протяжении 5—7 дней или проводят санацию влагалища 10% раствором.
 |
|
Рис. 3. Результаты бактериологического исследования больных до и после лечения вагинальными суппозиториями бетадина [4]
|
Результаты многочисленных исследований во всем мире доказывают, что применение бетадина у женщин эффективно не только при амбулаторном лечении инфекционной патологии влагалища, но и при предоперационной профилактике осложнений инфекционного генеза. Препарат достоверно снижает риск развития послеоперационных осложнений, успешно помогает справляться с немотивированной гипертермией в послеоперационном периоде [11].
Опыт использования антисептиков, в частности бетадина, накоплен и в нашей стране. Опубликованы результаты масштабного исследования в рамках региональной программы профилактики инфекционных осложнений при внутриматочных вмешательствах. Показана высокая эффективность бетадина для предманипуляционной подготовки при внутриматочных вмешательствах лечебного и диагностического характера [3].
Белорусские исследователи [8] сообщают об убедительных результатах применения бетадина для лечения смешанных вагинальных инфекций у беременных в I триместре. Оценка эффективности терапии проводилась через 7—8 суток. Критериями излеченности считались субъективная оценка пациентки, уменьшение влагалищных выделений и нормализация бактериоскопической картины при контрольном исследовании мазка. В группе беременных, у которых применяли бетадин, клиническая излеченность смешанных инфекций достигала 91%, что совпадает с данными литературы [3, 6, 9, 12].
Авторами делается вывод о том, что топическое применение бетадина — эффективный и безопасный метод лечения вагинальных инфекций у беременных в I триместре. Санация бетадином приводит к эффективной эрадикации гарднерелл, кандид, сопровождается ликвидацией воспалительной реакции. Широкий спектр антибактериальной, антивирусной, антифунгальной активности в сочетании с отсутствием побочного влияния на эмбрион позволяет считать бетадин препаратом выбора в лечении вагинальных инфекций в I триместре беременности.
G. Gimes et al. [12] доказали отсутствие влияния повидон-йода на функцию щитовидной железы плода в I триместре и относительную безопасность местного применения в другие сроки, за исключением случаев преждевременных родов. В своем исследовании авторы убедительно показали эффективность суппозиториев бетадина в лечении бактериального вагиноза и грибковых инфекций влагалища у беременных.
Правомерен вопрос: может ли йод, абсорбировавшийся со слизистой влагалища, влиять на функцию щитовидной железы плода? 80 беременных женщин с кольпитом получали лечение суппозиториями бетадина в течение 7 дней в сроке 37—40 гестационных недель с превосходным терапевтическим результатом. Уровни тиреоидных гормонов были измерены в сыворотке новорожденных спустя 4—5 дней после рождения, никаких отрицательных отклонений не обнаружено.
Авторы рекомендовали 7-дневное интравагинальное назначение суппозиториев бетадина для профилактики внутриматочных инфекций, лечения смешанных (бактериальных, грибковых) влагалищных инфекций и восстановления нормального биоценоза влагалища, так как риск гипотиреоза у зрелых новорожденных мал. В случае недоношенности гипотиреоз встречается чаще (независимо от лечения йодсодержащими препаратами), поэтому у таких новорожденных контроль уровня гормонов щитовидной железы рекомендуется в любом случае.
В эти же сроки беременности для профилактики септических осложнений после операции кесарево сечение бетадин использовали интравагинально. Наряду с хорошими результатами по снижению послеоперационных осложнений различной локализации отмечено отсутствие каких-либо осложнений, связанных с использованием этого препарата, как для матери, так и для плода и новорожденного [15].
Анализ родового травматизма у женщин, получавших предродовую санацию, позволил установить, что в основной группе родовой травматизм наблюдался у 14 (17,5±4,2%) пациенток: разрывы промежности I степени — в 6 (7,5±2,9%) случаях, разрывы промежности II степени — в 2 (2,5±1,7%), разрывы влагалища — в 6 (7,5±2,9%). В то же время в группе сравнения (без предродовой санации влагалища) родовой травматизм наблюдался в 16 (53,3±9,1%) случаях: разрывы промежности I степени — у 7 (23,3±7,7%), II степени — у 3 (10,0±5,5%), разрывы влагалища — у 6 (20,0±7,3%) женщин.
Темпы и характер заживления ран в послеродовом периоде также различались в обследованных группах. Среди родильниц основной группы с травмой промежности заживление ран первичным натяжением произошло у всех 8 пациенток, в то время как в группе сравнения у 4 женщин наблюдали инфильтрацию, гиперемию раны промежности, у 2 — частичное расхождение раны, у 2 — полное расхождение раны и заживление вторичным натяжением.
Проведенные исследования подтверждают высокую частоту травм промежности и инфекционных осложнений при заживлении ран промежности у несанированных беременных, что диктует необходимость профилактики этой патологии до родоразрешения. Бетадин оказался высокоэффективным препаратом. Отсутствие влияния на нормальную микрофлору влагалища позволяет широко использовать данное лекарственное средство для подготовки к инвазивным вмешательствам в акушерстве и гинекологии без риска возникновения дисмикробиоценоза вагинальной микрофлоры.
На основании проведенного исследования сформулируем следующие выводы:
1. Бетадин безопасен и не противопоказан к применению у беременных и родильниц.
2. Вагинальные суппозитории бетадина практически не вызывают побочных эффектов и аллергических реакций.
3. Высокая эффективность бетадина и отсутствие резистентности к препарату позволяет широко применять его в акушерско-гинекологической практике для профилактики и лечения инфекционно-воспалительных заболеваний влагалища у беременных женщин и для неспецифической профилактики при проведении внутриматочных вмешательств.
4. Применение этого препарата является эффективным способом профилактики септических осложнений после родов через естественные родовые пути, а также после оперативного родоразрешения.
5. Предродовая профилактика снижает частоту возникновения в родах травматического повреждения тканей родового канала и улучшает результаты заживления послеродовых травм.
6. Бетадин доступен по цене, является экономически обоснованным как препарат выбора для предродовой санации в амбулаторных условиях и в акушерских стационарах за счет снижения последующих затрат на лечение послеродовых или послеманипуляционных осложнений.
Литература
1. Адаскевич В.П. Заболевания, передаваемые половым путем. – Витебск, 1997.
2. Грищенко О.В., Яковлева Т.А., Сторчак А.В. // Репродуктивное здоровье женщины. —2005. —№ 2 (22). — С. 72—74.
3. Занько С.Н. // Мед. новости. —2005. — № 3. – С.52—59.
4. Захарова Ю.В. и др. // Актуальные вопросы современной медицины. – 1997. – Т.1. — С. 406.
5. Панкратов В.Г. // Рецепт. — 2004. —№ 5. — С. 119—127.
6. Потапов В.А., Сирокваша Е.А., Рубан Н.К., Гринченко Т.Н. // Репродуктивное здоровье женщины.— 2005. — № 1. — С.219—222.
7. Радзинский В.Е., Пиддубный М.И., Багаева Т.В. и др. // Гинекология. — 2002. — Т.4, № 2. — С.1—3.
8. Сафина М.Р., Солошкина Д.А. // Мед. новости. — 2006. — № 7. – С. 74—76.
9. Тютюник В.Л. // Фарматека. — 2005. — № 2.—С.20—24.
10. Bercelman R.L., Holland B.W., Anderson R.L. // J. of Clin. Microbiology. —1982.—N 4. —P.635—39.
11. Eason А. et al. // Amer. J. of Obstetr. and Gynecol. —1997.—V.176. —P.1011—1016.
12. Gimes G., Peter F. // Acta pharmaceutica Hungarica: A Magyar Gyogyszereszeti Tarsasag folyoirata. — 1997.—V. 67, evf. 6. — P. 249—253.
13. Lacey R.W., Catto A. // Postgrad. Med. J. —1993.—V.69. — P.78—83.
14. Michel D., Zach G.A. // Dermatology. — 1997. —V.195 (Suppl. 2). — P.36—41.
15. Rossali V. S., Zurawski J. // Оbstetrics & Gynecology. —2005. —V. 105. —P. 1024—1029.
16. Simmons A. // Dermatology. —1997. —V. 195, Suppl. l2. —P.85—88.
17. Socal D.S., Hermonat P.L. // Sex. Transmis. Diseases. —1995. —V.22 (1). — P.22—24.
Медицинские новости. – 2007. – №13. – С. 15-20.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.