Вопросы инактивации ВИЧ в биологических жидкостях наряду с высококачественной диагностикой имеют огромное значение в обеспечении безопасности трансфузий крови, ее компонентов и биопрепаратов, получаемых из продуктов крови. Большинство развитых стран достигли значительных успехов в отношении инактивации ВИЧ в крови и ее продуктах и тем самым исключили возможность передачи вируса при гемотрансфузиях. Однако несвоевременное внедрение передовых методов диагностики и инактивации ВИЧ в крови и ее продуктах, например в концентратах факторов свертывания крови, в США, Франции, Испании и других государствах привело к инфицированию вирусом 50—90% больных гемофилией А и В. В настоящее время интенсивно ведется поиск препаратов-микробицидов, инактивирующих ВИЧ, для предотвращения его половой передачи.
Растет интерес к изучению методов инактивации ВИЧ с целью получения конформационно и функционально целостных вирионов, которые можно использовать для разработки терапевтической вакцины, исследований патогенеза вируса, а также других аспектов ВИЧ-инфекции.
Все методы инактивации ВИЧ в зависимости от используемого инактивирующего агента условно можно разделить на физические, химические и их сочетание.
Влияние физических факторов на инактивацию ВИЧ
Действие ультрафиолетового (УФ) облучения на ВИЧ. Первые попытки инактивации ВИЧ были предприняты практически сразу же после выделения вируса и доказательства его этиологической роли в развитии ВИЧ-инфекции в 1983 г. [4, 15]. После определения основных групп риска и механизмов передачи вируса (половой, с кровью и ее продуктами, от инфицированной матери ребенку) разработка способов инактивации стала более целенаправленной.
Широкое применение в медицинской практике ультрафиолетового излучения способствовало тому, что данный метод был одним из первых, который апробировали для инактивации ВИЧ.
J.R. Carlson [6] изучал инактивирующее действие УФ облучения (254 нм) на ВИЧ-1, штамм HTLV-III (human T-lymphotrophic virus type III). Для этих целей был использован источник ультрафиолетового света Virotechnology, Inc. (Швеция). Прибор ранее успешно применяли для инактивации бактерий и вирусов Staphylococcus aureus, E. coli, ECHO 2 в воде, сыворотке и плазме крови. Для инактивации ВИЧ первичные лимфоциты, выделенные из периферической крови здоровых доноров, инфицировали вирусом и затем облучали УФ в дозе 1,4·106 мВт/cм2. Обработанные ультрафиолетом лимфоциты периферической крови и инфицированные, необработанные клетки сокультивировали с перевиваемой культурой лимфобластоидных клеток HUT-78. О наличии вируса судили по наличию цитопатического действия ВИЧ-1 (образованию синцитиев) и по определению обратнотранскриптазной активности. Как показали исследования, на протяжении всего времени наблюдения (30 дней) вирус не удавалось определить обоими методами. Однако авторы указывали на необходимость дальнейших исследований в отношении установления оптимальной дозы и времени облучения, а также возможности дополнительного использования химических реагентов с целью достижения синергического эффекта при инактивации вируса двумя этими способами (ультрафиолетовое облучение и химические вещества).
Количественную оценку воздействия разных доз УФ облучения на инфекционную активность ВИЧ-1 провели H.N. Nakashima et al. [32]. В своих экспериментах они использовали ультрафиолетовую лампу фирмы Toshiba (Япония) и ВИЧ-1 штамма HTLV-III, который накапливали в перевиваемой культуре лимфобластоидных клеток Molt-4. Вируссодержащую культуральную жидкость освобождали от клеток и клеточного дебриса центрифугированием и последующей ультрафильтрацией через фильтры размером 0,22 мкм. Полученный таким образом супернатант вируссодержащей культуральной жидкости помещали в открытые пластиковые чашки Петри и облучали разными дозами УФ света с длиной волны 254 нм: 100, 200, 500, 1000, 2000 и 5000 J/m2. Эффективность инактивации оценивали с помощью методов иммунофлюоресценции (МФА), по пролиферативной активности облученных и необлученных клеток, а также с помощью метода образования бляшек. В результате показано, что инактивация ВИЧ с помощью УФ облучения имела строгий дозозависимый эффект, а полная инактивация вируса происходила после облучения дозой 5000 J/m2. В то же время при использовании дозы 2000 J/m2 авторы получили клон вируса, обозначенный UV-1, который оказывал необычное цитопатическое действие в культуре лимфобластоидных клеток МТ-4, морфологически проявляющееся в формировании «баллонов». Антигенные свойства клона UV-1 не отличались от необлученного HTLV-III.
Несмотря на эффективность дозы УФ-облучения в 5000 J/m2, ученые сделали вывод о необходимости поиска альтернативных немутагенных методов инактивации вируса, особенно в отношении обеззараживания продуктов крови.
То, что малые дозы УФ облучения могут активировать вирус, было показано C. Cavard et al. [8] на трансгенных мышах, содержащих ген lacZ. При облучении таких мышей УФ в дозах 0,1 J/m2 при длине волны 280—320 нм и 2 J/m2 при длине волны 254 нм отмечали значительную продукцию белка β-галактозидазы, за синтез которого ответствен ген lacZ. Авторы указывали на возможное непосредственное воздействие на кератиноциты или опосредованное усиление секреции внеклеточных факторов после УФ облучения, которые могут активировать транскрипцию ВИЧ-1 в клетках другого типа.
Воздействие температуры на ВИЧ. После первых документированных случаев передачи ВИЧ при переливании крови и ее продуктов [10, 14, 43] возникла острая необходимость в поиске простого, но эффективного способа элиминации или дезактивации вируса. Так как оболочка вируса представляет собой бислой липидов и протеинов и потенциально чувствительна к повышению температуры, высказано предположение о возможности инактивации ВИЧ воздействием температуры. Исследования выполнялись несколькими группами ученых и были получены сходные данные [11, 13, 30, 37]. Инактивацию вируса проводили в биологических жидкостях (сыворотка и плазма крови), вируссодержащей культуральной жидкости и лиофилизированном материале. Степень инактивации вируса оценивали с помощью ловушечного иммуноферментного анализа на антигены ВИЧ. В первом случае снижение концентрации вируса на lg достигалось через 24—30 с при прогревании вируса при 56—60оC независимо от среды, в которой ВИЧ находился (вируссодержащая культуральная жидкость, сыворотка, жидкий фактор VIII свертывания крови и фактор свертывания крови в стабилизаторе – 50% сахарозе и 2М глицине) [30]. В лиофилизированных препаратах факторов свертывания крови VIII и IX снижение концентрации вируса на lg достигалось через 32 мин при 60оС, а полная инактивация ВИЧ с инфекционным титром 105.26 происходила через 20 ч при температуре 60оС [13, 42]. Так как стабильность лиофилизированных функционально значимых белков (таких как иммуноглобулины и ферменты) при данной температуре значительно выше (измеряется несколькими днями), был сделан вывод о возможности использования тепловой обработки продуктов крови с целью элиминации ВИЧ. Примерно такие же результаты получены и при инактивации ВИЧ с инфекционным титром 105 в препарате антитромбина III (АТ-III), содержащем стабилизаторы цитрат и сахарозу. При обработке АТ-III в течение 3 мин, 8 мин, 30 мин и 6 ч, 10 ч и 16 ч при температуре 60оС полная инактивация вируса происходила уже через 30 мин. Однако учитывая, что вирус гепатита В более устойчив, чем ВИЧ, авторами был рекомендован режим обработки АТ-III при 60оС в течение 10 ч. Эффективность метода подтверждена и в опытах in vivo [40]. В настоящее время для обеззараживания продуктов крови разработаны методы, сочетающие комбинацию нескольких этапов удаления вирусов различными способами: тепловая обработка, γ-излучение, ионообменная хроматография, фильтрация [3].
Влияние химических факторов на инактивацию ВИЧ
Химические факторы широко применялись и применяются в настоящее время для инактивации ВИЧ с разными целями, но в основном для освобождения крови от ВИЧ и других «кровяных» вирусов (гепатитов В, С, вирусов герпетической группы).
Действие этанола на ВИЧ. Влияние этанола на степень инактивации ВИЧ хорошо изучено на примере приготовления γ-глобулина из пулированной донорской плазмы крови [16]. Препарат готовили методом фракционирования по Kistler & Nitschmann и Cohn & Oncley [9, 24, 34].
Схематически процесс фракционирования плазмы крови представлен на рисунке.
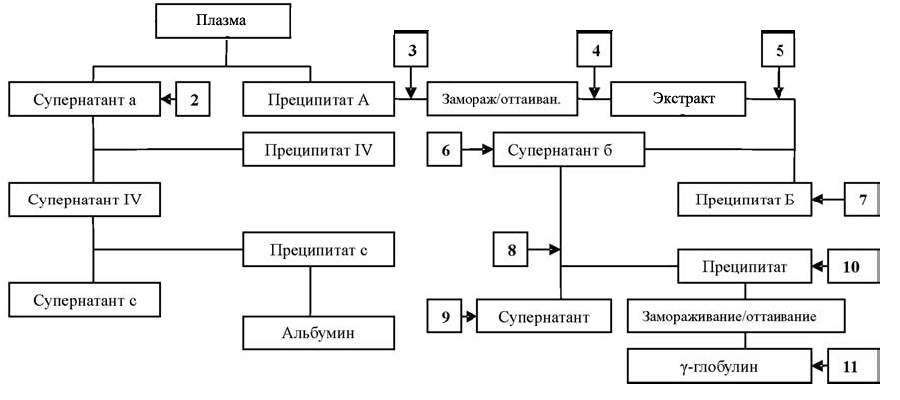
Рис. Процесс спиртового фракционирования плазмы крови по методу Kistler & Nitschmann [24].Цифрами указаны точки забора материала для последующего исследования на маркеры ВИЧ
Плазму фракционировали из 700 мл пулированной крови, отрицательной на антитела к ВИЧ-1 (2). К образцу плазмы добавляли 4.9 М ацетатный буфер с рН 4,0 и доводили рН до 5,8. После охлаждения до 0 — +2оС к пробе был добавлен этанол до конечной концентрации 19% (v/v – объем/объем), при этом температуру понижали до —5 —6оС и перемешивали в течение 1 ч. Затем суспензию центрифугировали 30 мин при 8000g и температуре —5 —6оС. Полученный при этом преципитат немедленно замораживали при —30оС или ниже, после чего его перемешивали при 0—+2оС в течение 30 мин в смеси дистиллированной воды и 0,5 М фосфатно-ацетатного буфера. Экстракцию продолжали при 0—+2оС в течение 2 ч, после чего в течение часа доводили рН фосфатно-цитратным буфером до 5,1±0,02. После последующего перемешивания в течение 30 мин к образцу добавляли 120 мл дистиллированной воды в течение 15 мин, а спустя 30 мин вливали 96% этиловый спирт до конечной концентрации 12% (v/v) с сопутствующим понижением температуры до —2,3—3,5оС. Перемешивание продолжали еще в течение 30 мин. Полученную таким образом суспензию центрифугировали 30 мин при 8000 g и температуре —3оС, после чего преципитат Б удаляли, а супернатант б оставляли. К супернатанту б добавляли 3,3 мл 15% NaCl и затем 0,1 М NaOH на протяжении не менее 3 ч до получения рН 7,25±0,05. К полученному образцу в течение 2 ч добавляли этанол до конечной концентрации 25% (v/v), температуру понижали до —7оС и продолжали перемешивание в течение 30 мин. Преципитат был отделен центрифугированием в течение 30 мин при 8000 g, температуре —7оС и затем быстро заморожен до —30оС или ниже. Супернатант удаляли.
Для определения влияния на ВИЧ этанола и низких температур в плазму добавляли вирус в рабочей концентрации 1,6х104 вирусных частиц. Забор материала и его тестирование на маркеры ВИЧ проводили в точках, указанных на рисунке. Как показали результаты исследований, уже во фракции супернатанта б (№ 6) маркеры вируса не определялись. В связи с этим в данный образец был добавлен ВИЧ в рабочей концентрации и в точках №№ 7—11 был произведен забор материала для выявления маркеров вируса. Как показали исследования, если во фракции преципитата Б ВИЧ выявлялся в количестве, равном исходной рабочей концентрации, то после добавления этилового спирта к супернатанту б (№ 8) маркеры ВИЧ не обнаруживались ни в одной из последующих фракций (№№ 9—11), в том числе в конечном продукте — γ-глобулине. Иммуноглобулин не обладал вируснейтрализующей активностью. Такие же результаты получены и при фракционировании плазмы крови по методу Cohn & Oncley [47].
Таким образом, при приготовлении γ -глобулина действуют три основных фактора, позволяющих полностью удалить ВИЧ: 1) инактивация вируса этанолом; 2) удаление вируса при фракционировании; 3) разрушение вируса на этапе замораживания-оттаивания. Как показали расчеты, на этапах фракционирования γ -глобулина происходит снижение инфекционной активности ВИЧ (примерно 1:10-15). Из этого можно заключить, что эффект инактивации (удаления) ВИЧ в процессе получения препарата не зависит от исходной концентрации вируса и нет, соответственно, субпопуляции ВИЧ, которая выжила бы при таких режимах обработки. Безусловно, большое значение имеет и предварительная проверка исходного материала на маркеры вирусных гепатитов В, С, в том числе на Алт, а также ВИЧ-1 (2).
В современном производстве иммуноглобулинов для внутримышечного введения и фактора свертывания крови IX в целях достижения полной инактивации вирусов (ВИЧ, гепатитов В и С) в препарате с успехом используют растворяющие детергенты, например Tri (n-butyl phosphate -TNBP), и анионные детергенты, например холат натрия в сочетании с нанофильтрацией [2, 22]. Удаление детергента осуществляется последующей преципитацией, фильтрацией и ультрафильтрацией. Эффективность инактивации ВИЧ-1 в эксперименте при данных способах обработки препарата иммуноглобулина оценивалась путем сравнения вирусной нагрузки при внесении вируса на определенном этапе фракционирования и в конце данного этапа. Затем рассчитывался фактор редукции инфекционной активности ВИЧ в lgТЦД50 [2]. При применении названных методов инактивации сохраняются иммунологические характеристики препарата: количество антител и их стабильность.
В экспериментах in vitro установлено, что при воздействии 70% этанола на ВИЧ-1 в концентрации 107 происходит полная инактивация вируса в течение 1 мин до уровня ниже предела определения [38]. Воздействие на вирус низких значений рН (например, при использовании хлорной кислоты) также приводит к его инактивации [29, 35]. Сильнокислые растворы разрывают фосфодиэфирные связи в нуклеиновых кислотах [44]. Данные химические агенты можно использовать для предотвращения трансмиссии ВИЧ-1 при костной трансплантации от доноров реципиентам [31]. Время экспозиции при этом зависит от размера костного образца.
Озон. Озон в концентрации 1,200 ppm инактивирует ВИЧ-1 в течение 2 ч [46]. Механизм инактивации, по мнению авторов, связан с воздействием озона на липиды оболочки вируса. При инактивации вируса в жидких средах (таких как кровь) озон может реагировать с другими соединениями (белками, жирными кислотами и т.п.), вызывая образование вторичных продуктов реакции, таких как гидроксипероксидаза, что, в свою очередь, еще больше способствует инактивации вируса.
Фотодинамические агенты. Для инактивации ВИЧ в крови и ее компонентах (концентрат тромбоцитов и эритроцитов) использовали фотодинамические агенты, действие которых связано с генерацией активных форм кислорода, что ведет к разрушению оболочки вируса [41]. К фотодинамическим агентам относятся метиленовый синий [26], мероцианин 540 (МЦ-540) в видимом свете [12], фталоцианин в красном свете [19], дигемопорфирин, бензопорфирин и др. Обладая неплохим эффектом в отношении инактивации ВИЧ путем разрушения его наружной оболочки, эти вещества имеют и существенные недостатки. Так, метиленовый синий активен в отношении внутриклеточных вирусов, действие МЦ-540 зависит от концентрации плазменных белков, которые, обладая протективными свойствами, снижают инактивацию вируса. Фотодинамические агенты отрицательно воздействуют на клеточные элементы крови, вызывая гемолиз, выход ионов калия при длительном хранении эритроцитов, а также увеличивают связывание иммуноглобулинов [33, 45]. Для устранения этих недостатков разработаны методики инактивации (удаления) ВИЧ из плазмы, сочетающие клеточную фильтрацию (с целью удаления клеток, содержащих вирус) с последующей обработкой плазмы фотодинамическим агентом – метиленовым синим, который воздействует на внеклеточный вирус. Метод оказался высокоэффективным в отношении как внеклеточного, так и внутриклеточного ВИЧ с сохранением коагулирующей активности фактора VIII, содержащегося в плазме [1].
Инактивация ВИЧ ноноксинолом-9, C31G, натрия додецил сульфатом.С целью предотвращения передачи ВИЧ-1 во время половых контактов ведется поиск и изучение антивирусных свойств в отношение вне- и внутриклеточного ВИЧ, широкого спектра химических агентов — микробицидов, многие из которых уже использовались ранее в качестве антимикробных средств.
Одно из таких веществ — ноноксинол-9 (N-9). Препарат применяли в виде спермицидной смазки кондомов в концентрации 8% в полиэтиленгликоле; в виде вагинальной смазки, содержащей 5% N-9; в виде спермицидных свечей, содержащих 5% N-9 в полиэтиленгликоле. Установлено, что N-9 в чистом виде ингибирует репликацию ВИЧ в концентрации 0,05% [28], а в виде добавок в спермицидных средствах инактивирует ВИЧ в концентрациях от 0,1 до 1,0%. Таким образом, для предотвращения передачи вируса во время полового контакта соединения, содержащие N-9, не должны разводиться более чем в 100 раз. В сравнительных исследованиях эффективности инактивации вне- и внутриклеточного ВИЧ-1 с помощью N-9, С31G и додецил сульфат натрия (SDS-NaДС) показано, что С31G более эффективен, чем N-9, а при инактивации ВИЧ-1 с помощью SDS требовалась в два раза большая концентрация этого химического соединения для достижения сопоставимого с N-9 и С31G уровня инактивации, но SDS был в 11 раз менее цитотоксичен, чем N-9, и в 5 раз, чем С31G [25]. В настоящее время препарат С31G проходит клинические испытания в качестве микробицида. Предварительные результаты противоречивы: с одной стороны, у животных концентрации C31G 1% и 1,7% вызывали разрушение цилиндрического эпителия и воспалительный процесс через 2 и 4 часа после местного применения, с другой стороны, однократное местное применение 1% С31G у женщин не вызывало каких-либо неблагополучных последствий [7]. К сожалению, как показали клинические испытания препарата ноноксинол-9 (вагинальный гель), он обладает целым рядом побочных эффектов: вызывает апоптоз и некроз эндометрия, снижение концентрации цитокинов и экспрессии муцина 1. Все эти повреждения в конечном итоге ведут к нарушению барьерной функции эндометрия и, соответственно, способствуют проникновению ВИЧ и других патогенов [17, 18, 20, 21].
Вещества, влияющие на конформационные изменения внутри ВИЧ. Все описанные выше методы имеют цель элиминировать ВИЧ для предотвращения его передачи. Однако существует ряд методов, направленных на инактивацию ВИЧ при сохранении конформационной и функциональной целостности его поверхностных гликопротеинов и, соответственно, иммуногенных свойств. Это чрезвычайно важно при разработке вакцинных препаратов. Такие вирионы могут быть использованы как дополнительный компонент «prime-boost» режима вакцинации, включающий живые вектора, такие как аттенуированные поксвирусы [36], или в схемах вакцинации, включающих ДНК-иммунизацию [23]. Другое потенциальное применение этих методов — инактивация ВИЧ-1 в образцах крови, которые используются в клинических и научных лабораториях, что снизит риск инфицирования при манипуляциях с такими образцами. Чрезвычайно важно, чтобы метод инактивации ВИЧ не влиял на химические показатели сыворотки и клеточные элементы.
В настоящее время опубликованы данные о нескольких методах инактивации ВИЧ-1 с сохранением конформационной целостности его структурных детерминант. К факторам инактивации относятся химические вещества, которые модифицируют нуклеокапсидный белок р7 (NCp7) ВИЧ-1, вследствие чего нарушается упаковка вирусной РНК в вирионе и блокируется обратная транскрипция вирусной РНК. В результате вирус теряет инфекционность, но сохраняет целостность структурных элементов. Так, группа ученых из США [5] опубликовала данные об антивирусных свойствах двух соединений, относящихся к пиридиналканоил тиоэфирам (рyridinioalkanoyl thioester) (PATE): N-[2-(5-pyridiniovaleroylthio) benzoyl] sulfacetamide bromide и N-[2-(5-pyridiniovaleroylthio) benzoyl] –4-(4-nitrophenylsulfonyl) aniline bromide (соединения 45 и 47 соответственно). Оба соединения выбивают Zn из высококонсервативной Zn-finger позиции, ковалентно модифицируя белок р7 с пиридин-щелочными группами. Кроме того, соединение 45 в присутствии катионов Ag+ модифицирует цистеины в позициях 36 и 49, выбивая Zn из С-концевого Zn–finger. Проведенные исследования демонстрируют возможность избирательного воздействия на участки-мишени нуклеокапсидного белка p7 с целью отбора наиболее эффективных ингибиторов ВИЧ с высокоселективным воздействием на Zn–finger.
Подобным механизмом действия обладает и 2,2’-dithiodipyridine (aldrithiol-2; AT-2). Его инактивирующие свойства изучались в сравнении с другими факторами инактивации, такими как нагревание и обработка вирионов формальдегидом [39]. Показано, что АТ-2 в жидкой среде при концентрации выше 300 мкМ полностью инактивировал ВИЧ-1. Механизм инактивации связан с ковалентной модификацией Zn–fingers в NCp7. Кроме того, АТ-2 вызывает перекрестное связывание NCp7, что, вероятно, предотвращает «раздевание» вируса, начало обратной транскрипции и последующее слияние оболочки вируса с рецепторами клетки-мишени [27]. В то же время конформационная структура детерминант на поверхности инактивированных вирионов была сопоставима с нативной. Это подтвердили результаты иммунопреципитации инактивированных АТ-2 и нативных вирионов с антителами (в том числе с моноклональными к конформационной детерминанте на gp 120). В отличие от этого, инактивация ВИЧ формальдегидом и нагреванием существенно снижала иммунопреципитацию по сравнению с нативным вирусом, что свидетельствует об утрате конформационных антигенных детерминант при данных методах инактивации.
Литература
1. Abe H., Yamada-Ohnishi Y., Hirayama J. et al. // Transfusion. –2000. –V.9. –P.1081–1087.
2. Alonso W. R., Trukawinski S., Savage M. et al. // Biologicals. –2000. –V.28. –P.5–15.
3. Andersson I., Connor S.E., Lindquist L.-O., Watson E.A. // Вестник службы крови России. –2000. –№ 3. – C.41–44.
4. Barre-Sinoussi F., Chermann J.C., Rey F. et al. // Science. — 1983. — V. 220. – P.868—871.
5. Basrur V., Song Y., Mazur S.J. et al. // J. Biol. Chem. –2000. –V.275. –P.14890.
6. Carlson J.R. // IRCS Medical Science. – 1985. – V.13. – P.1009.
7. Catalone B.J., Kish-Catalone T.M., Neely E.B. et al. // Antimicrob. Agents Chemother. – 2005.—V.49.—P.1509—1520.
8. Cavard C., Zider A., Vernet M. et al. // J. Clin. Invest. — 1990.—V.86.—P.1369—1374.
9. Cohn E.J., Strong L.E., Hughes W.J. et al. // J. Amer. Сhem. Soс. –1946. –V.68. –P.459–475.
10. Curran J.W., Lawrence D.N., Jaffe H. // New Engl. J. Med. – 1984. – V. 310. –P.69–75.
11. Davis B.D., Dulbecco R. // Microbiology. – 2d ed. / ed. by B.D. Davis, R. Dulbecco, H.N. Eisen et al. —Hagerstown, Maryland, Harper & Row, 1973. –P.233–270.
12. Dodd R.Y., Moroff G., Wagner S. // Transfusion. –1991. –V.31. –P.483–490.
13. Einarsson M., Perenius L., McDougal J.S., Cort S. // Transfusion. –1989. –V.29, N 2. –P.148–152.
14. Evatt B.L., Ramsey R.B., Laurence D.N. et al. // Ann. Intern. Med. – 1984. – V.100. – P.499–504.
15. Gallo R.C., Sarin P.S., Gelman E.P. et al. // Science. — 1983. — V. 220. — P. 865—867.
16. Henin Y., Marechal V., Barre-Sinoussi F. et al. // Vox. Sang. –1988. –V.54. –P.78–83.
17. Hillier S.L., Moench T., Shattock R. et al. // AIDS.—2005.—V.39.—P.1—8.
18. Hoffman I.F., Taha T.E., Padian N.S. et al. // AIDS. — 2004.—V.18.—P.2191—2195.
19. Horowitz B., Rywkin S., Margolis-Nunno H. // Blood Cells. –1992. –V.18. –P.141–149.
20. Jain J.K., Li A., Minoo P. et al. // Contraception.—2005.—V.71.—P.137—142.
21. Jain J.K., Li A., Nucatola D.L. et al. // Biol. Reprod.—2005.—Apr.13.
22. Johnston A., Macgregor A., Borovec S. et al. // Biologicals. –2000. –V.28, N 3. –P.129–136.
23. Kim J.J., Weiner D.B. // Springer Semin. Immunopathol. –1997. –V.19. –P.175–194.
24. Kistler P., Nitschmann H. // Vox. Sang. –1962. –V.7. –P.414–424.
25. Krebs F.C., Miller S.R., Malamud D. // Antiviral Research. –1999. –V.43, N 3. –P.157–173.
26. Lambrecht B., Norley S.G., Kurth R. et al. // Biologicals.—1994.—V.3.—P.227—237.
27. Loo J.A., Holler T.P., Sanchez J. et al. // J. Med. Chem. –1996. –V.39. –P.4313–4320.
28. Malkovsky M., Newell A., Dalgleish A.G. // Lancet. –1988. –P.645.
29. Martin L.S., McDougal J.S., Loskoski S.L. // J. Infect. Dis. –1985. –V.152. –P.400—403.
30. McDougal J.S., Martin L.S., Cort S.P. et al. // J. of Clin. Investigation. –1985. –V.76. –P.875–877.
31. Mellonig J. T., Prewett A. B., Pat Moyer M. // J. Periodontology. –1992. –V.63, N 12. –P.979—983.
32. Nakashima H., Koyanagi Y., Harada S. // J. of Investigation Dermatology. –1986. –V.87, N 2. –P.239–243.
33. North J., Freeman S., Overbaught J. et al. // Transfusion. –1992. –V.32. – P.121–128.
34. Oncley J.L., Melin M., Richert D.A. et al. // J. Amer. Chem. Soc. –1949. –V.71. — P.541–550.
35. Ongradi J., Ceccherini-Nelli L., Pstello M. et al. // AIDS Res. Human. Retrovirus. –1990. –V.12. –P.1433–1436.
36. Paoletti E. // Proc. Natl. Acad. Sci. USA. –1996. –V.93. –P.11349–11353.
37. Quinnan G.V., Wells M.A., Wittek A.E. // Transfusion. –1986. –V.26. –P.481–483.
38. Resnick L., Veren K., Salahuddin S. et al. // JAMA. –1986. –V.255. –P.1887–1891.
39. Rossio J.L., Esser M.T., Suryanarayana K. et al. // J. Virology. –1998. –V.72, N10. –P.7992–8001.
40. Rouzioux C., Chameret S., Montagnier L. et al. // Lancet. –1985. –V. 1. –P.271—272.
41. Sieber F., Krueger G.J., O’Brien J.M. et al. // Blood. –1989. –V. 73. –P.345–350.
42. Tersmette M., de Goede R., Over J. // Vox. Sang. –1986. –V.51. –P.239—243.
43. Vilmer E., Barre-Sinoussi F., Rouzioux X. // Lancet. – 1984. – V.1. – P.753–757.
44. Vodiska P., Hemminki K. // Chem. Biol. Interactions. –1988. –V.68. –P.153–164.
45. Wagner S.J., White R., Wolf L. et al. // Photochem. Photobiol. –1993. –V.57. –P.819—824.
46. Wells K.H., Latino J., Gavalchin J., Poiesz B. J. // Blood. –1991. –V.78, N 7. –P.1882–1890.
47. Wells M.A., Wittek A.E., Epstein J.S. et al. // Transfusion. –1986. –V.26. –P.210–213.
Медицинские новости. – 2007. – №13. – С. 7-11.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.