Воспаление межпозвоночного диска известно под различными диагнозами – дисцит, спондилодисцит, межпозвоночный остеохондрит и др. [3, 5, 6, 16, 24]. У взрослых воспалительный процесс в межпозвоночном пространстве обычно является осложнением дискэктомии [12, 15, 21, 26]. В детском возрасте развитие дисцита связывают с гематогенной инфекцией и травмой [7, 9, 34]. Впервые межпозвоночный дисцит у ребенка описал L.Mayer в 1925 г. [25]. Заболевание длительное время рассматривалось как «малодеструктивная», благоприятно протекающая форма остеомиелита позвоночника. В отечественной литературе дисцитам у детей уделено недостаточно внимания [1]. Неосведомленность врачей и отсутствие характерных клинических проявлений данного заболевания приводит к многочисленным диагностическим ошибкам и неоправданному лечению [8, 11, 22, 35].
В Белорусском центре детской хирургии с 1998 по 2005 г. на лечении находилось 16 детей с межпозвоночным дисцитом. Для диагностики использовали клинические, лучевые (Rg, КТ, МРТ, УЗ), лабораторные и бактериологические методы исследования. Применяли также радиоизотопную сцинтиграфию с 99mТс медронатом и тепловизионное исследование (ТВИ) на аппарате «Радуга» (Беларусь). Для обработки полученных данных использовали статистические методы.
Возраст детей с дисцитами варьировал от 1,5 до 15 лет (7,9±1,2 года). Мальчиков было 9 (56,2%), девочек – 7 (43,8%). Наиболее часто дисциты наблюдались у детей 4–10 лет (n=9; 56,3%) и 11—15 лет (n=4; 25,0%). В возрасте от 1 до 3 лет выявлено 3 детей с дисцитами (18,7%).
В шейном отделе позвоночника воспалительный процесс локализовался у 9 детей (56,3%), в грудном — у 3 (18,7%), в поясничном — у 2 (12,5%), в пояснично-крестцовом отделе — также у 2 (12,5%). Зависимости частоты поражения какого-либо отдела позвоночника от возраста не установлено (Р > 0,05). Локализация дисцитов представлена в таблице.
Таблица. Локализация дисцитов у детей
|
Локализация
|
Количество больных
|
|
СII-III
|
1 (6,25%)
|
|
СIII-IV
|
4 (25,00%)
|
|
СIV-V
|
1 (6,25%)
|
|
СV-VI
|
1 (6,25%)
|
|
СVI-VII
|
1 (6,25%)
|
|
СVII-VIII (добавочный СVIII)
|
1 (6,25%)
|
|
TIII-IV
|
1 (6,25%)
|
|
TVIII-IX и TIX-X
|
1 (6,25%)
|
|
TX-XI
|
1 (6,25%)
|
|
LI-II
|
1 (6,25%)
|
|
LIV-V
|
1 (6,25%)
|
|
LV–SI
|
1 (6,25%)
|
|
SI-II (люмбализация SI)
|
1 (6,25%)
|
|
Всего
|
16 (100,0%)
|
У одного ребенка выявлен двойной уровень поражения дисков – TVIII-IX и TIX-X. Наиболее часто воспалительный процесс локализовался в диске СIII-IV (4 чел.; 25,0%). Частота дисцитов других локализаций была одинаковая. Дети направлялись в стационар с диагнозами: шейный лимфаденит, остеомиелит позвоночника, коксит, гонит, радикулит, острый аппендицит и др. Правильный диагноз не был поставлен ни одному ребенку. Ранее 6 пациентам выполнялись различные исследования – краниограмма, рентгеноскопия желудка, ирригоскопия, внутривенная пиелография, спинномозговая пункция и лапароскопия. Исследование позвоночника у большинства детей не производилось. Средняя продолжительность заболевания до госпитализации составила 12,6±2,3 сут. Накануне развития дисцита у 5 детей отмечена ОРВИ, у 2 – инфекция мочевыводящих путей. У 4 пациентов заболеванию предшествовала травма, не относящаяся к области поражения.
Начало межпозвоночного дисцита сопровождалось повышением температуры тела до 37,5±0,4оС. Состояние большинства детей соответствовало средней тяжести.
Клиническая картина дисцита шейного отдела позвоночника характеризовалась болевым синдромом. Обращало на себя внимание вынужденное положение головы (симптоматическая кривошея), сглаженность лордоза и напряжение мышц шеи. При нагрузке на голову у половины детей выявляли болевую реакцию в зоне поражения. Обнаруживали болезненность в проекции остистых отростков и паравертебральных точек на уровне пораженного и смежных сегментов. Боли в области шеи уменьшались при фиксации головы руками. Менингеальные знаки выявлены у двух пациентов. У всех детей определялись увеличенные, умеренно болезненные, поверхностные и глубокие лимфатические узлы шеи при отсутствии воспалительных изменений в ротоглотке.
При дисците грудного отдела позвоночника дети жаловались на боли в спине. У одного ребенка с дисцитом T III-IV боли носили опоясывающий характер и усиливались при вдохе (симптоматическая межреберная невралгия). У пациента с локализацией воспалительного процесса в T X-XI отмечались боли в животе и ригидность поясничного отдела позвоночника.
В клинической картине дисцита поясничного и пояснично-крестцового отделов позвоночника на первый план также выступал болевой синдром. В начальной стадии заболевания наблюдались хромота, боли в пояснице, животе, иногда в ягодицах, бедрах, тазобедренных и коленных суставах. Двое детей могли стоять, сидеть на корточках и вставать, однако поясничный отдел позвоночника сохраняли ригидным. Наклоны в стороны были ограничены, вперед — невозможны. Двое детей отказывались ходить и находились в постели в вынужденном положении на спине, испытывая боли в пояснице при изменении положения туловища. Отмечалась сглаженность поясничного лордоза, напряжение длинных мышц спины, сколиоз, а также болезненность остистых отростков и паравертебральных точек на уровне пораженного сегмента. Сидя в постели, дети предпочитали опираться руками позади ягодиц.
Абдоминальные боли, снижение брюшных рефлексов, симптомы Вассермана и Мацкевича наблюдались у двух детей. Симптом Ласега, непостоянство коленного и ахиллова рефлексов выявлены также у двух пациентов. У одного ребенка 4 лет обнаружен симптом Гуверса [20]: поднимаясь на ноги из положения лежа ничком, он принимал коленно-локтевое положение, затем, вставая, руками последовательно захватывал голени, коленные суставы и бедра. Активные движения в тазобедренных и коленных суставах были ограничены, пассивные сохранены. При дисците LV-SI у одного ребенка были болезненные мочеиспускания. Боли при акте дефекации имели место у пациента с люмбализацией SI и дисцитом S I-II.
При лабораторном исследовании крови у детей определяли умеренный лейкоцитоз — (11,8±1,9)х109/л, увеличение лейкоцитарного индекса интоксикации (ЛИИ) — 1,6±0,2 (норма 1,0—1,5), возрастание СОЭ — 31,5±5,3 мм/ч и повышение уровня острофазных белков (СРБ, церулоплазмина, серомукоидов). Диспротеинемия и дисгаммаглобулинемия выявлены у половины пациентов. Посев на гемокультуру и обследование на туберкулез были отрицательными.
При первичном рентгенологическом исследовании деструктивных изменений в позвоночнике не выявлено. У большинства детей наблюдалась сглаженность физиологического изгиба позвоночника соответственно уровню поражения (рис. 1).
 |
 |
 |
|
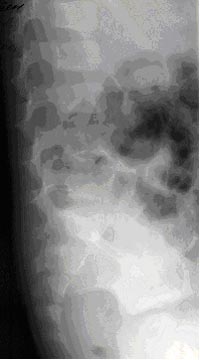
Рисунок 1. Пациент Г., 5 лет. Диагноз: дисцит LV–SI. 1 нед. от начала заболевания. Боковая спондилограмма (пояснично-крестцовый отдел). Отсутствие поясничного лордоза
|
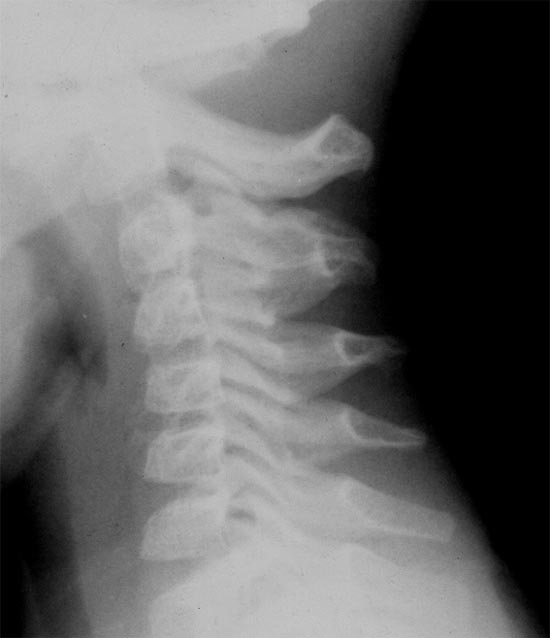
Рисунок 2. Пациент Ж., 5 лет. Диагноз: дисцит СII-III. 3 нед. от начала заболевания. Боковая спондилограмма (шейный отдел). Снижена высота диска СII-III. Отсутствие шейного лордоза
|
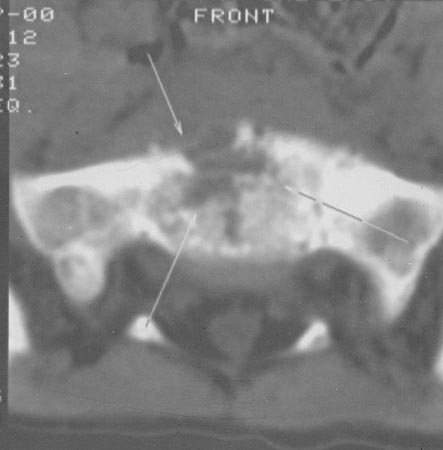
Рисунок 3. Пациент Г., 5 лет. Диагноз: дисцит LV–SI. 3 нед. от начала заболевания. КТ пояснично-крестцового отдела позвоночника. Деструкция диска LV–SI
|
Врожденные аномалии позвоночника обнаружены у 7 (43,7%) пациентов: сросшиеся СII–СIII – у 2, добавочный позвонок СVIII – у 1, люмбализация SI – у 1, spina bifida – у 3. Через 3–4 нед. от начала заболевания на спондилограммах выявляли сужение межпозвоночного пространства (рис. 2).
У одного ребенка обнаружен минимальный антелистез СV и нестабильность СV и СVI. По истечении 6–12 нед. выявлена неровность замыкательных пластинок тел смежных позвонков с последующим склерозированием. Необходимо подчеркнуть, что сужение дискового пространства в некоторых случаях обнаруживали только через 6–8 нед. от начала заболевания. КТ позволяла выявить уменьшение высоты дискового пространства на 2–3-й неделе от начала заболевания. Верифицировались эрозии замыкательных пластинок тел смежных позвонков и деструктивные изменения диска (рис. 3).
На МРТ обнаруживали гиперинтенсивность Т2 сигнала от пораженного диска, а также реактивные изменения паравертебральных тканей (миозит, целлюлит). Изотопная сцинтиграфия с 99mTc медронатом у двух пациентов позволила установить накопление радиофармпрепарата в пораженном диске и смежных позвонках.
При дисцитах шейной локализации УЗИ верифицировало увеличенные лимфатические узлы, локализующиеся как поверхностно, так и вдоль сосудисто-нервного пучка. При поясничных дисцитах у двух детей паравертебрально выявляли участки нарушения структурной четкости мышц (миозит). При ТВИ обнаруживали участок гетерогенной гипертермии в зоне поражения с распространением на смежные области позвоночника с ∆t = 1–2оC. Дифференциальную диагностику проводили с остеомиелитом позвоночника, кокситом, гонитом, туберкулезным спондилитом, менингитом, болезнью Гризеля, при наличии абдоминального синдрома — с острым аппендицитом.
Лечение детей с дисцитами было консервативным и комплексным. В первую очередь назначался постельный режим. При дисцитах шейного отдела позвоночника использовали головодержатель (воротник Шанца). Всем детям назначали антибактериальное лечение — комбинацию препаратов пенициллинового ряда и аминогликозидов и цефалоспорины I—III поколений. Применяли 3–4 курса антибиотикотерапии. В комплекс лечения входили неспецифические противовоспалительные (ибупрофен), антигистаминные препараты и дезинтоксикационная терапия. Проводилась лечебная гимнастика по общеукрепляющей методике и физиотерапевтическое лечение (УВЧ, электрофорез кальция). Во всех случаях эффект от терапии наблюдался довольно быстро. Уже через 2–3 суток уменьшался болевой синдром, появлялась способность более активно двигать головой и туловищем. Первые 2–3 нед. дети находились в постели, после чего им разрешали дозированную ходьбу, при грудной и поясничной локализации дисцита – при помощи костылей. Длительность антибактериальной терапии – 3–4 нед. К этому времени в основном приходили в норму лабораторные показатели крови. Через 2–3 месяца нормализовалась СОЭ. Длительность госпитализации составила 24,5±3,4 суток. Амбулаторно контролировали двигательный режим, физическую нагрузку, проводили рентгенологическое исследование.
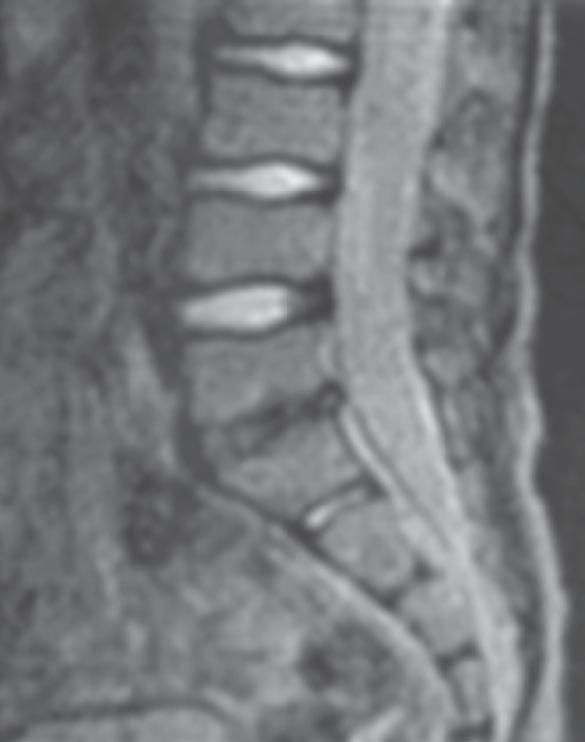
Отдаленные результаты изучены у 12 пациентов в сроки от 6 мес до 5 лет. В связи с возобновившимися болями в области поясницы двух детей госпитализировали повторно. Постельный режим и ограничение движений (хождение на костылях) в течение 1–2 нед. позволили полностью снять болевой синдром. У всех наблюдаемых пациентов наступило клиническое выздоровление, хотя у 2 детей отмечена умеренная вертебралгия после физической нагрузки. Сужение межпозвоночного пространства с узурацией замыкательных пластинок и склерозом подхрящевого слоя тел смежных позвонков рентгенологически выявлено у 13 детей (рис. 4, 5), восстановление высоты дискового пространства – у 4 пациентов, перенесших заболевание в младшем возрасте. Блокада пораженного межпозвоночного пространства развилась у 2 детей. При использовании МРТ в отдаленном периоде (более 6 мес.) обнаруживали снижение интенсивности МР-сигнала на Т2-взвешенных сканах от пораженного диска (рис. 6).
 |
 |
 |
|
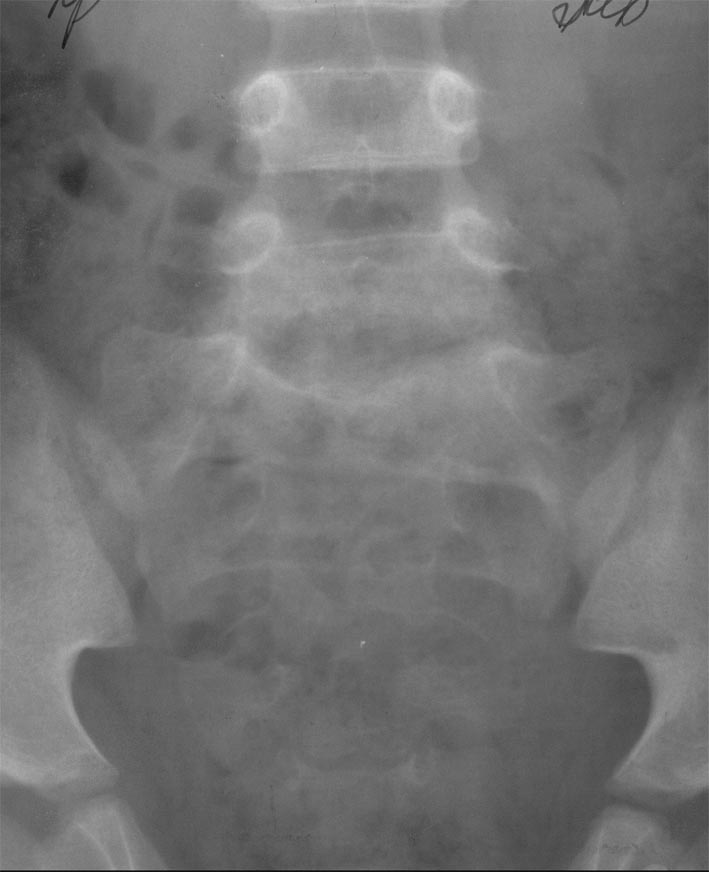
Рисунок 4. Пациент Г., 5,5 года. Диагноз: дисцит LV–SI. 6 мес от начала заболевания. Боковая спондилограмма (пояснично-крестцовый отдел). Неравномерное снижение высоты диска LV–SI. Неровность и склероз смежных поверхностей тел LV и SI. Деформация тела LV
|
Рисунок 5. Пациент Г., 5,5 года. Диагноз: дисцит LV–S1. 6 мес от начала заболевания. Прямая спондилограмма (пояснично-крестцовый отдел). Снижение высоты диска LV–S1. Узурация и склероз смежных поверхностей тел LV и SI
|
Рисунок 6. Пациент Г., 5,5 года. Диагноз: дисцит LV–S1. 6 мес от начала заболевания. МРТ пояснично-крестцового отдела позвоночника. Снижена интенсивность МР-сигнала на Т2-взвешенных сканах в диске LV–S1. Узурация смежных замыкательных пластинок тел LV и S1
|
Этиология межпозвоночного дисцита в детском возрасте до конца не выяснена. Большинство авторов считают, что заболевание имеет инфекционную природу, но не исключают значение предшествующей травмы [7, 9, 34]. В культурах из дискового пространства в 30% наблюдений обнаруживаются S. аureus (чаще всего), S. epidermidis, Kingella, Salmonella spp. и др. В 70% случаев посевы стерильны [8, 11, 18]. Травма способствует высвобождению из диска тканевых энзимов, среди которых фосфолипаза А2 известна как потенциальный стимулятор воспаления in vitro [30].
В проведенном исследовании у половины пациентов выявлены аномалии позвонков – сращение СII-СIII, шейный добавочный позвонок (СV), люмбализация SI, spina bifida. Установлено, что при пороках развития позвонков, в частности при блокаде, создается повышенная нагрузка выше и ниже пораженного сегмента позвоночника [3]. Таким образом, предрасполагающим фактором развития дисцита может быть повышенная нагрузка, что подтверждает более частая локализация межпозвоночного дисцита в подвижных отделах позвоночника – шейном и поясничном.
Межпозвоночный диск эмбриона хорошо кровоснабжается и получает питание из трех главных источников: сосудов периоста, аксиальных сосудов хорды и сосудов тела позвонка. Редукция питающих сосудов диска начинается с момента рождения ребенка и завершается к началу третьей декады жизни [17, 19]. Это объясняет большую частоту дисцитов у детей по сравнению с взрослыми. Микроорганизмы достигают межпозвоночного диска гематогенным путем, проникая в терминальные сосуды на периферии диска в зоне annulus fibrosis или путем прямого распространения возбудителей с замыкательных пластинок тел прилежащих позвонков [34].
Исследование биоптатов пораженных дисков обнаруживает признаки как острого, так и хронического воспаления [29]. В результате воспалительного процесса вследствие деградации белково-полисахаридного комплекса внутриклеточного матрикса диска и потери способности связывать воду межпозвоночное дисковое пространство сужается. Развивающееся уплотнение коллагеновой пластинки annulus fibrosus ограничивает подвижность в межпозвоночном пространстве и уменьшает мобильность позвоночника [3, 35].
Межпозвоночный дисцит развивается постепенно и характеризуется маломанифестным течением. Обычно ребенок с дисцитом оказывается у специалиста не ранее чем через 2–4 нед. от начала заболевания. В клинической картине наблюдаются раздражительность, хромота, нежелание стоять, сидеть или ходить. Дети среднего и старшего возраста жалуются на неясные боли в области шеи, спины, поясницы, нижних конечностях, животе [9]. Дети младшего возраста не предъявляют жалоб на боли в спине, но отмечают боли в животе. Возможно развитие вздутия живота и запора [22]. При исследовании пациентов боли в спине часто не привлекают внимания, несмотря на появление закрепощенности туловища, сколиоз и анталгическую позу вследствие спазма паравертебральных мышц. Важное значение имеет усиление болей в спине при поднятии тяжести. Многие авторы отмечают наиболее частую локализацию дисцитов в поясничном отделе позвоночника, хотя это не подтверждено проведенными исследованиями.
Анализ клинического течения дисцитов у детей позволил выделить несколько синдромов. Воспалительный синдром характеризуется лихорадкой и признаками интоксикации. Болевой синдром: ребенок жалуется на боли в шее, спине, пояснице. При этом боль не всегда соответствует локализации пораженного диска. Статодинамический синдром: хромота, нежелание стоять, сидеть или ходить. Рефлекторно-тонический синдром: повышение тонуса шейных (кривошея), параспинальных мышц с уменьшением или ликвидацией физиологических изгибов позвоночника, появление сколиотической деформации позвоночника (анталгическая поза). Абдоминальный синдром обусловлен воспалением межпозвоночных дисков нижнегрудного и поясничного отделов позвоночника. Характеризуется болями в животе, периодическим напряжением мышц и болезненностью передней брюшной стенки, иногда вздутием живота и болями при дефекации.
Нейропатический синдром развивается вследствие вовлечения корешков шейного, плечевого, поясничного или крестцового сплетения. Заинтересованность чувствительных волокон проявляется расстройствами чувствительности, тогда как поражение двигательных волокон – симптомами двигательных расстройств. Дисцит шейного отдела позвоночника от СI до СIV (шейное сплетение) в некоторых случаях сопровождается невритом n. occipitalis minor, nn. supraclavicularis, n. accessorius и др. Дисцит от СIV до TI (плечевое сплетение) может проявиться невритом n. subclavius, nn. thoracales anteriores et posteriores, n. supraclavicularis, nn. subscapulares и др. При воспалении дисков поясничного отдела позвоночника (поясничное сплетение) возможно развитие неврита n. iliohypogastricus, n. cutaneus femoralis lateralis, n. femoralis и др. При дисците пояснично-крестцового отдела (крестцовое сплетение) обнаруживаются признаки неврита n. ishiadicus, n. piriformis, n. quadratus femoris, n. gluteus superior et inferior и др. Выявление нейропатического синдрома помогает топической диагностике дисцита.
У детей младшего возраста чаще обнаруживаются воспалительный, статодинамический и абдоминальный синдромы, тогда как у детей старшего возраста – болевой, статодинамический, рефлекторно-тонический и нейропатический [4, 6, 15].
Решающим диагностическим признаком дисцита является сужение межпозвоночного пространства. Выделяют четыре фазы рентгенологических проявлений дисцита. I фаза (1–2 нед.) – на спондилограмме можно обнаружить сглаженность физиологических изгибов позвоночника. II фаза (3–4 нед.) – снижение высоты межпозвоночного пространства, иногда сопровождающееся остеопорозом тел смежных позвонков. Как правило, наблюдается сужение одного дискового пространства, хотя возможно и двойное поражение. III фаза (4–10 нед.) – появляется изъеденность замыкательных пластинок тел соседних позвонков. IV фаза (10–16 нед.) – продолжается сужение дискового пространства с развитием склероза замыкательных пластинок позвонков.
Вследствие раздражения зон роста контактирующего позвонка возможно увеличение его тела (vertebra magna), изменение формы (трапециевидная, снижение высоты, шиповидные разрастания) [9, 19]. У детей старшего возраста при разрушении диска тела позвонков могут спаиваться. Полное восстановление высоты дискового пространства наблюдается менее чем у 10% детей, в основном младшего возраста [34, 35].
КТ обладает более высокой разрешающей способностью по сравнению с рентгенографией и позволяет раньше обнаружить сужение дискового пространства, а также зоны субхондрального склероза тел смежных позвонков. Кроме того, при КТ визуализируются конфигурация, размеры спинномозгового канала, опухоли, гематомы и др. К недостаткам метода можно отнести ограничения, связанные с высокой лучевой нагрузкой [3, 31].
МРТ обладает рядом преимуществ перед другими методами лучевой диагностики. К ним относятся неинвазивность, отсутствие ионизирующего излучения, высокая контрастность изображения. Метод позволяет в течение первой недели выявить воспалительный процесс в межпозвоночном диске и окружающих тканях, оценить состояние позвоночного канала, обнаружить протрузию дисков и фрагментов концевых пластинок тел позвонков в спинномозговой канал. Пораженный диск вызывает снижение сигнала в режиме Т1 (гипоинтенсивный) и гиперинтенсивный сигнал в режиме Т2. МРТ позволяет осуществлять раннюю дифференциальную диагностику воспалительных заболеваний позвоночника с новообразованиями и травматическими повреждениями [10, 13, 14, 16, 32].
Сканирование с 99mTc медронатом (пирофосфатом) или 67Ga цитратом является чувствительным методом, позволяющим определить очаг воспаления в межпозвоночном дисковом пространстве через 3–7 сут от начала заболевания [23, 27]. Сцинтиграфия способствует не только выявлению локализации, но и определению стадии воспалительного процесса. Однако метод не обладает высокой специфичностью, так как накопление радиофармпрепарата происходит в смежных позвонках, при опухолях и переломах. Сцинтиграфию целесообразно использовать как скрининговый метод у детей младшего возраста при сложности топического выявления очага поражения [34].
УЗИ и ТВИ малоинформативны в диагностике дисцита и имеют вспомогательное значение. При этом ТВИ позволяет выявить зоны снижения или повышения температуры кожи (вазомоторные расстройства), косвенно свидетельствующие о нейропатии, сопутствующей дисциту.
Учитывая благоприятное течение межпозвоночного дисцита у детей, биопсия, как правило, не показана, однако такая необходимость может возникнуть в случае фулминантного течения заболевания, при подозрении на абсцедирование, туберкулез, грибковую инфекцию, при отсутствии эффекта от антибактериального лечения и хроническом течении болезни [11, 21]. Пункция межпозвоночного пространства осуществляется под флюороскопическим контролем – через параспинальные мышцы ниже латерального отростка позвонка. При пункции в поясничном отделе необходимо помнить о нижней полой вене и аорте, которые располагаются непосредственно впереди позвоночника.
Хромота и жалобы на боли в тазобедренном и коленном суставах, наблюдающиеся при дисцитах поясничного отдела позвоночника, нередко расцениваются как коксит или гонит. Однако при дисците пассивные движения в суставах сохранены, а проявления воспалительного процесса отсутствуют. Боли в животе, лихорадка, изменения в анализах крови воспалительного характера заставляют подозревать острый аппендицит. Наблюдение и использование при необходимости дополнительных методов исследования (УЗ, лапароскопия) помогают правильной диагностике. При болях в области фланков и поясницы может предполагаться инфекция мочевыводящих путей. Постановке диагноза помогает исследование мочи [7, 19].
При болезни Гризеля кривошея обусловлена ротационным смещением атланта при асимметричной контрактуре прикрепляющихся к атланту и основанию черепа околопозвоночных мышц (mm. rectus capitis ant. et lat.). Кривошее предшествует воспалительный процесс в зеве и носоглотке. В верхнешейном отделе позвоночника пальпируется выступающий остистый отросток СII, а со стороны глотки на задней стенке появляется возвышение, соответствующее сместившемуся атланту. На рентгенограмме, выполненной через открытый рот па циента, обнаруживается подвывих атланта – смещение позвонка кпереди с одновременным поворотом вокруг вертикальной оси [6].
При наличии головных болей, болей в области шеи, спины, мышечного спазма и менингеальных знаков можно заподозрить менингит, однако отсутствие очаговой симптоматики и отрицательные результаты спинномозговой пункции позволяют исключить данный диагноз. При остром гематогенном остеомиелите позвоночника наблюдается тяжелое течение заболевания, более ранние и выраженные изменения в позвонках. Правильной диагностике помогает КТ [2]. Дифференциальной диагностике с туберкулезным спондилитом способствуют рентгенологическое исследование органов грудной клетки и специфические пробы. Необходимо помнить о более медленном течении туберкулезного процесса, множественности поражения позвонков и преимущественной локализации в грудном отделе позвоночника. При этом наблюдается более выраженная деструкция тел позвонков [34].
При болезни Шейермана—Мау, как и при дисците, отмечается сужение межпозвоночного пространства, однако кифотическая деформация спины, характерная клиновидная форма позвонка, локализация в грудном отделе позвоночника и отсутствие воспалительного синдрома позволяют выставить правильный диагноз [4, 6]. Травма также может вызвать сужение дискового пространства. В этом случае большое значение имеет тщательно собранный анамнез. Дифференциальная диагностика проводится с редко встречающимися заболеваниями – опухолью спинного мозга, синдромом Guillain—Barre, поперечным миелитом, полиомиелитом, мышечной дистрофией [9].
В связи с различными взглядами на этиологию дисцитов у детей существуют и неодинаковые подходы к терапии. Традиционно лечение включает постельный режим, разгрузку позвоночника, иммобилизацию (головодержатель, корсет). Отношение к антибиотикотерапии неоднозначное. Некоторые авторы утверждают, что рецидивы заболевания чаще наблюдаются у пациентов, не получавших антибиотики [8]. Целесообразно учитывать сведения о невысокой проницаемости антибиотиков в ткани межпозвоночного диска у детей старшего возраста [19], что обусловлено снижением его кровообращения [27, 29]. Длительность лечения обусловлена продолжительностью болевого синдрома и данными лучевых методов исследования. Среди лабораторных показателей целесообразно ориентироваться на острофазные белки и СОЭ. Выбор антибиотиков осуществляется эмпирически, с учетом более частого выделения из пораженного дискового пространства S. aureus [18, 19]. Повышение активности фосфолипазы А2, наблюдающееся при патологии межпозвоночного диска, обусловливает рациональность применения нестероидных противовоспалительных препаратов, снижающих активность данного фермента [30]. Период иммобилизации обычно не превышает 4 нед.
Вопрос о хирургическом лечении детей с дисцитами может возникнуть при наличии превертебральных абсцессов, особенно в шейном отделе позвоночника опасных сдавлением органов шеи и развитием асфиксии, при лизисе диска с формированием патологической нестабильности позвоночника, а также при компрессии спинного мозга [4, 23, 26]. В ходе операции производится остеопериостальная декортикация пораженного сегмента позвоночника. Отслаивается передняя продольная связка вместе с тонким слоем кортикальной пластинки, удаляются остатки пораженного диска и резецируются контактные поверхности тел позвонков до кровотечения из спонгиозы. Спондилодез осуществляется аутотрансплантатом из гребня подвздошной кости [5].
У большинства детей отдаленные результаты лечения дисцита благоприятные. У 75% пациентов при отсутствии жалоб в отдаленном периоде выявляются рентгенологические изменения в позвоночнике [8]. В результате асимметрии дискового пространства может сформироваться сколиоз со структурными изменениями тел прилежащих позвонков. В ряде случаев перенесенный в детстве дисцит является причиной вертебралгии [28, 33, 35].
Таким образом, межпозвоночный дисцит в детском возрасте — не столь редкое заболевание, как принято считать. Ранняя диагностика дисцита трудна, так как жалобы пациента и клинические проявления заболевания неспецифичны, вследствие чего исследование позвоночника во многих случаях не проводится. Однако правильная диагностика чрезвычайно важна, так как позволяет предотвратить напрасные процедуры и вмешательства (спинномозговая пункция, лапаротомия, артротомия и др.).
Дисцит следует предполагать, если у ребенка имеется: 1) ухудшение состояния; 2) повышение температуры тела; 3) неясные боли в шее, спине, животе или нижних конечностях, причину которых невозможно установить. Настороженность врачей в отношении данной патологии и использование современных методов исследования позволят улучшить диагностику и результаты лечения дисцитов у детей.
ЛИТЕРАТУРА
1. Абаев Ю.К. //Детская хирургия. – 2003. – N 1. – С.22–25.
2. Беляев М.К., Прокопенко Ю.Д., Федоров К.К. //Детская хирургия. – 2006. – N 1. – С.39–42.
3. Гэлли Р.Л., Спайт Д.У., Симон Р.Р. Неотложная ортопедия. Позвоночник: Пер. с англ. – М.: Медицина, 1995.
4. Кузнечихин Е.П., Ульрих Э.В. Хирургическое лечение детей с заболеваниями и деформациями опорно-двигательной системы. – М.: Медицина, 2004.
5. Мусалатов Х.А., Колесов В.В. //Хирургия. – 1997. – N 8. – С.61–63.
6. Ульрих Э.В., Мушкин А.Ю. Вертебрология в терминах, цифрах, рисунках. – СПб.: ЭЛБИ, 2002.
7. Brown R., Hussain M., McHugh K. et al. //J. Bone Joint Surg. – 2001. — V. 83-B, N 1. – P.106–111.
8. Crawford A.H., Kucharzyk D.W., Ruda R., Smitherman H.C. //Clin. Orthop. Relat. Res. – 1991. – V. 266, N 5. – P.70 —79.
9. Cushing A.H. //Clin. Infect. Dis. – 1993. – V. 17. – P.1 — 6.
10. Fairbank J.C. //J. Bone Joint Surg. – 1995. – V. 77-A, N 2. – P.328 —329.
11. Fernandes M., Carrol C.L., Baker C.J. //Pediatrics. – 2000. – V. 105, N 6. – P. 1299—1304.
12. Foley K.T., Smith M.M. //J. Bone Joint Surg. – 1998. – V. 80-B. – Suppl. III. – P.232–233.
13. Friedman D.P., Hill J.R. //Amer. J. Roentgenol. – 1994. – V. 163. – P.699–704.
14. Gabriel K.R., Crawford A.H. //J. Bone Joint Surg. – 1988. – V. 70-A, N 6. – P.938–941.
15. Gebhard J.S., Brugman J.L. //Spine. – 1994. – V. 19, N 7. – P.855–857
16. Gertzbein S.D., Hollopeter M., Bertini J.E., Murdock H.D. //Spine. – 1998. – V. 23, N 6. – P.734–736.
17. Gibson M.J., Karpinski M.R.K., Slack R.C.B. et al. //J. Bone Joint Surg. – 1987. – V. 69-B, N 5. – P.784–786.
18. Hadjipavlou A.G., Mader J.T., Necessary J.T., Muffoletto A.J. //Spine. – 2000. – V. 25, N 13. – P.1668–1679.
19. Harris L.T., Haws F.P. //Al. Med. – 1994. – V. 63, N 7. – P.12–14.
20. Keller H., Haller J.S. //Amer. J. Dis. Child. – 1982. – V. 136, N 6. – P.555–556.
21. Kuker W., Mull M., Mayfrank L. et al. //Spine. – 1997. – V. 15, N 5. – P.544–551.
22. Leahy A.L., Fogarty E.E., Fitzgerald R.J., Regan B.F. //Surgery. – 1984. – V. 95, N 4. – P.412–414.
23. Lifeso R.M. //Spine. – 1990. – V. 22, N 5. – P.544—551.
24. Maiuri F., Laconetta G., Gallichio B. et al. //Spine. – 1997. – V. 22, N 15. – P.1741–1746.
25. Mayer L. //J. Bone Joint Surg. – 1925. – V. 7-A. – P.957–968.
26. Moon M.S., Kim S.S., Moon Y.W. //J. Bone Joint Surg. – 2002. – V. 84-B. – Suppl. III. – P.212.
27. Mutch P.G., Hadlow A.T. //J. Bone Joint Surg. – 2002. – V. 84-B. – Suppl. III. – P.285.
28. Nakamura Sh.-Ich., Takanashi K., Takanashi Yu. et al. //J. Bone Joint Surg. – 1996. – V. 78-B, N4. – P.606–612.
29. Olmarker K., Stromberg L., Blomquist J., Rydevik B. //J. Bone Joint Surg. – 1995. – V. 77-B. – Suppl. I. – P.22.
30. Piperno M., le Graverand M.P.H., Mathieu P. et al. //Spine. – 1997. – V. 22, N 18. – P.2061–2065.
31. Rothman S.L.G. //Orthop. Clin. North Amer. – 1996. – V. 27. – P.15–31.
32. Szypryt E.P., Hardy J.G., Hinton C.E. et al. //Spine. – 1998. – V. 13. – P.1042–1048.
33. Tertti M.O., Salminen J.J., Paajanen H.E.K. et al. //Radiology. – 1991. – V. 180, N 2. – P.503–507.
34. Ventura N., Huguet R., Cabrera M. //J. Bone Joint Surg. – 1995. – V. 77-B. – Suppl. I. – P.16.
35. Walters R.M., Smith S., Hutchinson M.J. et al. //J. Bone Joint Surg. – 2002. – V. 84-B. – Suppl. III. – P.211.
Медицинские новости. – 2007. – №1. – С. 39-45.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.