Последнее десятилетие характеризуется сменой взглядов на место и роль бета-адреноблокаторов (БАБ) в лечении больных хронической сердечной недостаточностью (ХСН) — от очень осторожного их использования до обязательного, независимо от функционального класса (ФК) тяжести. Свидетельством важности этой проблемы является факт проведения в течение короткого промежутка времени ряда крупных конгрессов (4-го Международного симпозиума по ХСН в г. Сорренто 16 ноября 2005 г., ежегодного форума «Сердечная недостаточность 2006» 17—19 июня 2006 в г. Хельсинки и пр.), материалы и доклады которых легли в основу данной статьи.
Практически сразу после внедрения БАБ в клинику в начале 1960-х годов попытка их применения у больных ХСН привела к драматическим последствиям. Первым сообщением на эту тему стала статья J.P. Stock [39], в которой был обобщен отрицательный опыт применения терапевтической дозы 75 мг пронетанола у трех пациентов с ХСН и с синусовой тахикардией. В частности, внутривенное введение препарата молодому человеку с недавно перенесенным инфарктом миокарда (ИМ) и явлениями ХСН снизило число сердечных сокращений (ЧСС) со 120 до 80 ударов в 1 минуту, но клиническое состояние его резко ухудшилось. В течение последующих 20 минут ЧСС прогрессивно уменьшалась, и наступила асистолия. Отрицательный клинический эффект был получен еще у двух пациентов. В связи с этим сформировалось мнение, что БАБ противопоказаны больным ХСН. Данное мнение стойко продержалось три десятилетия, несмотря на блестящий клинический эксперимент сотрудников проф. F. Waagstein [44] из Гетеборгского университета, проведенный в качестве «терапии отчаяния» 7 больным с тяжелым течением ХСН вследствие дилатационной кардиомиопатии (ДКМП). Исследователи предположили, что, несмотря на общеизвестное отрицательное действие БАБ на сократимость миокарда, они способны вызвать энергосберегающий эффект за счет удлинения периода диастолы («отдыха») сердца. Несмотря на достаточную условность этого предположения (с позиции сегодняшнего дня), смелый эксперимент по применению у 7 больных с ДКМП бета-адреноблокаторов увенчался успехом.
После осторожного, медленного титрования доз БАБ «вверх» (up-titration) в безнадежной ситуации у большинства пациентов достигнуты стабилизация состояния, улучшение сократительной функции миокарда и уменьшение размеров сердца. При крайне плохом прогнозе в условиях медицины того времени была достигнута стабилизация состояния больных в течение 6—62 месяцев. Произвольная же отмена БАБ сопровождалась значительным ухудшением течения ХСН или заканчивалась фатальным исходом. К сожалению, современниками этот замечательный опыт не был учтен.
В 1973 г. появились первые научные данные о тесной связи ХСН и активации симпатико-адреналовой системы (САС) [35] — звена терапевтического действия БАБ. В 1984 г. в результате анализа судеб 106 больных с клинически выраженной ХСН разной степени тяжести в течение 1—62 мес J.H. Cohn et al. [13] впервые установили, что уровень норадреналина плазмы крови является независимым показателем риска смерти. При этом степень активации САС повышается по мере нарастания тяжести клинического состояния пациентов уже с этапа бессимптомно протекающей левожелудочковой дисфункции [24]. Более того, по данным исследования SOLVD [6], содержание плазменного норадреналина — предиктор риска смерти не только при выраженной ХСН, но и при бессимптомно протекающей дисфункции левого желудочка (ЛЖ), а также риска смерти вследствие всех причин, повторных госпитализаций из-за ухудшения течения ХСН и развития острого коронарного синдрома.
Патофизиологические предпосылки. На ранней стадии ХСН активация САС чаще всего служит компенсаторным нейрогуморальным механизмом, итоговой целью которого является сохранение эффективного сердечного выброса и поддержание должного кровотока в органах и тканях. Системное давление в сосудах поддерживается за счет вазоконстрикции периферических сосудов, а сердечный выброс — за счет эффекта Франка—Старлинга и задержки жидкости.
Какое-то время повышение сократимости ЛЖ для облегчения должной систолы обусловлено увеличением диастолического напряжения. Но рано или поздно этот компенсаторный механизм становится неспособным сохранять адекватный сердечный выброс (СВ). Все больше крови остается в ЛЖ в конце диастолы, что ведет к растяжению миокарда. На этом этапе восстановление сократимости сердца осуществляется очень дорогой ценой — повышением давления в полости ЛЖ. Дальнейшее неизбежное падение СВ вызывает еще большую активацию САС и выраженную периферическую вазоконстрикцию с целью повышения системного давления [47]. После этапа повышения преднагрузки увеличивается постнагрузка, что обусловливает еще большее снижение СВ, повышение конечно-диастолического давления. В итоге это приводит к гипертрофии и дилатации правого желудочка. Такой процесс ремоделирования миокарда сопровождается гипертрофией и апоптозом кардиомиоцитов (КМЦ), ухудшением молекулярного фенотипа, что выражается в изменении генов и протеинов, а также структуры внеклеточного матрикса [8].
Активация САС играет важнейшую роль в ремоделировании сердечной мышцы, когда происходит некроз и фиброз КМЦ, фиброз внеклеточного матрикса, нарушается функция бета-1 рецепторов. Продолжительное повышение концентрации катехоламинов приводит к существенному снижению чувствительности бета-1-рецепторов к действию бета-агонистов, посредством которых реализуется способность миокарда к усилению систолической функции ЛЖ. Процесс перестройки рецепторного аппарата в результате хронического воздействия избытка норадреналина, сопровождающийся существенным снижением количества бета-1-рецепторов, носит название «down regulation», или десенсизации. Он происходит вследствие того, что рецепторы связаны с молекулами норадреналина. Развивается парадоксальная ситуация: несмотря на избыток норадреналина, сократительная функция миокарда не увеличивается, а падает [1]. В снижение СВ свой вклад вносит и «неполноценная», укороченная диастола, что обусловлено увеличением числа сердечных сокращений. Диастолическая дисфункция является также результатом повышения жесткости стенок ЛЖ вследствие фиброза КМЦ и внеклеточного матрикса. Эти нарушения ведут к электрическим изменениям в миокарде и развитию нарушений ритма, вплоть до фатальных.
В последние годы изменения сократимости миокарда и его механической функции рассматриваются с позиции перестройки сердца как «трехкомпонентного сэндвича». Причина такого интереса к данной теории лежит в потенциальных, еще не разработанных подходах к медикаментозной коррекции нарушений взаимодействия сокращений разных слоев миокарда. Как известно [36], эпикардиальные и эндокардиальные слои мышцы сердца ориентированы по его длиннику, а средние, составляющие 75% массы, — циркулярно. Сокращение эпикардиальных волокон и среднего слоя происходит с некоторым интервалом, т.е. асинхронно. Циркулярные миофибриллы обеспечивают основной вклад в формирование СВ, симметрично снижая объем ЛЖ в систолу, а продольные уменьшают его объем по продольной оси, внося свой вклад за счет дополнительного воздействия на систолический объем сердца. Такое слаженное взаимодействие разных слоев миокарда, подчиненное формированию адекватного СВ, нарушается при гипертрофии стенок сердца и (или) дилатации его камер, характерных для больных ХСН.
Активизация САС предшествует активизации ренин-ангиотензин-альдостероновой (РААС) системы, причем с этапа бессимптомной дисфункции ЛЖ, что можно проиллюстрировать на модели развития застойной формы ХСН как следствия перенесенного ОИМ (рис. 1).
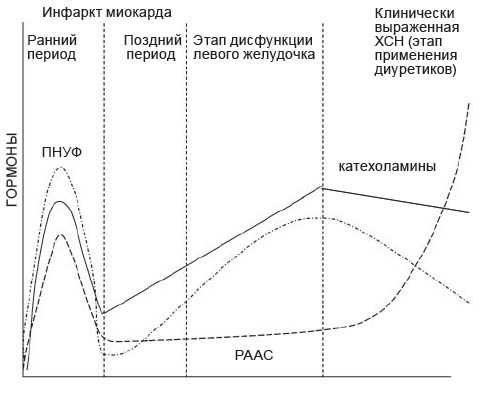
Рис. 1. Последовательность активизации нейрогуморальных систем САС и РААС от старта ХСН до ее выраженной клинической формы (адаптировано из S.D. Anker [4]). ПНУФ – предсердный натрийуретический фактор
Существенным аргументом в пользу применения БАБ является их ренопротективный эффект. Ингибируя активацию САС, они блокируют β1-рецепторы в юкстагломерулярных клетках почек, снижая высвобождение ренина и ингибируя действие гиперактивированной РААС. В то же время иАПФ оказывают влияние преимущественно на РААС.
Ренопротективное действие БАБ. Дисфункция почек является независимым предиктором плохого прогноза течения ХСН [26, 27]. Почечная недостаточность (ПН) разной степени выраженности наблюдается у 20—50% больных ХСН. По данным L.F. Fried et al. [26], у пожилых пациентов в случаях подъема плазменного креатинина ≥ 1,7 мг/дл риск развития ХСН удваивается по сравнению с группой лиц с содержанием креатинина < 1,1 мг/дл.
Важен также следующий аспект. У 10—20% больных ХСН пожилого возраста поддержка шаткой компенсации уже нарушенной функции почек осуществляется посредством действия ангиотензина-II (АНГ-II). В таких случаях его блокада иАПФ или блокаторами АТ1-рецепторов АНГ-II (АРА) может привести к резкому ухудшению почечной функции [5]. Кроме того, как выяснилось из исследования SOLVD, применение иАПФ (в данном случае эналаприла) повышает риск развития дисфункции почек, особенно у пациентов с тяжело протекающей ХСН, получающих диуретики, и при наличии сахарного диабета (СД). Данное замечание существенно, поскольку весьма распространена точка зрения, что иАПФ и АРА — нефропротекторы, особенно у больных СД [2]. Это правильно, но у части пациентов с почечной дисфункцией БАБ являются препаратами выбора, снижая смертность независимо от уровня креатинина (субисследование CIBIS II при использовании бисопролола [18]). Кроме того, БАБ при ХСН вызывают множество полезных, не до конца понятых эффектов:
- снижают симпатический тонус;
- повышают тонус вагуса;
- улучшают взаимоотношение «сила-частота»;
- улучшают уровень потребления О2 миокардом (соотношение «работа/О2»);
- уменьшают субэндокардиальную ишемию;
- повышают вариабельность сердечного ритма;
- снижают дисперсию QT;
- вызывают восстановительный эффект при уже нарушенной вариабельности сердечного ритма;
- нормализуют баланс фосфорных соединений, обеспечивающих энергетику сердца;
- снижают высвобождение ренина;
- уменьшают продукцию и выброс эндотелина;
- повышают обратный захват норадреналина;
- восстанавливают регуляцию функционирования бета-адренергических рецепторов;
- снижают количество циркулирующих воспалительных цитокинов;
- оказывают противодействие аутоантителам против бета1-рецепторов;
- могут оказывать антиоксидантное действие.
Многочисленные попытки повысить эффективность терапии больных ХСН с использованием лекарств с положительным инотропным действием на миокард, которые вызывали временный благоприятный эффект в отношении клинического течения заболевания, закончились неудачей при долговременном использовании этих препаратов. Милринон, эноксимон, веснаринон, пимобендан и др. повышали смертность пациентов (PROMISE – Prospective Randomized Milrinone Survival Evaluation [30]; OPTIME–HF – Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbation of Chronic Heart Failure [21]). Даже относительно новое лекарство левосеминдан, оказывающее выраженное инотропное действие без увеличения внутриклеточного содержания Са2+ в миофибриллах и цАМФ, при внутривенном введении тяжелым больным улучшает 6-месячную выживаемость [23], за исключением лиц, нуждающихся в постоянной инотропной поддержке ([3], J. Lopez-Sendon, 2004). Применение новых нейрогормональных антагонистов принесло разочарование. Самый известный из них — омапатрилат — лекарство с двойным действием (ингибитор АПФ и нейтральной эндопептидазы – НЭП). Несмотря на его способность блокировать эндогенные механизмы вазоконстрикции (ингибируя АПФ) и препятствовать разрушению НЭП — важного фактора вазодилатации, препарат не имеет преимуществ перед обычной терапией ХСН, что доказало его сравнение с эналаприлом [31]. Аналогичная ситуация и с антагонистом рецепторов эндотелина бозентаном [32]. Антагонист имидазолиновых рецепторов моксонидин увеличил летальность и смертность больных с ХСН [14], что послужило основанием для досрочного прекращения исследования MOXCON. Бесполезными оказались и антицитокиновые препараты, в частности блокатор фактора некроза опухоли этанерсепт [15, 29].
Влияние БАБ на число сердечных сокращений. Из неполного списка перечисленных благоприятных эффектов БАБ при ХСН наибольший практический интерес представляет их хроническое действие. В классических работах H.J. Levine [28] показано, что в мире живых существ с бьющимися сердцами существует зависимость между ЧСС и продолжительностью жизни (рис. 2). Хотя у разных животных она различается более чем в 35 раз, в течение жизни у всех теплокровных ЧСС является величиной сравнительно постоянной. Иллюстрацией зависимости продолжительности жизни от ЧСС может служить следующий пример. У галапагосской черепахи ЧСС составляет 6 ударов в 1 минуту, и она живет около 177 лет; у крысы – 240 ударов в 1 минуту, ее продолжительность жизни — около 5 лет [37]. У здорового человека сердце синтезирует и потребляет огромное количество АТФ – 30 кг в сутки, т.е. намного больше, чем пищи. На каждое сердечное сокращение необходимо 108 молекул О2 и 300 мг АТФ [22], что составляет 11000 кг в год. Возможность митохондрий адекватно синтезировать АТФ ограничена самой Природой. R. Ferrari [22] отмечает, что снижение ЧСС у человека с 70 до 60 ударов в 1 минуту может повысить продолжительность жизни с 80 до 93,3 года.
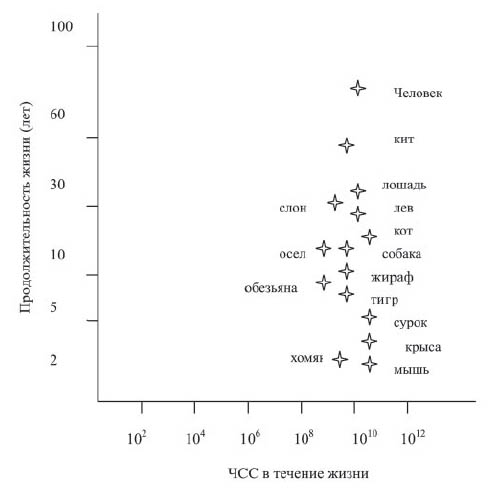
Рис. 2. Взаимоотношения между продолжительностью жизни животных и общим ЧСС в течение всей жизни (по H.J. Levine [28])
Хорошо известно, что учащенное сердцебиение у больных ХСН — косвенное свидетельство гиперактивации САС. При анализе данных ряда крупных исследований (GISSI-3, CONSENSUS [16]) установлено, что увеличение ЧСС — независимый предиктор как госпитальной, так и амбулаторной смертности [49], особенно с исходной частотой пульса более 85 ударов в минуту [16] и дисфункцией ЛЖ (ФВ<40%) [40]. У таких пациентов отмечаются также частые эпизоды дестабилизации течения ХСН.
Кроме не оцененного современниками первого положительного клинического опыта F. Waagstein et al. [44] по применению БАБ у больных с ХСН, в 1979 г. группой проф. K. Swedberg [41] были опубликованы результаты долговременной терапии БАБ 24 больных с ДКМП. Сравнительный анализ с группой контроля из 13 пациентов, получавших только препараты дигиталиса и диуретики, показал, что выживаемость лиц, леченных БАБ, составила 52% против 10% в группе контроля.
Первым значительным долговременным, но безрезультативным исследованием по изучению эффективности бета-адренергической блокады у больных с ДКМП было исследование МDС (Metoprolol in Dilated Cardiomyopathy [45]). Причиной провала оказался БАБ: использовался не метопролола сукцинат, как в последующие годы (MERIT-HF, 1999), а метопролола тартрат, т.е. лекарство короткого действия. Его неэффективность была продемонстрирована и в исследовании COMET [33], в котором он применялся не в дозе 150 мг/сут, как в МDС, а 85 мг/сут.
О преимуществах метопролола сукцината для лечения сердечной недостаточности подробно читайте здесь - http://lechenie-gipertonii.info/metoprolol.html. Узнайте, в каких ситуациях лучше назначать метопролол, а в каких - конкурирующие бета-блокаторы (бисопролол, небиволол, карведилол).
На сателлитном симпозиуме в Хельсинки, проведенном в рамках Европейского конгресса «Heart Failure» Ph. Lechat (Франция), R. Willenheimer (Швеция), F. Follath (Швейцария) и D.J. van Veldhuisen (Нидерланды), обсуждались уроки исследования CIBIS-III, суть которых может быть сведена к двум важным для клинициста-практика обстоятельствам.
Со времени первого многоцентрового крупного и корректно проведенного исследования по применению БАБ (бисопролола) у больных с ХСН с целью изучения влияния бета-адреноблокады на смертность пациентов — CIBIS (Cardiac Insufficiency Bisoprolol Study [10]) прошло 19,5 года, а более успешного CIBIS II [11] — почти 8 лет. Выводы последнего были триумфальными: применение бисопролола (в РБ и РФ — конкора) у 2647 больных с ХСН ишемической и неишемической этиологии привело к 34%-ному снижению смертности от всех причин, госпитализаций — на 20%, в том числе на 36% — по причине дестабилизации ХСН, а внезапной смерти — на 44% !
Еще одно обстоятельство предшествовало изучению возможностей использования бисопролола для оценки перспективы монотерапии у больных с ХСН с целью улучшения прогноза течения заболевания и повышения выживаемости. Этим обстоятельством стали результаты метаанализа [20] исследования SOLVD [37,38]. В частности, в SOLVD Prevention [38] установлено, что у лиц с асимптомно протекающей дисфункцией ЛЖ с низкой ФВ смертность снижается только в том случае, если кроме фонового (плацебо) приема эналаприла пациенту назначается БАБ. В SOLVD Treatment [37] установлено, что максимально полезный клинический эффект у больных с ХСН достигается в том случае, если назначается комбинация эналаприла и БАБ, и тогда существенно повышается выживаемость. При проведении монотерапии влияние БАБ на показатель смертности было больше, нежели эналаприла. В своем докладе по этому вопросу проф. F. Follath (Швейцария) отметил следующий малоизвестный факт: выживаемость женщин ниже, чем мужчин; прогноз у лиц с коморбидными состояниями (ХОБЛ, сахарный диабет, почечная недостаточность) плохой. Анализируя реальную картину, автор доклада подчеркнул, что на практике дозы рекомендуемых лекарств для лечения ХСН намного ниже, чем достигнуты в триалах: в среднем реально назначаемая суточная доза каптоприла составляет в странах ЕС 57,6 мг (вместо 150 мг), лизиноприла 12,3 мг, периндоприла 3,1 мг, эналаприла 14,3 мг, карведилола 17,6 мг, бисопролола 4,7 мг (т.е. почти в 2 раза меньше целевых).
Dirk J. van Veldhuisen (Нидерланды) подчеркнул следующее чрезвычайно важное обстоятельство: назначение БАБ при ХСН, особенно на ранних стадиях, — единственный, проверенный жизнью способ борьбы с внезапной смертью. Эффективность борьбы зависит от дозы БАБ. Если, например, бисопролол назначается хотя бы в дозе ? 50% рекомендуемой (целевой), смертность и частота госпитализации пациентов вследствие дестабилизации ХСН снижаются на 34–57% (в среднем на 47%), назначение небиволола в целевой (10 мг) дозе ведет к уменьшению этих показателей на 30%, в дозе 5 мг – на 15–20%, 1,25–2,5 мг – на 5—10%. То есть титрование дозы «вверх» должно проводиться не только у иАПФ, но и у БАБ.
R. Willenheimer (Швеция) заметил, что титровать иАПФ и БАБ одновременно практически невозможно. Если терапию назначают с титрования первым иАПФ, то его целевая доза достигается у 90% пациентов, бисопролола — у 82%. Если титрование стартует с бисопролола, его целевая доза достигается у 86% больных, иАПФ—у 72%. Но именно в этом случае у больных с низкой ФВ достигается ее повышение.
Уроки CIBIS III. В лекции «Уроки, выученные из CIBIS III» D. J. van Veldhuisen отметил, что БАБ, в частности бисопролол, являются альтернативой иАПФ при их разумном применении. БАБ прошли путь от лекарств, противопоказанных при ХСН, до обязательных в лечении этой тяжелой категории больных. На 3-м международном симпозиуме по сердечной недостаточности, прошедшем 27 ноября 2004 г., проф. S. Anker (Германия), резюмируя данные метаанализа предшествующей программы CIBIS II, подчеркнул тот малоизвестный факт, что назначение бисопролола предупреждает развитие такого грозного осложнения, как кахексия. В целом, отметил докладчик, при ХСН «толстый живет дольше», а в этом контексте «толстый» значит «жирный», поскольку именно масса жира является предиктором смертности. Вес же тела сам по себе может определяться конституцией человека или, например, наличием отеков. Установлено, что при ХСН повышение индекса массы тела на одну единицу снижает риск смерти на 3,5%. В исследовании CIBIS II назначение бисопролола пациентам с ХСН в течение 12 мес позволило повысить вес тела на 800 г, спустя 2 года – на 1,2 кг, чего не отмечено в группе плацебо.
Бисопролол против внезапной смерти. Заглавие раздела отражает то, что впервые было доложено в г. Хельсинки. Предупреждение внезапной смерти (ВС) — одна из важнейших задач при лечении ХСН. ВС — это, как правило, смерть вследствие сердечных причин в течение 1 часа от момента появления острых симптомов [38]. Это причина смерти половины больных кардиологического профиля в индустриально развитых странах [48]. В США жертвами ВС ежегодно являются более 400000 пациентов [34]. Подавляющее их число умирает вне стационара вследствие жизненно опасных аритмий.
По данным Маастрихтского исследования [43], у 80% больных ВС наступает дома, а выживаемость составляет только 8%. По сравнению со здоровыми людьми риск смерти у пациентов с ХСН выше в 6—9 раз [3] и составляет более половины смертей при ХСН II и III ФК, а также при выраженной левожелудочковой дисфункции. Более тяжелые пациенты (ФК IV) умирают от прогрессирующей ХСН.
Как показали результаты метаанализа исследования AVID (Antiarrhythmics Versus Implantable Defibrillator), у лиц с высоким риском ВС применение БАБ уменьшило этот риск на 53% [19]. У постинфарктных больных назначение БАБ снижает риск ВС на 28—47%, в то время как иАПФ — только на 3—26% [25].
Предполагается, что антиаритмическое действие БАБ как протекторов ВС реализуется посредством их прямого β1-блокирующего действия. В здоровом сердце β1-рецепторы составляют около 77% всех бета-адренорецепторов [7], а отношение β1- к β2-рецепторам равно 80:20. При повышении концентрации норадреналина в плазме крови, т.е. ситуации, характерной для ХСН, наблюдается перераспределение β1- и β2-адренорецепторов (65:35). Причиной такого ремоделирования рецепторной системы сердца и развития вышеупомянутого феномена «down regulation» является то обстоятельство, что аффинность норадреналина к β1-рецепторам выше, чем к β2- или β1-рецепторам (20:1:2), и молекулы норадреналина могут связывать до 88—90% бета-рецепторов именно β1-субтипа [7]. Не исключено, что во многом этим и определяется эффективность БАБ как средств борьбы с аритмической ВС, особенно высокоселективных к β1-рецепторам [9], таких как бисопролол. В этом плане безусловно интересным является тот факт, что если бисопролол назначать первым, т.е. титрование начинать не с иАПФ, а с БАБ, то, по данным CIBIS III, смертность уменьшается на 31% (Р < 0,065) [47].
Нам представляется, что стартовать с БАБ необходимо в том случае, если у больных ИБС отмечаются частые приступы стенокардии. В подобных ситуациях иАПФ неэффективны, а БАБ действуют на первопричину ангинозного синдрома — ишемию миокарда.
1. Атрощенко Е.С. Бета-адреноблокаторы в лечении хронической сердечной недостаточности. – Минск: Белпринт, 2003.
2. Атрощенко Е.С. Фармакотерапия нарушений метаболизма миокарда у больных с хронической сердечной недостаточностью с помощью цитопротекторов.— Минск: Белпринт, 2005.
3. (AHA): American Heart Association. Heart disease and stroke statistics – 2005 update // http: www. americanheart. org / downloadable / heart / 1105390918119HDSStats 2005 Update. Pdf / December 2005.
4. Anker S.D. // Eur. Heart J. – 1998. – V. 19, Suppl. F. – P. F56—F61.
5. Bart B.A. // Amer. Heart J. – 1999. – V. 138. – P. 801—803.
6. Benedict C.R., Shelton B., Johnstone D.E. et al. // Circulation. – 1996. – V. 94. – P. 690—697.
7. Bristow M.R., Ginsburg R., Umans V. et al. // Circ. Res. – 1986. – V. 59. – P. 297—309.
8. Bristow M.R. // Lancet. – 1998. – V. 352, Suppl. 1. – P. S8—S14.
9. Bristow M.R., Feldman A.M., Adams K.F.Jr., Goldstein S. // J. Cardiol. Fail. – 2003. – V. 9. – P. 444—453.
10. CIBIS Investigators and Commitees. A randomized trial of beta-blockade in heart failure. The cardiac insufficiency bisoprolol study (CIBIS) // Circulation. – 1994. – V. 90. – P. 1765—1773.
11. CIBIS II Investigators and Commitees. The cardiac insufficiency bisoprolol study II (CIBIS II): a randomized trial // Lancet. – 1999. – V. 353. – P. 9—13.
12. Cleland J.G.F., Chattopadhyay S., Khand A. et al. // Heart Fail. Rev. – 2002. – V. 70. – P. 229—242.
13. Сohn J.N., Levine T.B., Olivari M.T. et al. // New Engl. J. Med. – 1984. – V. 311. – P. 819—823.
14. Сohn J.N., Pfeffer M.A., Rouleau J. et al. // Eur. J. Heart Fail. – 2003. – V. 5. – P. 659—667.
15. Coletta A.P., Clark A.L., Banarjee P., Cleland J.G. // Eur. J. Heart Fail. – 2002. – V. 4. – P. 559—561.
16. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the COoperative North Scandinavian ENalapril SUrvival Study (CONSENSUS) // New Engl. J. Med. – 1987. – V. 316. – P. 1429—1435.
17. Dries D.L., Exner D.V., Domanski M.J. et al. // J. Amer. Coll. Cardiol. – 2000. – V. 35. – P. 681—689.
18. Erdmann E., Lechat P., Verkenne P., Wiemann H. // Eur. J. Heart Fail. – 2001. – V. 3. – P. 469—479.
19. Exner D.V., Dries D.L., Waclawiw M. et al. // J. Amer. Coll. Cardiol. – 1999. – V. 33. – P. 916—923.
20. Exner D.V., Reiffel J.A., Epstein A.E. et al // J. Amer. Coll. Cardiol. – 1999. – V. 34. – P. 325—333.
21. Felker G.M., Benza R.L., Chandler A.B. et al. // J. Amer. Coll. Cardiol. – 2003. – V. 41. – P. 997—1003.
22. Ferrari R. // Eur. Heart J. Suppl. – 2003. – V. 5, Suppl. G. – P. G1—G2.
23. Follath F., Cleland J.G., Just H. et al. // Lancet. – 2002. – V. 360. – P. 196—202.
24. Francis G.S., Benedict C., Johnstone D.E. et al. // Circulation. – 1990. – V. 82. – P. 1724—1729.
25. Freemantle N., Cleland J., Young P. et al. // Brit. Med. J. – 1999. – V. 318. – P. 1730—1737.
26. Fried L.F., Shipak M.G., Crump C. et al. // J. Amer. Coll. Cardiol. – 2003. – V. 41. – P. 1364—1372.
27. Hillege H.L., Girbes A.R., de Kam P.J. et al. // Circulation. – 2000. – V. 102. – P. 203—210.
28. Levine H.J. // J. Amer. Coll. Cardiol. – 1997. – V. 30. – P. 1104—1106.
29. Mann D.L., McMurray J.J., Packer M. et al. // Circulation. – 2004. – V. 109. – P. 1594—1602.
30. Packer M., Carver J.R., Rodeheffer R.J. et al. // New Engl. J. Med. – 1991. – V. 325. – P. 1468—1475.
31. Packer M., Califf R.M., Konstam M.A. et al. // Circulation. – 2002. – V. 106. – P. 920—926.
32. Packer M., McMurray J., Massie B.M. et al. // J. Card. Fail. – 2005. – V. 11. – P. 12—20.
33. Pool-Wilson P.A., Swedberg K., Cleland J.G. et al. // Lancet. – 2003. – V. 362. – P. 7—13.
34. Richter S., Duray G., Gronefeld G. et al. // Circ. J. – 2005. – V. 69. – P. 625—629.
35. Rutenberg H.L., Spann J.F. // Amer. J. Cardiol. – 1973. – V. 32. – P. 472—480.
36. Silke B. // Eur. Heart J. Suppl. – 2006. – V. 8, Suppl. C. – P. C13—C18.
37. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ejection fractions and congestive heart failure // New Engl. J. Med. – 1991. – V. 325. – P. 293—302.
38. The SOLVD Investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions // New Engl. J. Med. – 1992. – V. 327. – P. 685–691.
39. Stock J.P. // Amer. J. Cardiol. – 1996. – V. 18. – P. 444—449.
40. Sutton St. J. M., Pfeffer M.A., Moye L. et al. // Circulation. – 1997. – V. 96. – P. 3294—3299.
41. Swedberg K., Hjalmarson A., Waagstein F., Vallentin I. // Lancet. – 1979. – V. 1. – P. 1374—1376.
42. Vanoli E., Adamson P.B. // Eur. Heart J. Suppl. – 2006. – V. 8, Suppl. C. – P. C51—C57.
43. de Vreede-Swagemakers J.J., Gorgels A.P., Dubois-Arbouw W.I. et al. // J. Amer. Coll. Cardiol. – 1997. – V. 30. – P. 1500—1505.
44. Waagstein F., Hjalmarson A., Varnauskas E., Vallentin I. // Brit. Heart J. – 1975. – V. 37. – P. 1022—1036.
45. Waagstein F., Bristow M.R., Swedberg K. et al. // Lancet. – 1993. – V. 342. – P. 1441—1446.
46. Willenheimer R., Van Veldhuisen D.J., Silke B. et al. // Circulation. – 2005. – V. 12. – P. 2426—2435.
47. Zelis R., Flaim S.F. // Progr. Cardivasc. Dis. – 1982. – V. 24. – P. 437—459.
48. Zipes D.P., Wellens H.J. // Circulation. – 1998. – V. 98. – P. 2334—2351.
49. Zuanetti G., Mantini L., Hernandez-Bernal F. et al. // Eur. Heart J. – 1988. – V. 19, Suppl. F. – P. F19—F26.
Медицинские новости. — 2007. — №8. — С. 14—18.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.