Инфекционно-токсический шок (ИТШ) является частым осложнением генерализованных форм менингококковой инфекции (ГФМИ) и представляет собой каскад эндогенных реакций, инициированных компонентом клеточной стенки менингококка, в результате которых развиваются нарушения микроциркуляции и, как следствие, снижается перфузия кислорода в ткани.
Пусковой фактор каскада патогенетических реакций — менингококковый липополисахарид (ЛПС) [3, 5]. Сама по себе субстанция специфична не только для менингококка и встречается у многих микроорганизмов (сальмонеллы, шигеллы, стрептококки и др.) - ЛПС не является высокотоксичным веществом. По прямому биологическому эффекту он значительно уступает экзотоксинам (в 1 млн раз слабее токсина ботулизма) [2]. Его патофизиологический и клинический эффекты обусловлены активацией и высвобождением ряда биологически активных субстанций самого макроорганизма [3, 5, 6, 15]. В настоящее время можно считать установленным, что быстрота развития шока зависит от количества поступившего в организм ЛПС. Проведена параллель между содержанием ЛПС в сыворотке крови пациента и тяжестью шока [3, 12]. Нет оснований также отрицать взаимосвязь между выраженностью шока и кратностью введения токсических субстанций в эксперименте. Индуцирование синдрома Санарелли-Швартцмана — неотъемлемое свойство ЛПС. Существуют патоморфологические модели шока, полученные при двукратном введении токсина. Наличие у некоторых микроорганизмов, в том числе у N. meningitis, экзогенной токсической субстанции, содержащей ЛПС в минимальном количестве (blebs), наводит на мысль о возможности предварительной сенсибилизации организма больного малыми дозами ЛПС. Подобный взгляд подтверждается клиническими и экспериментальными исследованиями при тяжелом шоке с выраженным геморрагическим синдромом.
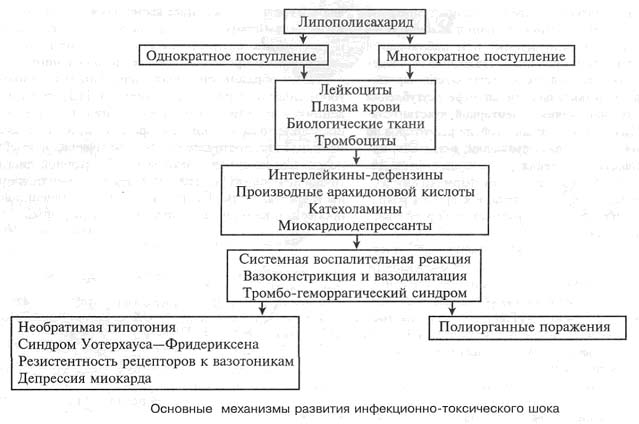
В основе патогенетических механизмов ИТШ лежит действие цитокинов, обусловленное влиянием ЛПС (рисунок). Выброс интерлейкинов существенно определяет развитие интоксикационного синдрома, системной воспалительной реакции. Фактор некроза опухолей (ФНО) — одна из важнейших субстанций, которой придается особое значение в развитии тканевых поражений. Массивный выброс ФНО осуществляется в течение первых часов заболевания. В последующем он фиксируется на рецепторных тканевых структурах, вызывая их повреждение. Ориентация на уровень ФНО крови в качестве маркера степени интоксикации неверна, так как с первых часов заболевания он уходит в ткани и его сывороточная концентрация не соответствует как выраженности токсического синдрома, так и степени органных поражений. Однако количественное определение в крови белковых структур, фрагментов специфического рецептора к ФНО, представляется вполне клинически оправданным, так как их содержание соответствует количеству ФНО, связавшемуся с тканями [6, 7, 9, 14].
В настоящее время существенная роль в развитии синдрома полиорганных поражений отводится интерлейкину 8 (IL 8). Его выброс под влиянием ЛПС и фиксации с тканями приводит к хемотаксису нейтрофилов и "дефензиновому взрыву". При этом происходит массивное повреждение тканей дефензинами, что в конечном счете обусловливает развитие синдрома полиорганной недостаточности. На ряд патогенетических звеньев при шоке значительное влияние оказывают производные арахидоновой кислоты, и прежде всего простагландины. Если их участие в развитии полиорганных поражений изучено недостаточно, то несомненна ключевая роль в патогенезе интоксикационного синдрома.
Инициальная стадия тяжелой бактериальной интоксикации, как правило, сопровождается вазоспастическим компонентом. Он обусловлен массивным выбросом катехоламинов (КА), содержание которых значительно на всех этапах развития ИТШ. Кроме вазоспастического эффекта, существенной представляется возможность прямого воздействия КА на миокард, сосудистую стенку, тромбоциты и т. д. Подобное влияние приводит к развитию депрессии миокарда, нарушению сосудистой проницаемости, тромбогеморрагическому синдрому (ТГС) [4, 6, 13].
Клинико-экспериментальные данные свидетельствуют о фазовой последовательности изменений гемодинамических показателей при развитии ИТШ. Первоначальный период интоксикации характеризуется гиперкинетическими изменениями, проявляющимися тахикардией, возрастанием периферического сосудистого сопротивления и минутного объема крови. Выраженная централизация кровообращения приводит к выключению из активного кровообращения значительной части крови. Возникает состояние, называемое "дегидратация без дегидратации". В этой стадии нарастают микроциркуляторные нарушения. Вторая характерная особенность гемодинамических изменений при шоке — развитие депрессии миокарда. Это проявляется резким падением артериального давления за счет снижения ударного и минутного объема. Страдает сократительная функция миокарда, что выражается в существенном снижении остаточного систолического и диастолического объема. Клинически нарастают явления сердечной недостаточности, аритмии, которые объясняются прямым влиянием эндогенных миокардиальных депрессантов, а также снижением коронарного кровообращения. Третья гемодинамическая особенность при ИТШ — снижение периферического сосудистого сопротивления на фоне падения ударного объема крови. Эта фаза сопровождается усугублением ТГС и развитием полиорганной недостаточности. Основная клиническая черта — необратимая гипотония, развивающаяся на фоне полиорганных поражений и усугубляющегося ацидоза. Естественно, что клиническая картина данной фазы полиморфна и иногда вызывает затруднения в правильной трактовке [11].
Синдром Уотерхауса — Фридериксена, представляющий собой массивные кровоизлияния в гормонопродуцирующие органы (надпочечники, щитовидную железу и т. д.), часто встречается у погибших при ИТШ менингококкового генеза. Рядом экспериментальных классических работ доказано, что в развитии этого синдрома значительную роль играют стрессовые механизмы. Другими словами, сводить развитие необратимой гипотонии при ИТШ только к "надпочечниковым поражениям" неправомерно. Кроме того, гибель пациента наступает не только вследствие развития этого синдрома, а изменения в надпочечниках не всегда соответствуют уровню гипотонии.
С самого начала ИТШ характеризуется значительным выбросом в кровь катехоламинов, сохраняющимся в течение всего заболевания. Если в начальной стадии процесса это приводит к появлению гиперкинетической реакции, то в терминальной стадии на фоне выраженной катехолемии развивается необратимая гипотония. Введение ряда фармакологических средств, направленных на подъем артериального давления, дает иногда неожиданный фармакодинамический эффект или наблюдается полная резистентность к препарату. Подобные наблюдения свидетельствуют, во-первых, об усугублении нарушения рецепторной чувствительности по мере усугубления ИТШ; во-вторых, нарушения рецепторной чувствительности не могут быть сведены лишь к гибели рецепторов по мере усугубления мембранных поражений; в-третьих, наблюдается этапность выпадения рецепторных функций. Поэтому резистентность к некоторым фармакологическим препаратам может отсутствовать, а к другим сохраняться. Все это значительно затрудняет выбор адекватного лечения при ИТШ [4, 8, 10, 11].
Многообразие патогенетических механизмов, отчетливая фазность процесса, индивидуальные особенности макроорганизма (в первую очередь состояние сердечнососудистой системы и иммунитета) обусловливают разнообразие вариантов течения ИТШ. Это, естественно, затрудняет клиническую идентификацию ИТШ при ГФМИ. Традиционно врачи-практики связывают тяжесть состояния больных при менингококцемии со степенью выраженности и распространенностью геморрагической сыпи. Действительно, ТГС придается особое значение в патогенезе ИТШ. Морфологически тяжелый ТГС во многом определяет патологоанатомическую картину ИТШ. Выраженность кожных проявлений, усугубление лабораторных признаков ТГС реально обусловливают раннее распознавание заболевания и тактику интенсивной терапии больного. Однако существенным представляется наличие клинических форм шока, протекающих с незначительной геморрагической сыпью и при ее полном отсутствии, например кишечные, легочные, почечные и т. д. Поэтому, не отрицая значимости геморрагических проявлений в оценке тяжести больных менингококцемией, видимо, следует согласиться с существующими ныне критериями постановки диагноза ИТШ, в основе которых лежит степень выраженности гемодинамических и микроциркуляторных расстройств. Такими клиническими признаками, в совокупности свидетельствующими о наличии у больных ИТШ на фоне ГФМИ, являются снижение артериального давления на 30% (или на 50 мм рт. ст. по сравнению с исходными показателями у гипертоников), отсутствие или значительное ослабление периферического пульса, расстройства микроциркуляции, олигурия [1,8]. Лабораторными критериями тяжести ИТШ являются лейкоцитоз (не ниже 10,0 • 109/л), тромбоцитопения (ниже 100,0 • 109/л), уровень фибриногена ниже 1,5 г/л, а также декомпенсированный ацидоз. Несмотря на использование сложных лабораторных методов, в литературе просматривается тенденция к поиску наиболее простых клинических критериев для объективизации диагноза ИТШ. При всех очевидных преимуществах такого подхода, позволяющего распознать это состояние в клинике любого уровня, в настоящее время назрела необходимость в разработке новых критериев, дающих возможность точно и всесторонне оценить тяжесть и ведущие патогенетические звенья процесса у конкретного больного.
Таким образом, оценивая современные клинико-патогенетические взгляды на патогенез ИТШ, отметим тенденцию к практическому преломлению накопленных в последние годы знаний по теории шока, их перспективность для диагностических, прогностических и лечебных целей. Современные подходы к лабораторной диагностике и лечению ИТШ должны быть строго индивидуальны и требуют четкой корректировки в отношении фазы процесса и клинического варианта течения шока.
Литература
1.Bikardin К., Grau G. Е., DayerJ. М. et al. // Engl. J. Med. –1988. – N 319. – P. 397–400.
2.Braude A. I. // Bacterial Exotoxins. – 1986. – P. 42.
3. Casey L. C., Balk R. A., Bone R. C. // Ann. Intern. Med. – 1993. – V. 119, N 8. – P. 771–778.
4. Deich E. A. // Ann. Surgery. – 1993. – V. 216, N 2. – P. 117–134.
5. Dinarello C. A., Cannon J. G. // Ann. Intern. Med. – 1993. – V. 119, N 8. – P. 853–854.
6.Guidet В., Staikowsky F., Offenstadt G. // Rev. Prat. – 1993.–V. 43, N 1. – P. 13–17.
7. Lamt N., Deby–Dupont G., Damas P. // Rev. Prat. – 1993. – V. 43, N 1. – P. 19–25.
8. Leclerc F., Beusart R., Diependall F. et al. // Intensive Care Med. – 1985. – V. 11. – P. 140–143.
9.Nariano J. L, Bolanos J., Gonialei B. // Med. Clin. Bare. – 1993. – V. 100, N 8. – P. 305–315.
10. Ono S., Tamakuma S., Mochiluki H. et al. // Surg. Today. – 1993. - v. 23, N 3. – P. 229–233.
11. Padua G., Mastroni P., Piredda G. // Minerva Anestesiol. – 1992. – V. 58, N 5. – P. 297–300.
12. Roman J., Fernandel F., Velasco F. // Acta Paediatr. – 1993.–V. 82, N 4. – P. 352–354.
13. Tons C., Wlosterhalfen R., Wlinge U. et al. // Langenbecks Arch. Chir. – 1993. – V. 378, N 4. – P. 217–232.
14. Vincent J. L., BakkerJ., Marecaux G. et al. // Chest. – 1992.–V. 101, N 3. – P. 810–815.
15.Weinberg E. // Acta Physiol. Scand. (Suppl.). – 1993. – V.611. – P. 1–72.
Медицинские новости. – 1997. – № 3. – С. 22-24.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.