Функция сердца как эндокринного органа впервые выявлена в 1985 г., когда De Bold et al. определили натрийуретическое действие экстракта предсердий у крыс. Известно несколько гормонов, секретируемых в предсердиях и различающихся по количеству аминокислот [24]. Предсердный натрийуретический фактор (ПНУФ) определяется вплазме и тканях-мишенях [4, 44, 48]. Действие предсердного натрийуретического гормона осуществляется через высокоспециализированные рецепторы, которые обнаружены на базолатеральных мембранах клеток коры почек, гладкомышечных клетках артерий, коре надпочечников и гипофиза, а также в легких, печени, цилиарном теле глаза, тонком кишечнике, на тромбоцитах и клетках щитовидной железы [1, 29]. С помощью синтетического ПНУФ было показано, что в головном мозге имеется большое количество мишеней для этого пептида, который действует на структуры, отвечающие за регуляцию давления крови, содержание электролитов и количество воды в организме. Воздействуя на гипоталамус, ПНУФ подавляет секрецию вазопрессина [27].
Установлено, что взаимодействие ПНУФ со специфическими рецепторами осуществляется при непосредственном участии циклического гуанозинмонофосфата, который выполняет в клетках функцию посредника, "второго мессенджера": цГМФ передает внутриклеточным структурам информацию о взаимодействии ПНУФ со специфическими рецепторами [15, 34].
Предсердный натрийуретический гормон вызывает разнообразные физиологические эффекты, оказывая влияние на ренин-ангиотензин-альдостероновую систему [27]. Известно, что ПНУФ уменьшает секрецию ренина, осуществляемую клетками юкстагломерулярного аппарата, снижает уровень секреции альдостерона, стимулированной ангиотензином II и адренокортикотропином в клетках клубочковой зоны коры надпочечников, что приводит к снижению скорости стероидогенеза [13]. Под влиянием ПНУФ уменьшается продукция и ингибируется активность вазопрессина в органах-мишенях, а также подавляется эффективность ангиотензина II: замедление клубочковой фильтрации, увеличение реабсорбции натрия и воды [28]. Предсердный натрийуретический фактор по своему действию на органы-мишени является антагонистом прессорной системы ренин—ангиотензин—альдостерон и находится в постоянном равновесии с ней, что позволило определить атриопептидную систему как релаксантную [53]. В последние годы релаксантную атриопептидную систему рассматривают как ингибирующую стероидогенез в надпочечниках блокированием стимулирующего влияния АКТГ, что вызывает понижение в плазме крови концентрации не только альдостерона, но и кортизола, прямо ингибирует освобождение ренина в почках, увеличивает содержание инсулина в плазме [47, 48].
Многочисленными исследованиями установлено, что ПНУФ непосредственно воздействует на различные структуры почек, вызывая быстрый и сильный диурез и натрийурез [13, 43]. Диуретический эффект ПНУФ связывают с его релаксирующим действием на сосуды почек и с увеличением медуллярного кровотока и плазмотока, а также с непосредственным влиянием на почечные канальцы, что способствует снижению интенсивности реабсорбцил натрия и воды в этих отделах нефрона [4, 42].
Атриальный натрийуретический фактор оказывает выраженное спазмолитическое действие на гладкомышечные клетки сосудов, кишечника, осуществляя свое влияние путем активации гуанилатциклазы на уровне специфических рецепторов [20].
Изучая действие предсердного натрийуретического фактора на микрососуды и его взаимодействие сL1-и L2-адренорецепторами, исследователи пришли к выводу, что ПНУФ мало влияет на L2-рецепторы, а преимущественно ингибирует L1-адренорецепторы, вызывая вазодилатацию. На тонус интактных и спазмированных вен ПНУФ существенно не влияет [35]. Кроме того, ПНУФ контролирует процессы дилатации коронарных сосудов, однако это происходит без использования аденозин- и простогландинзависимых механизмов [51].
Не вызывает сомнения, что активация секреции ПНУФ происходит при растяжении предсердий вследствие повышения объема циркулирующей крови и (или) давления в правом и левом предсердии [14]. Уровень иммунореактивного предсердного натрийуретического гормона в плазме крови возрастает в ответ на внутривенное введение солевых растворов, воды, повышенное потребление поваренной соли, изменение объема циркулирующей крови, при переходе тела из вертикального положения в горизонтальное, погружении его в воду, резком повышении кровяного давления вследствие выброса сосудосуживающих гормонов, т.е. после физической работы, при учащенном сердцебиении во время ходьбы, назначении адреналина, солодки, высоких доз минералокортикоидов и глюкокортикоидов, при электрокардиостимуляции предсердий, ишемии миокарда [18, 49]. Однако все указанные факторы оцениваются как стимулирующие секрецию и выделение ПНУФ до некоторой степени условно, так как на его содержание в плазме крови оказывают влияние и циркадные ритмы [26], а при длительной частой электростимуляции сердца происходит не повышение, а снижение его уровня [45].
Содержание ПНУФ повышалось у больных пароксизмальной суправентрикулярной тахикардией [36, 38], мерцательной аритмией [10].
ПНУФ играет важную роль в патогенезе сердечной недостаточности [3, 54].
М. Кантен и Ж. Жене [5] обнаружили, что по мере прогрессирования патологического процесса содержание ПНУФ в плазме крови изменяется. В эксперименте было показано, что при всех стадиях застойной сердечной недостаточности содержание ПНУФ было ниже, чем у здоровых животных. Уровень ПНУФ в плазме крови достигал максимума в средней фазе заболевания и снижался на конечных стадиях, что является признаком истощения секреторных возможностей предсердных кардиомиоцитов.
В исследованиях А. Ю. Постнова и др. [6] у больных с недостаточностью кровообращения III стадии регистрировалось очень низкое содержание ПНУФ в плазме крови. Возможно, что усиленная секреция больших количеств ПНУФ в течение продолжительного времени противодействует задержке натрия в организме и активизации системы ренин—ангиотензин—альдостерон, однако на поздних стадиях сердечной недостаточности эти признаки все же проявляются.
Повышение концентрации ПНУФ в плазме крови наблюдается у больных с наиболее значительными нарушениями сократительной функции левого желудочка при дилатационной кардиомиопатии [25, 52], при патологии митрального клапана [37], при врожденных пороках сердца [40], после перикардэктомии [50].
При артериальных гипертензиях уровень ПНУФ значительно повышается [17, 23]. Повышение уровня ПНУФ в плазме крови больных артериальными гипертензиями свидетельствует об уровне его секреции, которая, очевидно, связана с изменением гемодинамики в ответ на повышение АД. Уже на ранних стадиях заболевания компенсаторная роль ПНУФ значительно ослабевает, что подтверждается преобладанием прессорных факторов, которые приводят к вазоконстрикции и задержке натрия и воды [9]. В. А. Алмазов с соавт. [2] также характеризуют в целом роль натрийуретических гормонов у больных артериальными гипертензиями как компенсаторную по отношению к нарушениям водно-электролитного обмена и вместе с тем как гипотензивную для ПНУФ и гипертензивную для дигиталисоподобного натрийуретического фактора. Внутривенное введение ПНУФ вызывает снижение сердечного выброса за счет снижения объема циркулирующей крови и уменьшения периферического сопротивления [32, 33, 46]. Одновременно происходит активация симпатической нервной системы [19].
T.Iwasaki et al. [30] отмечали различную реакцию атриального натрийуретического пептида на прием антагонистов кальция и нитроглицерина больных эссенциальной гипертензией и здоровых людей.
В. Д. Слепушкин с соавт. [7] изучили действие полипептидов, выделенных из сердца телят, на течение экспериментального новодринового инфаркта миокарда у крыс. В результате у животных, получавших полипептид сердца, общая летальность уменьшилась на 13%, а продолжительность жизни увеличилась. В 1989 г. P. A. Phillips et al. [39] обнаружили повышение ПНУФ у больных острым инфарктом миокарда; после введения стрептокиназы уровень атриального гормона снизился. Авторы оценили такую динамику как положительную: увеличение объема циркулирующей крови препятствует развитию шоковой реакции.
N. Arakawa [12] Предлагает использовать ПНУФ при остром инфаркте миокарда для коррекции водно-электролитного баланса. В последние годы предприняты попытки изучения влияния ПНУФ на аритмию, вызванную ишемией миокарда [16].
Таким образом, как свидетельствуют литературные данные, ПНУФ является активным гормоном, который синтезируется в предсердиях (ушко правого и левого предсердия), межжелудочковой перегородке, поступает в кровяное русло, взаимодействует со специфическими рецепторами органов-мишеней с помощью цГМФ (возможно, угнетает цАМФ) и вызывает разнообразные физиологические эффекты, будучи антагонистом прессорной системы ренин—ангиотензин—альдостерон. Высокая активность ПНУФ проявляется в быстром массивном увеличении диуреза, натрийуреза и клубочковой фильтрации, уменьшении почечного сосудистого сопротивления, релаксации кровеносных, в том числе коронарных, сосудов. Выделение ПНУФ стимулируют патологические состояния, при которых происходит растяжение предсердий и повышение внутрипредсердного давления: артериальные гипертензии, застойная сердечная недостаточность, суправентрикулярная пароксизмальная тахикардия, фибрилляция—трепетание предсердий, электрокардиостимуляция, инфаркт миокарда.
В последние годы В. П. Сытый и А. Г. Мрочек [8] изучали уровни ПНУФ и его динамику у больных ИБС под влиянием ультразвукового облучения прекардиальной области. При этом было обнаружено два типа секреции ПНУФ у больных инфарктом миокарда: первый — с высоким уровнем, второй — с низким. В зависимости от уровня ПНУФ в плазме крови содержание альдостерона имело тенденцию к снижению (при повышении ПНУФ) или к повышению. Уровень цАМФ у больных острым инфарктом миокарда несколько повышен, а содержание цГМФ прямо зависит от количества ПНУФ в плазме крови, что согласуется с известными фактами об активации атриальным гормоном гуанилатциклазы клетки и увеличении уровня цГМФ.
При воздействии на прекардиальную область больных инфарктом миокарда с высоким уровнем предсердного натрийуретического гормона в плазме крови происходит его скорейшая нормализация, по-видимому, за счет более быстрого истощения секреции. При низком уровне ПНУФ ультразвуковое воздействие стимулирует секрецию последнего и способствует повышению его уровня до нормальных параметров. Таким образом, к уже известным механизмам повышения секреции ПНУФ, описанным в некоторых обзорах и исследованиях [11, 15, 21, 22, 41], В. П. Сытый и А Г. Мрочек относят и ультразвуковое воздействие.
Ультразвуковое облучение прекардиальной области больных стенокардией напряжения ФК I—III стимулирует секрецию атриального гормона уже после первой процедуры.
Этот эффект ультразвука является ключевым во всей цепи гормональных сдвигов. Инфаркт миокарда в остром периоде сопровождается выраженной реакцией гипофизарно-тиреоидной системы, проявляющейся значительным повышением уровня трийодтиронина и тетрайодтиронина. Постепенно уровень этих гормонов снижается. Ранее обнаруживалось повышение уровня обратимого трийодтиронина с максимумом на 3-й день инфаркта миокарда. R-трийодтиронин — интенсивный ингибитор конверсии Т4 в Т3. Ультразвуковое облучение прекардиальной области ускоряет нормализацию уровня тиреоидных гормонов в крови. В. П. Сытый и А. Г. Мрочек считают, что "пусковым" механизмом воздействия на функциональное состояние гипофизарно-тиреоидной системы является изменение секреции предсердного натрийуретического гормона. Обсуждая функциональную автономию регуляции функции гормональной системы гипофиз — щитовидная железа, авторы включают в эту схему и ПНУФ (рис.1).
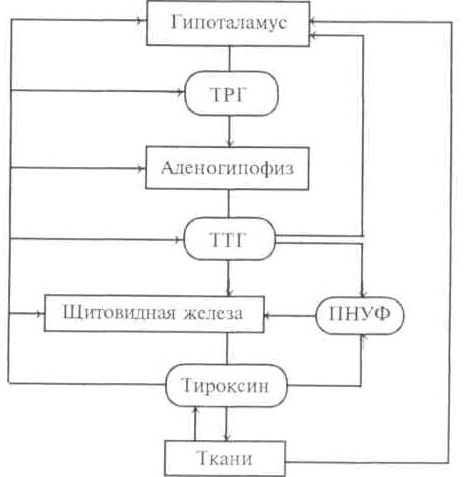
Рис. 1. Обратная связь, регулирующая секрецию гормонов щитовидной железы
Установлено, что ультразвуковое облучение прекардиальной области обладает триггерным эффектом по отношению к гормональным системам гипофиз—надпочечники и гипофиз—поджелудочная железа. После однократного ультразвукового воздействия достоверной динамики АКТГ, кортизола, СТГ, инсулина не выявлено. Однако после трехкратного и семикратного ультразвукового облучения замедляется темп нормализации повышенного уровня АКТГ, снижается уровень кортизола и повышается уровень инсулина в плазме крови. Эти эффекты опосредованы атриальным натрийуретическим гормоном, который угнетает стимулирующее влияние АКТГна секрецию кортизола и ингибирует секрецию АКТГ либерина в гипоталамусе (рис. 2, 3).
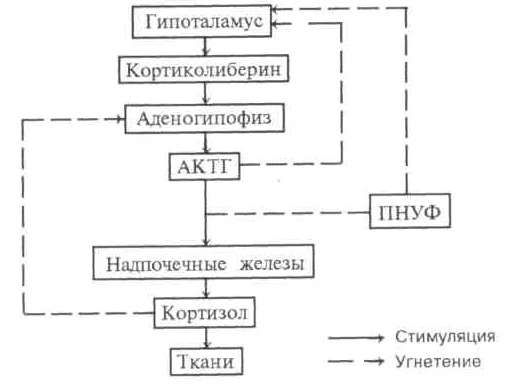
Рис. 2. Влияние ПНУФ на ингибирование стимуляции кортикостероидов адренокортикотропным гормоном
Рис. 3. Влияние ПНУФ на ингибирование стимуляции кортикостероидов АКТГ
Очевидно, ПНУФ влияет и на секреторную деятельность β-клеток поджелудочной железы (рис. 4).
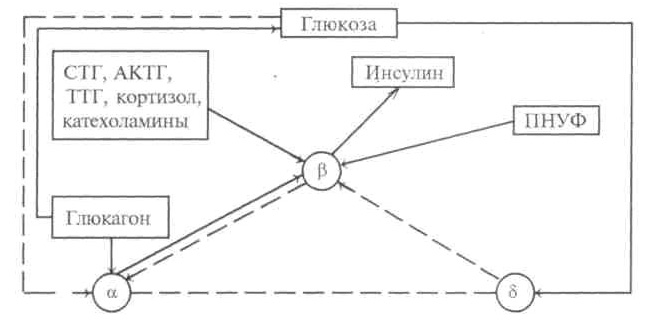
Рис. 4. Механизм обратной связи между секрецией инсулина, гликемией и модуляционными гормональными факторами; α, β, γ — клетки поджелудочной железы
Обнаружено выраженное влияние ультразвука на показатели центральной гемодинамики. По-видимому, увеличение секреции атриального натрийуретического фактора уменьшает объем циркулирующей крови и снижает венозный возврат крови к сердцу. Уменьшение преднагрузки усиливает контрактильную функцию миокарда, что отражается на показателях центральной гемодинамики.
В заключение следует подчеркнуть, что гормональная функция сердца не ограничивается предсердным натрийуретическим гормоном. Внимание ученых и практических врачей привлекает возможность использования гормонов сердца в терапии различных заболеваний.
Литература
1. Алексеенко Л. П., Орехович В. Н. Новое в проблеме сердечно-сосудистой регуляции: эндокринная функция сердца (Обзор)// Вопр. мед. химии.— 1987.— Т. 33, N 3.- С. 2-15.
2. Алмазов В. А., Хирманов В. Н., Щербак А. И. и др. Натрийуретические гормоны (предсердный и дигиталисоподобный) у больных с артериальной гипертензией в условиях функциональных нагрузок // Кардиология.— 1992.— Т. 32, N 1.— С. 56—59.
3. Волненко Н. Б. Предсердный натрийуретический пептид при хронической недостаточности кровообращения у больных ишемической болезнью сердца // Врачебное дело.— 1990.- Т. 23, N 9.— С. 26-28.
4. Жарова Е. А., Иванишвили Л. О., Джибладзе Г. Д., Афонская Н. И. Предсердный натрийуретический фактор // Бюлл. ВКНЦ.— 1989.— С. 99.
5. Кантен М., Жене Ж. Сердце как эндокринная железа // В мире науки.— 1986.- Т. 4.- С. 40-46.
6. Постное А. Ю., Постное И. Ю., Волков В. Н., Батурова Е. А. Содержание предсердного натрийуретического фактора в плазме крови больных с недостаточностью кровообращения // Кардиология.— 1987.— Т. 27, N 9.—С. 109—110.
7. Слепушкин В. Д., Павленко В. С, Хавинсон В. X, Морозов В. Г. Влияние полипептидов, выделенных из сердца, на течение экспериментального инфаркта миокарда // Бюлл. эксперим. биологии и медицины.— 1987.—ТЮЗ, N 1.— С. 26—27.
8. Сытый В. П., Мрочек А. Г., Булгак А. Г. Новые данные о механизме влияния озвучивания прекардиальной области на течение инфаркта миокарда // Вопр. кардиологии (Алма-Ата).—1991.— Т. 3.— С. 10.
9. Томашец Е. А., Мазур Н. А., Масенко В. П. Натрийуретический гормон и артериальное давление у больных артериальными гипертониями // Кардиология .— 1992.- Т. 32, N 1.- С. 60-62.
10. Шершнев В. Г., Фуштей И. М., Ситниченко В. А. и др. Показатели структурно-функционального состояния миокарда и предсердный натрийуретический пептид при мерцательной аритмии // Кардиология.—1992.—Т. 32, N 5.— С. 70—72.
11. Arai П., Nakao К., Saito Y. et al. Augmented expression of atrial natriuretic polypeptide gene in ventricles of spontaneously: hypertensive rats SHR and SHR- stroke phone // Circulation Res.-1988.- V. 62, N 5.- P. 926-930.
12. Arakawa N. // J. Iwate Med. Assoc- 1990.- V. 42, N 3.-P. 385-396.
13. Atlas S., Kleinert H, Camargo M., Volpe M. et al. Структура и биологическое действие предсердного натрийуретического фактора (аурикулина) // Кардиология. — 1986.- Т. 26, N в.- С. 20-27.
14. Buhler F. R., Muller F. В., Raine A. E. et al. Pathophysiological role of atrial natriuretic peptide in man // Pharmacol. Res. Commun.— 1988.—V. 20, suppl. 3.— P. 35-53.
15. Cantin M., Genest J. The heart and the atrial natriuretic factor// Endocrin. Rev.— 1985.- V. 6, N 2.-P. 107-127.
16.Chowdrey H S., Curtis M. J., Hearse D. J. Effects of atrial natriuretic peptide on ischaemiainduced arrhythmias in the rat heart: arrhythmogen or endogenous antiarrhythmic agent? // J. cardiovasc. Pharmacol.—1989.— V. 13, N 3.— P. 451—454.
17.Cowan B. D., Martin J. N., Tucker J. et al. High plasma concentrations of human atrial natriuretic polypeptide in women with pregnancy-induced hypertension // Clin, and Exp. Hypertens. B.-198S.- V. 7, N 3.- P.331-341.
18.Dietz R, Lang R. E., Purdaj J. et al. Relationships between haemodynamic parameters and concentrations of atrial natriuretic peptide in human plasma // J. Hypertens.- 1986.- V.46, N 6.- P. 5512-5515.
19.Ebert T. J., Skelton M. M., Cowley A. W. Dynamic cardiovascular responses to infusions of atrial natriuretic factor in humans // Hypertension.— 1988.— V. 11, N 6.— P. 537-544.
20.FaberJ. E., GettesD. R., Giatturco D. P. Microvascular effects of atrial natriuretic factor: Interaction with Lj- and L,-adrenoreceptors // Circulation Res.— 1988.— V. 63, N 2.- P. 415-428.
21. Finn W. L., Gordon R. G, Tunny T. J. et al. Effects of volume expansion and contraction on plasma levels of atrial natriuretic peptide in man// Clin. Exp. Pharmacol. Physiol.- 1988.-V. 156, N 4.-P. 311-315.
22.Fontana F., Spagnolo N., Capelli M. et al. Fattore natriuretico atriale nell aritmia ipercinetica atriale acuta e nel fibrino-flutter atriale cronico // G. ital. cardiol.— 1989.— V. 19, N 5.- P. 417-427.
23.GiglerH., Banner U., Palkovits M. Atrial natriuretic peptide of the locus coeruleus is important for central regulation of blood pressure and volume homeostatis // Clin, and Exp.Hypertens. A.-1989.-V.116, N 4.-P. 691.
24.Gutkowska J., Horky K., Thibaut G. et al. Atrial Natriuretic factor is a circulating hormone // Biochem. Biophys. R.- 1984.— V.125, N 1.- P.315—323.
25. Haas M., Dietz R., Fischer T.A. et al. Role of right and left atrial dimensions for release of atrial natriuretic peptide in left-sided valvular heart disease and idiopathic dilated cardiomyopathy //Amer. J. Cardiol.— 1988.— V.62, N 10.- P.764—770.
26.Hartter E., Kurz R., Woloszczjuk W., Petzl D.H. Circadian variation and age dependence of human atrial natriuretic peptide levels in hospitalized patients //Hormone and Metabol. Res.- 1987.- V. 19, N 10.- P. 490-492.
27.Horky K., Sramkova J., Gregorova I., Dvorakova J. Vztah atrialniho natriureticke-ho faktoru a systemu renin—angiotensin—aldosteron k geralni odpovedi na akutni volumovou zatez u nemocnych s esencialni hypertenzi // Cas. Lekces.— 1989.—V. 128, N 12.- P. 363-367.
28.HorkyK., TesarV., LachmanovaJ. etal. Атриальный натрийуретический фактор и его роль в регуляции электролитного объемного гомеостаза и гомеостаза давления крови // Чехосл. мед. —1989.— V. 12, N 1.— Р. 1—21.
29. Hwang С. Y., Wang Т. L., Chang S. F. et al. Effect of thyroidectomy on the secretion of atrial natriuretic polypeptide and vasopressin in euhydrated and dehydrated rats// 31th Intern. Congr. Physiol. Sci., Helsinki, 9-14 July 1989 : Abstr.— Oulu, 1989.- P. 267-268.
30.Iwasaki T., Niwa A., Shinoda T. et al Effects of calcium antagonists and nitroglycerin on atrial natriuretic peptide in norn al subjects and patients with essential hypertension //Angiology.-1989.- V. 40, N 1.- P. 24-28.
31.Izumi Y., Honda M., Fukuda N. et al. Effect of atrial natriuretic peptide on adrenal renin and aldosterone // Endocrinol. Jpn.— 1990.—V. 37, N 1.— P. 47—52.
32.LappeR. W. Jodt J.A., Wendt R. L. Hemodynamic effects of infusion versus bolus administration of atrial natriuretic factor //Hypertension.— 1986.—V. 8, N 10.—P. 866—873.
33.Lee R.W., Goldman S. Mechanism for decrease in cardiac output with atrial natriuretic peptide in dogs // Amer. J. Physiol.- 1989.- V. 256, N 3.- P. 760-765.
34.Levin E. R., Frank H. J., ClaudhariA., Kischenbaum M.A. et al. Decreased atrial natriuretic factor receptors and impaired cGMR generation in glomeruli from the cardiomyopathic hamster//Biochem. and Biophys. Res. Commun.— 1989. —V. 159, N 2.- P. 807-814.
35. Ljutik D., Rumboldt Z. The influence of the atrial natriuretic factor on venous tone in man // Intern. J. Clin. Pharm. Res.-1989.-V.9, N 14.- P.255-260.
36.Mebazoa A., Maistre G., Mateo J. et al. Atrial tachycardia per se induces atrial natriuretic factor release despite atrial pressure decrease // J. Mol. and Cell. Cardiol.— 1990.- V. 22, N 4, suppl.- P. 39.
37. Nagata M., Hiroe M., Naruse M. et al. An integrated study employing histopathological, immunohistochemical and radioimmunoassay analyses of atrial natriuretic peptide in the right and left atria in patients with mitral valve disease // Jap. Circulat. J.-1988.-V. 52, N 12.-P. 1453-1456.
38. Nicklas J. M., Giacherio D. A., Moskomtz D. et al Natriuresis associated with elevated plasma atrial natriuretic hormone during supraventricular tachycardia // Amer. Heart.- 1989.- V. 117, N 2.-P. 377-381.
39. Phillips P. A., Sasadeus J., Hodsman G. P. et al. Plasma atrial natriuretik peptide in patients with acute myocardial infarction: effects of streptokinase // Brit. Heart J.— 1989. - V.61, N 2.- P. 139-143.
40.Ross R. D., Daniels S. R., Dolan L. M. et al Determinants of plasma atrial natriuretic factor concentrations in congenital heart disease //Amer. J. Cardiol.— 1988.— V. 62, N 10.—P. 785—788.
41.Saito Y., Nakao K., Arai H. et al Augmented expression of atrial natriuretic polypeptide gene in ventricle of human failing heart // J.Clin. Invest.— 1989.— V. 83, N l.-P. 298-305.
42.Sanaka Т., Tsuchiya K., Nitta K. et al. Role of atrial natriuretic peptide in experimental renal failure // Jap. Circulat. J.- 1988.-V. 52, N 12.- P. 1441-1445.
43.Shin W.S., Toyo-oka Т., Naiton T. et al Response or intracellular Ca2+ transients in cultured vascular smooth muscle cells to angiotensin II, vasopressin, acetylcholine and atrionatriuretic peptide // Jap. Heart J.- 1989.- V. 30, N 1.- P. 77-83.
44.Vantyghem M.C., Lefebvre J. Facteurs natriuretigues // Pathol.-Biol.— 1987.— V.35, N 4.- P. 405—415.
45. Walsh K. P., Williams T. D. M., Wilder R. etal Decline of atrial natriuretic peptide release in dogs during sustained rapid cordiac pacing // Clin. Sci.— 1988.— V. 74, N 6.— P. 567-570.
46. Weder В. А., Sekkarie М. A., Takiyyuddin M. et al Antihypertensive and hypotensive effects of atrial natriuretic factor in men // Hypertension.— 1987.— V. 10, N 6.- P. 582-589.
47. Weidmann P., Saxenhofer H., Ferrier С et al Atrial natriuretic peptide in man // Amer. J. Nephrol.-1988.- V. 8, N 1,- P. 1-14.
48.Weidmann P., Saxenhofer H., Shaw S. et al Atrial natriuretic peptide in man // J.Steroid Biochem.- 1989.- V. 32, N 18.- P. 229-241.
49.Williams T. D. M., Walsh K. P., Сапера-Anson R. et al Atrial natriuretic peptide response to rapid atrial pacing in cardiac-denervated dogs //Amer. J. Physiol.— 1989.— V. 257, N 1, pt 2.-P. R162-R167.
50.Wolozin M. W., Ortola F. V., SpodickD., SeifterJ. L. Release of atrial natriuretic factor after pericardiectomy for chronic constrictive pericarditis // Amer. J. Cardiol.— 1988.-V. 62, N 17.-P. 1323-1325.
51. Yanagisawa A., Lefer A. M. Pharmacological actions of synthetic atrial natriuretic factor on coronary vascular smooth muscle // Jap. Circulat. J.— 1988.— V.52, N 12.— P. 1436-1440.
52.Yasue H., Obata K., Okumura K. et al Increased secretion of atrial natriuretic polypeptide from the left ventricle in patients with dilated cardiomyopathy // J. clin. Invest.- 1989.-V. 83, N 1.- P. 46-51.
53.Yasujima M., Abe K., Kanazawa M. et al Effects of chronically administrated atrial natriuretic factor in aldosterone-infused hypertensive rats // Jap.Circulat. J.— 1988.— V. 52, N 12.- P. 1446-1449.
54. Yoshino F., Sakuma N., Date T. et al Diurnal change of plasma atrial natriuretic peptide concentrations in patients with congestive heart failure // Amer. Heart J.— 1989.- V. 117, N 6.- P. 1316-1319.
Медицинские новости. – 1995. – №4. – С. 10-21.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.