Внимание! Статья адресована врачам-специалистам
Prystrom A.M.
Institute for Advanced Training and Retraining of Healthcare Personnel of the Belarusian State Medical University, Minsk
Heart failure with preserved ejection fraction:
new in pathophysiology, diagnostics, and treatment
Резюме. Приведены современные взгляды на патофизиологию, диагностику и лечение сердечной недостаточности с сохраненной фракцией выброса левого желудочка. Определена роль повышенной жесткости миокарда, кардиометаболического стресса и микроваскулярного воспаления в развитии сердечной недостаточности. Установлена роль новых диагностических шкал и уровней натрийуретических пептидов в установке диагноза сердечной недостаточности. Приведен пошаговый алгоритм диагностики сердечной недостаточности с исключением несердечно-сосудистых и сердечно-сосудистых заболеваний, которые могут имитировать симптомы сердечной недостаточности. Определены ключевые направления фармакологического лечения основных сопутствующих заболеваний (артериальная гипертензия, сахарный диабет, ожирение, фибрилляция предсердий, ишемическая болезнь сердца, хроническая болезнь почек и обструктивное апноэ во сне), а также модифицирующая заболевание терапия с использованием ингибиторов натрий-глюкозного котранспортера 2-го типа, антагонистов минералокортикоидных рецепторов и ингибиторов рецепторов ангиотензина и неприлизина.
Ключевые слова: сердечная недостаточность с сохраненной фракцией выброса, патофизиология сердечной недостаточности, диагностические шкалы, ингибиторы натрий-глюкозного котранспортера 2-го типа, антагонисты минералокортикоидных рецепторов, ингибиторы рецепторов ангиотензина и неприлизина.
Медицинские новости. – 2024. – №2. – С. 8–18.
Summary. The article presents modern views on the pathophysiology, diagnosis and treatment of heart failure with preserved ejection fraction of left ventricular. The role of increased myocardial stiffness, cardiometabolic stress and microvascular inflammation in the development of heart failure has been determined. The role of new diagnostic scales and levels of natriuretic peptides in establishing the diagnosis of heart failure has been established. A step-by-step algorithm for diagnosing heart failure is provided, excluding non-cardiovascular and cardiovascular diseases that can mimic symptoms of heart failure. The key ways of pharmacological treatment of main concomitant diseases (arterial hypertension, diabetes mellitus, obesity, atrial fibrillation, coronary heart disease, chronic kidney disease and obstructive sleep apnea), as well as disease-modifying therapy using sodium glucose cotransporter type 2 inhibitors, mineralocorticoid receptor antagonists, and angiotensin receptor/neprilysin inhibitors have been identified.
Keywords: heart failure with preserved ejection fraction, pathophysiology of heart failure, diagnostic scales, sodium-glucose cotransporter type 2 inhibitors, mineralocorticoid receptor antagonists, angiotensin receptor/neprilysin inhibitors.
Meditsinskie novosti. – 2024. – N2. – P. 8–18.
Сердечная недостаточность (СН) с сохраненной фракцией выброса (СНсФВ) представляет собой распространенное состояние, которое составляет примерно половину всех пациентов с СН [49]. СНсФВ сопровождается высокой заболеваемостью и смертностью, а также высокой частотой госпитализаций по поводу СН, достигая 198 случаев на 1000 человеко-лет. Причем по мере старения населения в ближайшие годы ожидается увеличение распространенности СНсФВ [55].
Эпидемиология СНсФВ
За последние два десятилетия заболеваемость СНсФВ выросла на 50% и составляет сегодня 27 случаев на 10 000 человеко-лет [47]. Аналогичным образом растет и распространенность СНсФВ и, как ожидается, в ближайшем будущем превысит распространенность сердечной недостаточности со сниженной фракцией выброса (СНнФВ). В 2018 году по сравнению с 2008 годом более чем вдвое выросло число госпитализаций пациентов с СНсФВ [59].
По данным исследований CHS (Исследование сердечно-сосудистого здоровья) и MESA (Мультиэтническое исследование атеросклероза) [53], предполагаемый пожизненный риск развития СНсФВ в возрасте 45 лет составляет >10% как у мужчин, так и у женщин. В совокупности эти данные позволяют предположить, что общее бремя СНсФВ, по прогнозам, в будущем станет доминирующим подтипом СН, поражая примерно 1 из 10 взрослых в течение жизни.
Выживаемость пациентов с СНсФВ примерно такая же, как и при СНнФВ. В исследовании V. Bhambhani и соавт. [47] смертность от всех причин среди лиц с впервые диагностированной СНсФВ составила 394 на 10 000 человеко-лет по сравнению с 459 событиями при СНнФВ. Пятилетняя смертность среди лиц, включенных в реестр Get With The Guidelines-HF, составила 75,3% среди лиц с СНсФВ и 75,7% – среди лиц с СНнФВ [32]. Причем при СНсФВ была б?льшая доля несердечно-сосудистых смертей по сравнению с СНнФВ [42].
Патофизиология СНсФВ
Ранее считалось, что СНcФВ формировалась вследствие диастолической дисфункции, вызванной гипертензивным ремоделированием миокарда левого желудочка (ЛЖ), усугубляемым хронотропной недостаточностью. Однако, за последние два десятилетия преобладающий клинический фенотип при СНcФВ сместился от пожилых людей с гипертензивным поражением сердца к мультиморбидным пациентам с ожирением, сахарным диабетом (СД) или метаболическим синдромом [45], с акцентом на системное воспаление, эндотелиальную дисфункцию, нарушенную энергетику миокарда и аномалии в скелетных мышцах [29].
Гипертензивная жесткость миокарда желудочков. Пассивная жесткость миокарда часто увеличивается при СНcФВ вследствие формирования фиброза миокарда и экспрессии коллагена типов I и III. Изменения в экспрессии изотипов и фосфорилировании саркомерных белков, таких как тайтин, также изменяют жесткость кардиомиоцитов, что приводит к увеличению жесткости миокарда у пациентов с СНcФВ [43]. Кроме того, жесткость миокарда ЛЖ может повышаться вследствие увеличения эпикардиального и перикардиального жира, что нарушает расслабление миокарда [6].
Ожирение – кардиометаболический стресс. Жесткость миокарда ЛЖ увеличивается у пациентов с ожирением и, дополнительно, с возрастом. С увеличением массы тела у пациентов с СНcФВ и ожирением наблюдается более высокий объем крови и б?льшая чувствительность давления наполнения к объему плазмы [40].
Повышение индекса массы тела и развитие инсулинорезистентности приводит к увеличению работы миокарда ЛЖ и снижению ее эффективности, что может быть связано с большей зависимостью миокарда при ожирении от окисления жиров [21]. Недавние исследования [25] подтвердили нарушения энергетики миокарда при СНсФВ. Кроме того, у пациентов с ожирением и СНсФВ чаще наблюдалась дисфункция правого желудочка (ПЖ), а также кардиомегалия из-за увеличения эпикардиального жира, что приводило к усилению ограничений со стороны перикарда и нарушению межжелудочкового взаимодействия [6]. Подобные результаты были отмечены в апостериорном анализе исследования RELAX [7], в котором пациенты с ожирением и СНсФВ имели худшее пиковое потребление кислорода и дистанцию 6-минутной ходьбы по сравнению с пациентами без ожирения и СНсФВ, а также более выраженные признаки системного воспаления (более высокие уровни С-реактивного белка).
Микроваскулярное воспаление. В 2013 году W.J. Paulus и C. Tschöpe [46] предложили новую модель развития СНсФВ, согласно которой сопутствующие заболевания, такие как ожирение, СД, хронические заболевания легких и артериальная гипертензия (АГ), вызывают провоспалительное состояние, при котором развивается коронарная микрососудистая эндотелиальная дисфункция, приводящая к последующему снижению биодоступности оксида азота, циклического гуанозинмонофосфата и активности протеинкиназы G в кардиомиоцитах.
В исследовании PROMIS-HFpEF [48] у 75% пациентов были признаки коронарной микрососудистой дисфункции. Хроническая коронарная микрососудистая дисфункция может способствовать снижению плотности сосудов и развитию фиброза. Вышеуказанные факторы приводят к нарушению структуры и функции сердца. Нарушения релаксации миокарда ЛЖ и увеличение его жесткости способствуют повышению давления наполнения ЛЖ, которое вызывает ремоделирование и дисфункцию левого предсердия (ЛП), что часто приводит к развитию фибрилляции предсердий (ФП), которую можно рассматривать как «биомаркер» основного заболевания [5]. Сегодня показано, что нарушение функции ЛП является наиболее надежным визуализирующим маркером, отличающим СНсФВ от некардиальных причин одышки [38]. У части пациентов с СНсФВ может развиться первичная миопатия ЛП как причина повышенного давления ЛП и снижения наполнения ЛЖ, что приводит к недостаточному увеличению сердечного выброса при нагрузке.
Устойчивое повышение давления в ЛП приводит к развитию легочной гипертензии (ЛГ) [1], которая имеется примерно у 80% пациентов с СНсФВ. Сначала ЛГ появляется за счет пассивного повышения давления в ЛП, но в последующем развивается вазоконстрикция и ремоделирование артериол, что приводит к формированию легочной артериолярной гипертензии, которая снижает толерантность к физической нагрузке, приводит к застою в легких, легочным диффузионным нарушениям и повышению смертности [30]. В последующем развивается дисфункция ПЖ со вторичной трикуспидальной регургитацией и системным венозным застоем.
В формировании СНсФВ принимают участие также и многочисленные экстракардиальные механизмы. К ним относятся аномалии кондуитных артериальных сосудов, эндотелия и микроциркуляторного русла, скелетных мышц, легких, почек и жировой ткани, особенно у пациентов с избытком висцерального жира.
Дефицит пикового потребления О2 у пациентов с СНсФВ во время нагрузки определяется примерно поровну, как снижением сердечного выброса, так и разницы содержания О2 в артериальной и венозной крови [12]. Пиковое потреб-ление О2 представляет собой такое количество кислорода, которое организм может использовать за одну минуту на килограмм веса.
При СНсФВ также часто встречается вегетативная дисфункция, поскольку у многих пациентов наблюдается хронотропная недостаточность, снижение артериальной барорефлекторной чувствительности и нарушение венозной емкости, что способствует повышению давления наполнения ЛЖ [62].
Диагностика СНсФВ
Согласно рекомендациям Европейского общества кардиологов, СНсФВ определяется как состояние, сопровождающееся наличием симптомов и признаков СН и фракцией выброса левого желудочка (ФВ ЛЖ) ≥50%, а также объективных признаков структурных и/или функциональных нарушений сердца (наличие диастолической дисфункции ЛЖ/повышение давления наполнения ЛЖ), включая повышенный уровень натрий-уретических пептидов (НУП) [64]. Диагностика СНсФВ осложняется тем, что оценка уровня НУП и эхокардиограммы (ЭхоКГ) в состоянии покоя имеет ограничения [2].
Типичные симптомы СН включают одышку, ортопноэ, пароксизмальную ночную одышку, снижение толерантности к физической нагрузке, утомляемость и отеки лодыжек; а типичные признаки – периферические отеки, хрипы в легких, повышение давления в яремных венах или третий тон сердца [64]. Однако, сами по себе симптомы и признаки недостаточно точны для подтверждения диагноза СН. Так, например, одышка хоть и является одним из наиболее значимых симптомов СНсФВ, но она может присутствовать и у пациентов с ишемической болезнью сердца (ИБС), заболеваниями легких, ожирением, СД, ФП, анемией и др. Поэтому необходимо исключить эти сопутствующие заболевания или, по крайней мере, определить их вклад в симптоматику и выяснить, имеет ли одышка респираторное или сердечное происхождение [26]. В таблице 1 показаны ключевые аспекты, которые могут быть полезны для их различия [55].
Таблица 1. Одышка: респираторные и кардиальные проявления
|
Показатель
|
Респираторные проявления
|
Кардиальные проявления
|
|
Клиническое течение
|
Длительное и рецидивирующее
|
Прогрессирующее
|
|
Физикальный осмотр
|
Храп и свистящее дыхание
Приглушенные сердечные тоны
|
Крепитация
Шум, S3, S4
|
|
Рентгенограмма грудной клетки
|
Нормальный размер сердца
Интерстициальный паттерн
Легочная гипертензия
|
Кардиомегалия
Интерстициальный/альвеолярный отек
Венозно-капиллярная гипертензия
|
|
Электрокардиограмма
|
В норме
Перегрузка ПЖ
Низкий вольтаж
Блокада правой ножки пучка Гиса
ФП/трепетание предсердий
|
Отклонения от нормы: гипертрофия ЛЖ
Изменения ST-T
Зубцы Q
Блокада левой ножки пучка Гиса
ФП/трепетание предсердий
|
|
Дыхательная функция
|
Обструкция
|
В норме или легкое ограничение
|
|
Ответ на диуретики
|
-
|
++
|
|
Ответ на бронходилататоры
|
++
|
-
|
В течение многих лет для диагностики СН используются большие и малые Фрамингемские критерии. К большим относят пароксизмальную ночную одышку (сердечная астма) или ортопноэ, набухание шейных вен, хрипы в легких, кардиомегалию, отек легких, патологический III тон сердца, повышение центрального венозного давления более 160 мм вод. ст., время кровотока более 25 с (при норме 20–25 с), положительный гепатоюгулярный рефлюкс (набухание шейных вен при надавливании на правое подреберье). Малые критерии: отеки на ногах, ночной кашель, одышка при нагрузке, увеличение печени, гидроторакс, тахикардия более 120 в 1 мин, уменьшение жизненной емкости легких на 1/3 от максимальной. Для подтверждения диагноза СН необходимы либо один большой, либо два малых критерия. Определяемые признаки должны быть связаны с сердечным заболеванием.
Известно, что в диагностике СН определенную роль играет уровень НУП. Однако, примерно у трети пациентов с СНсФВ значения НУП ниже обычно используемых клинических порогов для диагностики СН, несмотря на повышенное давление наполнения ЛЖ в состоянии покоя или при нагрузке, особенно среди пациентов с ожирением [27]. Это связано с более низким напряжением стенки ЛЖ в диастолу при любом повышении диастолического давления ЛЖ, наблюдается у лиц африканского происхождения, у пациентов с инсулинорезистентностью и у женщин с повышенной андрогенностью. Таким образом, нормальные уровни НУП не могут использоваться для исключения СНсФВ.
Визуализация может быть полезна для оценки маркеров застоя, таких как увеличение отношения E/e’, увеличение ЛП, снижение напряжения стенки ЛП, повышение давления в легочной артерии и дилатация нижней полой вены [15]. Объективные свидетельства структурных, функциональных и серологических нарушений сердца, соответствующих наличию диастолической дисфункции ЛЖ/повышенного давления наполнения ЛЖ [64] представлены в таблице 2.
Таблица 2. Параметры диастолической дисфункции ЛЖ и повышенного давления наполнения ЛЖ
|
Параметр
|
Значение
|
Комментарии
|
|
Индекс массы ЛЖ
|
≥95 г/м2 (женщины)
≥115 г/м2 (мужчины)
|
Наличие концентрического ремоделирования или ГЛЖ подтверждает диагноз, но и отсутствие ГЛЖ не исключает СНсФВ
|
|
Относительная толщина стенки
|
>0,42
|
|
|
Индекс объема ЛП
|
>34 мл/м2 (синусовый ритм)
|
При отсутствии ФП или клапанного порока увеличение ЛП отражает хроническое повышенное давление наполнения ЛЖ (при ФП >40 мл/м2)
|
|
Отношение E/e’ в состоянии покоя
|
>9
|
Чувствительность 78%, специфичность 59% для СНсФВ при инвазивном нагрузочном тестировании
|
|
NT-proBNP
BNP
|
>125 (синусовый ритм)
или >365 (ФП) пг/мл
>35 (синусовый ритм)
или >105 (ФП) пг/мл
|
До 20% пациентов с инвазивно доказанной СНсФВ имеют НУП ниже диагностического порога, особенно при ожирении
|
|
Систолическое давление в легочной артерии
Скорость трикуспидальной регургитации в состоянии покоя
|
>35 мм рт. ст.
>2,8 м/с
|
Чувствительность 54%, специфичность 85% на наличие СНсФВ по инвазивным нагрузочным тестам
|
«Золотым стандартом» диагностики является оценка гемодинамики в состоянии покоя и во время нагрузки при катетеризации правых отделов сердца. При этом увеличение давления заклинивания в легочных капиллярах в состоянии покоя (≥15 мм рт. ст.) или при нагрузке (≥25 мм рт. ст.), наблюдаемое в конце выдоха, подтверждает диагноз СНсФВ [35].
Диагностические алгоритмы при подозрении на СНсФВ
Постановка диагноза СНсФВ может быть затруднена, учитывая, что на ЭхоКГ может не быть структурных или функциональных нарушений, а уровни НУП могут быть нормальными, особенно у лиц с ожирением.
С целью решения необходимости проведения инвазивных нагрузочных тестов при оценке пациентов с возможной СНсФВ были разработаны диагностические алгоритмы, такие как H2FPEF и HFA-PEFF [4, 35].
Шкалы H2FPEF и HFA-PEFF используют систему оценок, помогающую определить вероятность того, что имеющаяся у человека одышка связана с СНсФВ. Шкала H2FPEF была получена и подтверждена с использованием эталонного стандарта инвазивных гемодинамических измерений при физической нагрузке и является более практичным в оценке (рис. 1). Шесть баллов и более указывают на наличие СНсФВ [4].

Алгоритм HFA-PEFF, разработанный на основе консенсуса экспертов, включает выполнение 4 этапов: шаг 1 – предварительная оценка на основе клинической оценки и стандартных диагностических тестов, включая НУП, электрокардиограмму и ЭхоКГ для выявления лиц, у которых может быть СН; шаг 2 – балльная оценка результатов ЭхоКГ и НУП; шаг 3 – функциональное тестирование в случаях неопределенности; шаг 4 – окончательная оценка этиологических причин одышки и/или отеков [35] (рис. 2).

Низкие или высокие баллы по любой шкале используются для исключения или диагностики СНсФВ соответственно, а пациентов с промежуточными баллами лучше всего направлять на нагрузочное тестирование. В крупном многоцентровом сравнительном исследовании с инвазивным гемодинамическим подтверждением диагнозов обе шкалы были признаны точными инструментами для дифференциации СНсФВ от несердечных причин одышки, но было показано, что шкала H2FPEF более чувствительна, обладает большей общей точностью и избирательностью, чем HFA-PEFF, несмотря на требование меньшего количества входных переменных [13].
Также при установлении диагноза клинической СНсФВ необходимо исключить «имитаторы» СНсФВ, несердечно-сосудистые заболевания, которые могут имитировать СН: почечная недостаточность или нефротический синдром, печеночная недостаточность или цирроз печени, анемия, тяжелое ожирение с периферическими отеками, заболевания легких с легочным сердцем или без него, первичная легочная гипертензия и синдром гиповентиляции хронической дыхательной недостаточности.
Кроме того, признаки застоя при сохраненной ФВ ЛЖ могут быть связаны с особыми или необычными кардиомио-патиями, такими как инфильтративная/рестриктивная кардиомиопатия, гипертрофическая кардиомиопатия, пороки клапанов сердца или заболевания перикарда.
Пошаговый подход к оценке лиц с одышкой и/или отеками представлен на рисунке 3 [66], диагностический алгоритм при СНсФВ – на рисунке 4 [14].


Лечение пациентов с СНсФВ
После установления диагноза СНсФВ и исключения альтернативных диагнозов следует начать системное лечение СНсФВ, которое сосредоточено на трех направлениях: 1) стратификации риска и лечении сопутствующих заболеваний, включая АГ, СД, ожирение, ФП, ИБС, хроническая болезнь почек (ХБП) и обструктивное апноэ во сне (ОАС); 2) нефармакологическое лечение, включая роль физических упражнений и снижения веса, а также использование беспроводных имплантируемых мониторов легочной артерии; 3) управление симптомами и модифицирующая заболевание терапия с использованием петлевых диуретиков, ингибиторов натрий-глюкозного котранспортера 2 типа (ИНГКТ2), антагонистов минералокортикоидных рецепторов (АМР), ингибиторов рецепторов ангиотензина и неприлизина (АРНИ) и блокаторов рецепторов ангиотензина (БРА).
Контроль коморбидных состояний
Артериальная гипертензия (АГ) является наиболее значимой причиной развития СНсФВ с распространенностью от 60% до 89%. Структурные и функциональные нарушения сердца при АГ, такие как гипертрофия ЛЖ и диастолическая дисфункция, образуют субстрат для СНсФВ, чаще всего у пожилых людей, особенно у женщин. Хотя снижение артериального давления (АД) не было связано с улучшением результатов в исследованиях у лиц с СНсФВ, неконтролируемое АД может спровоцировать острую декомпенсацию СН, а у лиц с СНсФВ может наблюдаться повышенная гипертензивная реакция на физическую нагрузку [28].
Большинству пациентов с АГ для контроля АД потребуется два или более антигипертензивных препарата. Выбор антигипертензивной терапии основывается на переносимости, стоимости, сопутствующих заболеваниях и рекомендациях кардиологических обществ [65]. Назначения бета-блокаторов обычно следует избегать, учитывая их отрицательный хронотропный эффект, которые могут снизить переносимость физической нагрузки при СНсФВ. Для пациентов с СНсФВ и АГ предпочтительными препаратами будут диуретики, поскольку они часто необходимы для контроля объема жидкости. Применение дополнительных препаратов может быть основано на умеренном улучшении сердечно-сосудистых исходов, отмеченном в клинических исследованиях у людей с СНсФВ, включая АРНИ, БРА и АМР.
Фибрилляция предсердий. ФП и СН предрасполагают к развитию друг друга из-за общих факторов риска и структурных нарушений сердца. Распространенность ФП выше у лиц с СНсФВ по сравнению с СНнФВ. ФП связана с легочной гипертензией, правосторонней СН и трикуспидальной регургитацией, которые могут в дальнейшем снижать резерв сердечного выброса.
В исследованиях не было отмечено существенного улучшения сердечно-сосудистых исходов при использовании стратегии контроля частоты ритма по сравнению с фармакологической стратегией контроля ритма. Бета-блокаторы и недигидропиридиновые блокаторы кальциевых каналов (БКК) часто рассматриваются как препараты первой линии для контроля сердечного ритма у пациентов с СНсФВ. В отдельных случаях использование дигоксина можно рассматривать как дополнительную стратегию, если бета-блокаторы или недигидропиридиновые БКК неэффективны или противопоказаны лицам с СНсФВ. Примечательно, что чрезмерно агрессивный контроль частоты ритма может быть вредным для пациентов с СНсФВ и ФП из-за значительной дисфункции ЛП, приводящей к низкому ударному объему и неспособности увеличить ударный объем во время нагрузки.
Ожирение. Ожирение либо избыточный вес встречаются у 80% лиц с СНсФВ. Ожирение способствует развитию АГ, инсулинорезистентности, дислипидемии, апноэ во сне и воспалению. У лиц с ожирением и СНсФВ наблюдаются увеличение объема плазмы, концентрическое ремоделирование ЛЖ, дилатация и дисфункция ПЖ. Они также имеют б?льшую толщину эпикардиального жира, что приводит к гемодинамическим нарушениям, обусловленным высокой ригидностью перикарда.
При СНсФВ существует U-образно-зависимая связь между индексом массы тела (ИМТ) и смертностью от всех причин, при этом наименьшая частота событий наблюдается при ИМТ от 32 до 34 кг/м2.
Снижение веса за счет ограничения калорийности, а также посредством бариатрической хирургии и других вмешательств может улучшить толерантность к физической нагрузке, функцию сердца и устранить гемодинамические нарушения [17].
Ишемическая болезнь сердца. ИБС как с гемодинамически значимым коронарным стенозом, так и с микрососудистой дисфункцией, встречается до 75% пациентов с СНсФВ. Сегодня не существует проспективных исследований по определению влияния реваскуляризации на симптомы или исходы, особенно среди лиц с СНсФВ. Хотя у пациентов с острым коронарным синдромом и с персистирующими симптомами СНсФВ реваскуляризация может быть полезна.
В руководствах по СН не рекомендуется рутинное использование нитратов для улучшения толерантности к физической нагрузке при СНсФВ. Учитывая это, для пациентов с СНсФВ и стенокардией могут быть предпочтительны дигидропиридиновые БКК, если имеется сопутствующая необходимость лечения АГ, а также ранолазин, если частота сердечных сокращений или АД невысокие.
Сахарный диабет. Распространенность СД у лиц с СНсФВ варьирует от 28% до 40%. Пациенты с СНсФВ и СД, как правило, моложе, с более высоким ИМТ, большей объемной перегрузкой, худшей функциональной способностью и качеством жизни, а также чаще с АГ, сосудистыми заболеваниями и ХБП [33].
Целевой уровень гликилированного гемоглобина (HbA1c) на уровне от <7% до 7,5% рекомендуется лицам с более низким бременем сопутствующих заболеваний или меньшей тяжестью СН, при этом более высокие целевые значения HbA1c от <8% до 8,5% приемлемы для лиц старшего возраста с более высокой сопутствующей патологией, риском гипогликемии или выраженной СН [60].
ИНГКТ2 следует рассматривать как терапию первой линии для контроля уровня глюкозы, поскольку установлено их влияние на снижение частоты госпитализаций по поводу СН и смертности, связанной с сердечно-сосудистыми заболеваниями, у пациентов с СД и без него [31]. Кроме того, использование других пероральных гипогликемических средств не должно исключать применение ИНГКТ2, но может потребовать корректировку их дозы, или отмену.
Независимо от преимуществ, отмеченных при использовании ИНГКТ2, метформин рекомендуется в качестве терапии первой линии для контроля гликемии пациентам с СД и СН, включая СНсФВ, с расчетной скоростью клубочковой фильтрации (СКФ) около 30 мл/мин/1,73 м2, на основании данных наблюдений, показавших 20-процентное снижение относительного риска смертности у лиц с СНсФВ [39].
Агонисты рецепторов глюкагоноподобного пептида 1 (АГПП-1) следует рассматривать у лиц с СНсФВ при сопутствующем СД и высоким риском атеросклеротических сердечно-сосудистых заболеваний или с их наличием [63].
Препараты, которых следует избегать у лиц с СД и СНcФВ: ингибиторы дипептидилпептидазы-4 саксаглиптин и алоглиптин, а также тиазолидиндионы.
Обструктивное апноэ во сне. Распространенность ОАС составляет от 55% до 80% у людей с СНсФВ. Нарушения дыхания во сне отрицательно влияют на качество жизни, повышая риск депрессии [61]. Однако сегодня не показано однозначной пользы лечения ОАС в отношении сердечно-сосудистых исходов [9].
Пациентам с СНсФВ и высоким подозрением на апноэ во сне, а также пациентам с тяжелым ожирением, прекапиллярной легочной гипертензией, резистентной системной гипертензией, подтвержденной ночной гипоксией или ночной брадиаритмией следует проводить полисомнографию и в случае выявленных отклонений от нормы необходимо направление к специалисту по сну, и может быть проведена терапия с постоянным положительным давлением в дыхательных путях.
Хроническая болезнь почек (ХБП) определяется как снижение функции почек в течение как минимум 3 месяцев, о чем свидетельствует рСКФ <60 мл/кг/1,73 м2, альбуминурия (отношение альбумина к креатинину более 30 мг/г) или другие маркеры поражения почек. ХБП и СНсФВ часто сосуществуют, и ХБП является фактором риска возникновения СНсФВ, с распространенностью более 50% у лиц с СН. ХБП связана с повышенным риском госпитализации и увеличением смертности до 3 раз при СНсФВ, при этом величина риска увеличивается с тяжестью заболевания почек [8].
Диагностика ХБП может быть затруднена вследствие того, что снижается уровень креатинина из-за потери мышечной массы или увеличения объема/гемодилюции.
ИНГКТ2 замедляют скорость снижения функции почек у лиц с СНсФВ и ХБП [24], превосходя блокаторы ренин-ангиотензин-альдостероновой системы, такие как ингибиторы АПФ и БРА. Кроме того, рекомендуется использовать петлевые диуретики в минимальной эффективной дозе, а также АМР.
Фармакологическое лечение СНсФВ
Исторически имеется множество исследований без доказанной пользы в отношении медикаментозной терапии СНсФВ, включая исследования с периндоприлом, ирбесартаном, бета-блокаторами, нитратами, дигоксином, ивабрадином, силденафилом, серелаксином.
Однако недавние клинические исследования продемонстрировали пользу медикаментозной терапии у лиц с СНсФВ, и начало применения ключевых препаратов необходимо для улучшения симптомов и функциональных возможностей, а также снижения заболеваемости и смертности, связанных с СН.
Ингибиторы натрий-глюкозного котранспортера 2. ИНГКТ2 продемонстрировали значительные преимущества у лиц с СН как с СД, так и без него. Поэтому терапию ИНГКТ2 следует начинать у всех лиц с СНсФВ, не имеющих противопоказаний.
В исследованиях DELIVER [11] и EMPEROR-Preserved [23] оценивались эффекты дапаглифлозина и эмпаглифлозина соответственно на клинические исходы у лиц с СН и ФВ ЛЖ ≥40%. В обоих исследованиях было продемонстрировано, что лечение ИНГКТ2 было связано со снижением на 18–21% первичной конечной точки (госпитализация по поводу СН или сердечно-сосудистая смертность) среди пациентов с СН и ФВ ЛЖ ≥40%. Кроме того, в обоих исследованиях, а также в исследовании PRESERVED-HF [58], наблюдалось улучшение состояния здоровья и качества жизни при использовании ИНГКТ2 при СНсФВ.
Необходимо отметить, что наблюдаемая польза отмечалась при дополнительном использовании АМР и АРНИ. По результатам крупного исследования J.P. Ferreira и соавт. [36] с включением 5988 пациентов, применение эмпаглифлозина было связано с меньшим количеством случаев прекращения приема АМР из-за меньшего риска гиперкалиемии. В недавнем крупном мета-анализе с участием 21 947 пациентов с СН независимо от ФВ ЛЖ было показано, что АМР не меняют эффекты ИНГКТ2 (госпитализации по СН и СС смертность); при этом отмечалась тенденция по снижению СС смертности у пациентов, получающих ИНГКТ2 и АМР, а также назначение ИНГКТ2 уменьшает риск АМР-ассоциированной гиперкалиемии [41]. Авторами был сделан вывод о том, что комбинация ИНГКТ2 и АМР может быть предпочтительной для болезнь-модифицирующей стратегии со снижением риска вызываемой лечением гиперкалиемии у пациентов с СН независимо от ФВ ЛЖ.
Совсем недавно в исследовании EMPULSE [57] лечение эмпаглифлозином по сравнению с плацебо у госпитализированных лиц с острой декомпенсацией СН приводило к более быстрому и тщательному устранению отеков и было связано со значительным улучшением вторичной комбинированной конечной точки, включая клинический исход (смерть, явления СН) и состояние здоровья.
Преимущества ИНГКТ2 одинаково применимы не только к пациентам с СД и без него, но и также ко всему спектру ФВ ЛЖ [10].
Антагонисты минералокортикоидных рецепторов (АМР) представляют особый интерес для лечения СНсФВ из-за их влияния на интерстициальный фиброз, жесткость миокарда, расширение внеклеточного матрикса и функцию сосудов, которые являются ключевыми компонентами патогенеза СНсФВ [43]. Было показано, что терапия спиронолактоном улучшает показатели диастолической дисфункции при ЭхоКГ и уменьшает накопление N-концевого пропептида проколлагена III типа, циркулирующего маркера фиброза миокарда [20]. В мета-анализе у пациентов с СНсФВ или инфарктом миокарда с сохраненной ФВ ЛЖ терапия АМР снизила количество госпитализаций по поводу СН на 17%, улучшила диастолическую функцию, предотвращала ремоделирование ЛЖ и улучшила качества жизни, но не смогла снизить смертность от всех причин [19]. В исследовании STRUCTURE терапия спиронолактоном улучшила показатель соотношения скорости раннего митрального притока к ранней диастолической скорости митрального кольца (E/e’) во время нагрузки, что значительно повысило толерантность к физической нагрузке у пациентов с СНсФВ и аномальной диастолической реакцией на нагрузку [16]. В исследовании ALDO-DHF АМР также значительно улучшили показатели диастолической функции и наблюдалось обратное ремоделирование ЛЖ у лиц с СНсФВ [22].
В исследовании TOPCAT [54] приняли участие 3445 человек с СН и ФВ ЛЖ ≥45%, которые были рандомизированы в группы спиронолактона (15–45 мг в день) или плацебо. Первоначально опубликованные результаты не показали значимого преимущества в отношении первичного комбинированного исхода, такого как сердечно-сосудистая смерть, успешная реанимация или госпитализация по поводу СН (относительный риск (ОР) 0,89; 95% доверительный интервал (ДИ): 0,77–1,04), хотя наблюдалось значительное снижение числа госпитализации по поводу СН (ОР 0,83; 95% ДИ: 0,69–0,99). Последующий анализ подгрупп TOPCAT выявил значительное снижение основного комбинированного результата при применении спиронолактона у участников, зарегистрированных в Северной Америке (ОР 0,82; 95% ДИ: 0,69–0,98), тогда как среди участников из России/Грузии никакой пользы не наблюдалось (ОР 1,10 95% ДИ: 0,79–1,51) [51]. Это наблюдение было дополнительно подтверждено данными, демонстрирующими, что уровни канренона, активного метаболита спиронолактона, не обнаруживались у большей части участников из России, чем из США и Канады (30% против 3% соответственно; р<0,001), что подтверждает, что сообщаемое и фактическое использование спиронолактона значительно различалось в зависимости от региона.
Хотя не было показано, что АМР снижают смертность у пациентов с СНсФВ, однако отмечается их положительное влияние на качество жизни и толерантность к физической нагрузке, а также большинство пациентов с СНсФВ получают пользу от применения АМР за счет обеспечения сбалансированного диуреза с последовательной блокадой нефронов, контроля АГ и уменьшения количества госпитализаций по поводу СН. Важно, что при назначении АМР необходим соответствующий мониторинг уровня калия и функции почек, чтобы снизить риск развития гиперкалиемии и ухудшения функции почек.
Ингибиторы рецепторов ангиотензина – неприлизина. Сакубитрил ингибирует неприлизин, фермент, который инактивирует НУП, брадикинин и вещество Р, которые способствуют развитию и прогрессированию СН. Комбинация с валсартаном необходима, поскольку ингибирование неприлизина повышает уровень ангиотензина, что может нивелировать сосудорасширяющий эффект сакубитрила, если он также не ингибирован. Сакубитрил/валсартан обеспечивает умеренную дополнительную пользу по сравнению с валсартаном у лиц с СНсФВ.
Роль АРНИ у лиц с СНсФВ оценивалась в исследовании PARAGON-HF [3], в котором приняли участие 4822 участника исследования с ФВ ЛЖ ≥45% и повышенным уровнем НУП и признаками структурного заболевания сердца, и рандомизировали их на группы сакубитрил/валсартан (целевая доза 97/103 мг два раза в день) или валсартан (целевая доза 160 мг два раза в день). Первичная комбинированная конечная точка общего числа госпитализаций по поводу СН и смертности от сердечно-сосудистых заболеваний была ниже в группе сакубитрил/валсартан, но не была статистически значимой (ОР 0,87; 95% ДИ: 0,75–1,01). Недавно госпитализированные участники исследования показали существенно большее снижение риска при лечении ARNI по сравнению с валсартаном [50]. Потенциальная польза наблюдалась у лиц с ФВ ЛЖ от 45% до 57% (ОР 0,78; 95% ДИ: 0,64–0,95). У женщин польза была выше (ОР 0,73; 95% ДИ: 0,59–0,90) по сравнению с у мужчин (ОР 1,03; 95% ДИ: 0,84–1,25). Основываясь на этих данных, в феврале 2021 года FDA одобрило сакубитрилу/валсартану расширенное показание к применению при СН, «чтобы снизить риск сердечно-сосудистой смерти и госпитализации по поводу СН у взрослых пациентов с хронической СН», и отметило, что «польза наиболее явно очевидна у пациентов с ФВ ЛЖ ниже нормы».
Блокаторы рецепторов ангиотензина. БРА менее эффективен, чем АРНИ, однако может использоваться, когда последний противопоказан (например, ангионевротический отек в анамнезе) или финансово недоступен. В исследовании CHARM [18] кандесартан у пациентов с ФВ ЛЖ ≥40% уменьшил количество госпитализаций по поводу СН. Однако в исследовании I-PRESERVE [37] ирбесартан не снизил ни смертность по любой причине, ни госпитализации по сердечно-сосудистым причинам.
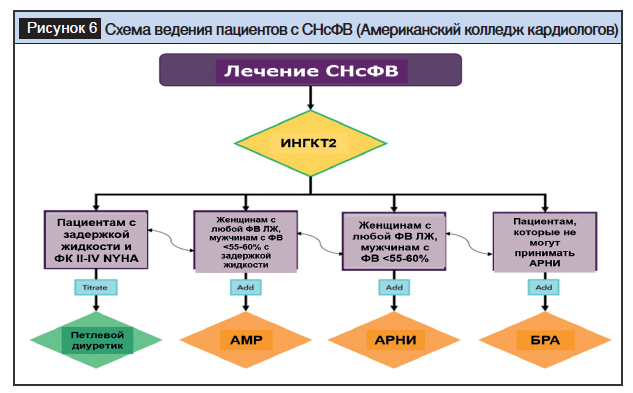
Инициация и титрование рекомендованных препаратов. За исключением противопоказаний, все пациенты с диагнозом СНсФВ должны получать лечение ИНГКТ2 с целью снижения смертности от сердечно-сосудистых заболеваний/госпитализаций с СН и улучшения качества жизни. Начальную терапию ИНГКТ2 следует рассматриваться как амбулаторным пациентам с СНсФВ, так и с острой декомпенсацией СН. Пациентам с ФВ ЛЖ <55–60% можно рассмотреть возможность использования АМР, АРНИ или БРА (когда применение АРНИ нецелесообразно).
Дозы АРНИ и АМР следует титровать в течение 2 недель до максимально переносимых с учетом симптомов, АД, уровня калия и креатинина, как это было подтверждено в исследовании STRONG-HF [52].
Схема ведения пациентов с СНсФВ, рекомендованная экспертами Европейского общества кардиологов в 2023 году, приведена на рисунке 5 [67]. Схема ведения пациентов с СНсФВ, рекомендованная экспертами Американского колледжа кардиологов в 2023 году, приведена на рисунке 6 [66].

Подробная схема лечения пациентов с СНсФВ представлена на рисунке 7 [34].

Таким образом, СНсФВ является одной из наиболее актуальных диагностических и терапевтических проблем в клинической медицине сегодня, учитывая ее растущую распространенность, недостаточную диагностику, плохой прогноз, ограниченные терапевтические возможности и значительную нагрузку на систему здравоохранения во всем мире. Несмотря на эти проблемы, успех недавних исследований по применению ингибиторов натрий-глюкозного котранспортера 2 типа показал, что СНсФВ поддается лечению. Созданные современные алгоритмы лечения пациентов с СНсФВ на основе применения ингибиторов натрий-глюкозного котранспортера 2 типа, антагонистов минералокортикоидных рецепторов, ингибиторов рецепторов ангиотензина и неприлизина и, при необходимости, петлевых диуретиков, а также лечение основных сопутствующих заболеваний позволяют рассчитывать на снижение распространенности, заболеваемости и смертности, связанной с СНсФВ, что станет огромным достижением в сохранении здоровья населения.
Л И Т Е Р А Т У Р А
1. Altered hemodynamics and end-organ damage in heart failure: impact on the lung and kidney / F.H. Verbrugge [et al.] // Circulation. – 2020. – Vol.142. – P.998–1012.
2. An epidemic of HFPEF? / A. Thompson [et al.] // Heart. – 2016. – Vol.102 (Supplement 6). – A15–A16.
3. Angiotensin-neprilysin inhibition in heart failure with preserved ejection fraction / S.D. Solomon [et al.] // N Engl J Med. – 2019. – Vol.381. – P.1609–1620.
4. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction / Y.N.V. Reddy [et al.] // Circulation. – 2018. – Vol.138. – P.861–870.
5. Atrial dysfunction in patients with heart failure with preserved ejection fraction and atrial ?brillation / Y.N.V. Reddy [et al.] // J Am Coll Cardiol. – 2020. – Vol.76. – P.1051–1064.
6. Borlaug, B.A. The role of the pericardium in heart failure: implications for pathophysiology and treatment / B.A. Borlaug, Y.N.V. Reddy // J Am Coll Cardiol HF. – 2019. – Vol.7. – P.574–585.
7. Characterization of the obese phenotype of heart failure with preserved ejection fraction: a RELAX trial ancillary study / Y.N.V. Reddy [et al.] // Mayo Clin Proc. – 2019. – Vol.94. – P.1199–1209.
8. Comorbidities, sociodemographic factors, and hospitalizations in outpatients with heart failure and preserved ejection fraction / V.V. Georgiopoulou [et al.] // Am J Cardiol. – 2018. – Vol.121. – P.1207–1213.
9. CPAP for prevention of cardiovascular events in obstructive sleep apnea / R.D. McEvoy [et al.] // N Engl J Med. – 2016. – Vol.375. – P.919–931.
10. Dapagli?ozin across the range of ejection fraction in patients with heart failure: a patient-level, pooled meta-analysis of DAPA-HF and DELIVER / P.S. Jhund [et al.] // Nat Med. – 2022. – Vol.28. – P.1956–1964.
11. Dapagli?ozin in heart failure with mildly reduced or preserved ejection fraction / S.D. Solomon [et al.] // N Engl J Med. – 2022. – Vol.387. – P.1089–1098.
12. Determinants of exercise intolerance in elderly heart failure patients with preserved ejection fraction / M.J. Haykowsky [et al.] // J Am Coll Cardiol. – 2011. – Vol.58. – P.265–274.
13. Diagnosis of heart failure with preserved ejection fraction among patients with unexplained dyspnea / Y.N.V. Reddy [et al.] // JAMA Cardiol. – 2022. – Vol.7. – P.891–899.
14. Diagnosis of heart failure with preserved ejection fraction: a systematic narrative review of the evidence / F. Formiga [et al.] // Heart Failure Reviews https://doi.org/10.1007/s10741-023-10360-z. Published online 20 October 2023.
15. Diastolic dysfunction and heart failure with preserved ejection fraction: understanding mechanisms by using noninvasive methods / M. Obokata [et al.] // J Am Coll Cardiol Img. – 2020. – Vol.13. – P.245–257.
16. Effect of Aldosterone Antagonism on Exercise Tolerance in Heart Failure with Preserved Ejection Fraction / W. Kosmala [et al.] // J Am Coll Cardiol. – 2016. – Vol.68. – P.1823–1834.
17. Effect of caloric restriction or aerobic exercise training on peak oxygen consumption and quality of life in obese older patients with heart failure with preserved ejection fraction: a randomized clinical trial / D.W. Kitzman [et al.] // JAMA. – 2016. – Vol.315. – P.36–46.
18. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved trial / S. Yusuf [et al.] // Lancet. – 2003. – Vol.362. – P.777–781.
19. Effects of mineralocorticoid receptor antagonists in patients with preserved ejection fraction: a meta-analysis of randomized clinical trials / Y. Chen [et al.] // BMC Med. – 2015. – Vol.13. – P.10.
20. Effect of Mineralocorticoid Receptor Antagonists on Cardiac Structure and Function in Patients with Diastolic Dysfunction and Heart Failure with Preserved Ejection Fraction: A Meta-Analysis and Systematic Review / A. Pandey [et al.] // J Am Heart Assoc. – 2015. – Vol.4. – e002137.
21. Effect of obesity and insulin resistance on myocardial substrate metabolism and ef?ciency in young women / L.R. Peterson [et al.] // Circulation. – 2004. – Vol.109. – P.2191–2196.
22. Effect of spironolactone on diastolic function and exercise capacity in patients with heart failure with preserved ejection fraction: the ALDO-DHF randomized controlled trial / F. Edelmann [et al.] // JAMA. – 2013. – Vol.309. – P.781–791.
23. Empagli?ozin in heart failure with a preserved ejection fraction / S.D. Anker [et al.] // N Engl J Med. – 2021. – Vol.385. – P.1451–1461.
24. Empagli?ozin in patients with chronic kidney disease / T.E. Group [et al.] // N Engl J Med. – 2023. – Vol.388. – P.117–127.
25. Energetic basis for exercise-induced pulmonary congestion in heart failure with preserved ejection fraction / M.K. Burrage [et al.] // Circulation. – 2021. – Vol.144. – P.1664–1678.
26. Epidemiology, Diagnosis, Pathophysiology, and Initial Approach to Heart Failure with Preserved Ejection Fraction / T. Anderson [et al.] // Cardiol Clin 2022. – Vol.40, N4. – P.397–413.
27. Evidence supporting the existence of a distinct obese phenotype of heart failure with preserved ejection fraction / M. Obokata [et al.] // Circulation. – 2017. – Vol.136. – P.6–19.
28. Exaggerated hypertensive response to exercise in patients with diastolic heart failure / S. Kato [et al.] // Hypertens Res. – 2008. – Vol.31. – P.679–684.
29. From Systemic Inflammation to Myocardial Fibrosis. The Heart Failure With Preserved Ejection Fraction Paradigm Revisited / W.J. Paulus [et al.] // Circ Research. – 2021. – Vol.128, N10. – P.1451–1467.
30. Global pulmonary vascular remodeling in pulmonary hypertension associated with heart failure and preserved or reduced ejection fraction / A.U. Fayyaz [et al.] // Circulation. – 2018. – Vol.137. – P.1796–1810.
31. Heart failure: an underappreciated complication of diabetes. A consensus report of the American Diabetes Association / R. Pop-Busui [et al.] // Diabetes Care. – 2022. – Vol.45. – P.1670–1690.
32. Heart Failure With Preserved, Borderline, and Reduced Ejection Fraction: 5-Year Outcomes / K.S. Shah [et al.] // J Am Coll Cardiol. – 2017. – Vol.70, N20. – P.2476–2486.
33. Heart failure with preserved ejection fraction and diabetes: JACC state-of-the-art review / K. McHugh [et al.] // J Am Coll Cardiol. – 2019. – Vol.–73. – P.602–611.
34. Heart Failure With Preserved Ejection Fraction. JACC Scientific Statement / B.A. Borlaug [et al.] // J Am Coll Cardiol. – 2023. – Vol.81. – P.1810–1834.
35. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC) / B. Pieske [et al.] // Eur Heart J. – 2019. – Vol.40. – P.3297–3317.
36. Interplay of mineralocorticoid receptor antagonists and empagli?ozin in heart failure: EMPEROR-Reduced / J.P. Ferreira [et al.] // J Am Coll Cardiol. – 2021. – Vol.77. – P.1397–1407.
37. Irbesartan in patients with heart failure and preserved ejection fraction / B.M. Massie [et al.] // N Engl J Med. – 2008. – Vol.359. – P.2456–2467.
38. Left atrial strain and compliance in the diagnostic evaluation of heart failure with preserved ejection fraction / Y.N.V. Reddy [et al.] // Eur J Heart Fail. – 2019. – Vol.21. – P.891–900.
39. Metformin treatment in heart failure with preserved ejection fraction: a systematic review and meta-regression analysis / A. Halabi [et al.] // Cardiovasc Diabetol. – 2020. – Vol.19. – P.124.
40. Miller, W.L. Impact of obesity on volume status in patients with ambulatory chronic heart failure / W.L. Miller, B.A. Borlaug // J Card Fail. – 2020. – Vol.26. – P.112–117.
41. Mineralocorticoid receptor antagonists with sodium-glucose co-transporter-2 inhibitors in heart failure: a meta-analysis / M. Banerjee [et al.] // Eur Heart J. – 2023. – Vol.44, N37. – P.3686–3696.
42. Mode of Death in Heart Failure With Preserved Ejection Fraction / M. Vaduganathan [et al.] // J Am Coll Cardiol. – 2017. – Vol.69, N5. – P.556–569.
43. Myocardial stiffness in patients with heart failure and a preserved ejection fraction: contributions of collagen and titin / M.R. Zile [et al.] // Circulation. – 2015. – Vol.131. – P.1247–1259.
44. Nair, A. Aldosterone Receptor Blockade in Heart Failure with Preserved Ejection Fraction / A. Nair, A. Deswal // Heart Fail Clin. – 2018. – Vol.14. – P.525–535.
45. Obesity and heart failure with preserved ejection fraction: new insights and pathophysiological targets / B.A. Borlaug [et al.] // Cardiovasc Research. -2022. – Vol.118. – P.3434–3450.
46. Paulus, W.J. A Novel Paradigm for Heart Failure With Preserved Ejection Fraction: Comorbidities Drive Myocardial Dysfunction and Remodeling Through Coronary Microvascular Endothelial Inflammation / W.J. Paulus, C. Tschöpe // J Am Coll Сardiol. – 2013. – Vol.62, N4. – P.263–271.
47. Predictors and outcomes of heart failure with mid-range ejection fraction / V. Bhambhani [et al.] // Eur J Heart Fail. – 2018. – Vol.20. – P.651–659.
48. Prevalence and correlates of coronary microvascular dysfunction in heart failure with preserved ejection fraction: PROMIS-HFpEF / S.J. Shah [et al.] // Eur Heart J. – 2018. – Vol.39. – P.3439–3450.
49. Prevalence, characteristics, management and outcomes of patients with heart failure with preserved, mildly reduced, and reduced ejection fraction in Spain / C. Escobar [et al.] // J Clin Med. – 2022. – Vol.11, N17. – P.5199.
50. Prior heart failure hospitalization, clinical outcomes, and response to sacubitril/valsartan compared with valsartan in HFpEF / M. Vaduganathan [et al.] // J Am Coll Cardiol. – 2020. – Vol.75. – P.245–254.
51. Regional variation in patients and outcomes in the Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist (TOPCAT) trial / M.A. Pfeffer [et al.] // Circulation. – 2015. – Vol.131. – P.34–42.
52. Safety, tolerability and ef?cacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial / A. Mebazaa [et al.] // Lancet. – 2022. – Vol.400. – P.1938–1952.
53. Sex and Race Differences in Lifetime Risk of Heart Failure With Preserved Ejection Fraction and Heart Failure With Reduced Ejection Fraction / А. Pandey [et al.] // Circulation. – 2018. – Vol.137, N17. – P.1814–1823.
54. Spironolactone for heart failure with preserved ejection fraction / B. Pitt [et al.] // N Engl J Med. – 2014. – Vol.370. – P.1383–1392.
55. The differential diagnosis of dyspnea / D. Berliner [et al.] Dtsch Arztebl Int. – 2016. – Vol.113, N49. – P.834–845.
56. The heart failure with preserved ejection fraction conundrum-redefining the problem and finding common ground? / P. Iyngkaran [et al.] // Curr Heart Fail Rep. – 2020. – Vol.17, N2. – P.34–42.
57. The SGLT2 inhibitor empagli?ozin in patients hospitalized for acute heart failure: a multinational randomized trial / A.A. Voors [et al.] // Nat Med. – 2022. – Vol.28. – P.568–574.
58. The SGLT2 inhibitor dapagli?ozin in heart failure with preserved ejection fraction: a multicenter randomized trial / M.E. Nassif [et al.] // Nat Med 2021. – Vol.27. – P.1954–1960.
59. Trends in Heart Failure Hospitalizations in the US from 2008 to 2018 / K.A.A. Clark [et al.] // J Card Fail. – 2022. – Vol.22 (2). – P.171–180.
60. Type 2 diabetes mellitus and heart failure: a scienti?c statement from the American Heart Association and the Heart Failure Society of America: This statement does not represent an update of the 2017 ACC/AHA/HFSA heart failure guideline update / S.M. Dunlay [et al.] // Circulation. – 2019. – Vol.140. – e294–e324.
61. Veasey, S.C. Obstructive sleep apnea in adults / S.C. Veasey, I.M. Rosen // N Engl J Med. – 2019. – Vol.380. – P.1442–1449.
62. Venous tone and stressed blood volume in heart failure: JACC review topic of the week / M. Fudim [et al.] // J Am Coll Cardiol. – 2022. – Vol.79. – P.1858–1869.
63. 2020 Expert consensus decision pathway on novel therapies for cardiovascular risk reduction in patients with type 2 diabetes: a report of the American College of Cardiology Solution Set Oversight Committee / S.R. Das [et al.] // J Am Coll Cardiol. – 2020. – Vol.76. – P.1117–1145.
64. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure / T.A. McDonagh [et al.] // Eur Heart J. – 2021. – Vol.42, N36. – P.3599–3726.
65. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines / P.A. Heidenreich [et al.] // J Am Coll Cardiol. – 2022. – Vol.79. – e263–e421.
66. 2023 ACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection Fraction / M.M. Kittleson [et al.] // J Am Coll Cardiol. https://doi.org/10.1 016/j.jacc.2023.03.393. Published online April 19, 2023.
67. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure / T.A. McDonagh [et al.] // Eur Heart J. – 2023. – Vol.44. – P.3627–3639.
Медицинские новости. – 2024. – №2. – С. 8-18.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.