Внимание! Статья адресована врачам-специалистам
KomissarovaS., RineiskaN.
State Institution Republican Scientific and Practical Centre “Cardiology”, Minsk, Belarus
Updated ESC-2023 clinical guidelines on diagnosis
and treatment of hypertrophic cardiomyopathy
Резюме. Эксперты Европейского общества кардиологов (ESC) обновили рекомендации по диагностике и лечению пациентов с гипертрофической кардиомиопатией. Особое внимание уделено стратегии медикаментозного лечения обструкции выносящего тракта левого желудочка (ОВТЛЖ) с применением нового лекарственного средства – ингибитора сердечной миозинаденозинтрифосфатазы – мавакамтена. Обобщены рекомендации по профилактике внезапной сердечной смерти в каждой категории риска с учетом дополнительных факторов риска, не включенных в модель HCM Risk-SCD.
Ключевые слова: рекомендации ESC, гипертрофическая кардиомиопатия, стратегия медикаментозного лечения.
Медицинские новости. – 2023. – №11. – С. 56–62.
Summary. Experts of the European Society of Cardiology (ESC) have revised recommendations for the diagnosis and treatment of patients with hypertrophic cardiomyopathy. Particular attention is devoted to the therapeutic strategy of left ventricular outflow tract obstruction (LVOTO) represented by novel selective cardiac myosin inhibitor – mavacamten. Recommendations for the prevention of sudden cardiac death in each risk category are summarized, considering additional risk factors disregarded in the HCM Risk-SCD model.
Keywords: ESC recommendations, hypertrophic cardiomyopathy, therapeutic strategy.
Meditsinskie novosti. – 2023. – N11. – P. 56–62.
На Конгрессе Европейского общества кардиологов 2023 года (ESC-2023) представлены обновленные клинические рекомендации по диагностике и лечению кардиомиопатий (КМП) [1]. В обновленных рекомендациях есть ряд ключевых изменений. Так, рабочая группа ESCобновила существующие клинические классификации, включив в нее новые фенотипические описания для упрощения терминологии и одновременно для обеспечения концептуальной основы для диагностики и лечения КМП.
Наиболее важные изменения в рекомендациях касаются группы состояний, которые включались под общим термином «аритмогенная кардиомиопатия», характеризующейся структурно-функциональными нарушениями миокарда и желудочковой аритмией. Первоначально в клинической практике использовался термин «аритмогенная правожелудочковая кардиомиопатия» (АКПЖ). Для верификации АКПЖ были приняты модифицированные критерии ITF 2010 (InternationalTaskForse, Международная целевая группа, 2010). За последние годы концепция заболевания существенно изменилась, был расширен фенотипический спектр данной нозологии с идентификацией бивентрикулярной и лево-доминантной форм, что привело к использованию термина «аритмогенная кардиомиопатия» вместо «аритмогенная кардиомиопатия правого желудочка», применяемого ранее.Однако последние рекомендации ESC-2023 по ведению кардиомиопатий настоятельно рекомендуют придерживаться терминологии «аритмогенная кардиомиопатия правого желудочка». Согласно этому руководству, термин АКПЖ может быть использован для описания варианта, при котором дилатация желудочков или нарушения движения стенок преимущественно ограничены ПЖ, с вовлечением левого желудочка (ЛЖ) или без него, и могут применяться модифицированные критерии ITF 2010.
В отношении некомпактной кардио-миопатии рабочая группа экспертов ESC не считает, что некомпактный миокард левого желудочка (НМЛЖ) является отдельной кардиомиопатией. Вместо этого она рассматривается как фенотипическая черта, которая может возникнуть либо изолированно, либо в сочетании с другими аномалиями развития: гипертрофией ЛЖ, дилатацией и/или систолической дисфункцией ЛЖ.
В последних рекомендациях ESC произошли обновления и по ведению пациентов с гипертрофической кардиомиопатией (ГКМП) – первичному заболеванию сердечной мышцы, характеризующемуся развитием гипертрофии миокарда левого желудочка в отсутствии других очевидных причин наблюдаемой степени гипертрофии. Несмотря на успехи в лечении, достигнутые благодаря разработке и внедрению моделей стратификации риска и вмешательств, направленных на первичную профилактику внезапной сердечной смерти (ВСС), ГКМП по-прежнему ассоциирована с: 1) повышенным риском возникновения ВСС, особенно у молодых, 2) прогрессирующей сердечной недостаточностью (СН), 3) большей вероятностью развития фибрилляции предсердий (ФП), 4) тромбоэмболическими инсультами. Общая смертность в популяции пациентов с ГКМП во всех возрастных группах остается выше по сравнению с одновозрастными группами контроля, как минимум, в 2 раза.
ГКМП является самым распространенным наследственным заболеванием сердца. Частота встречаемости фенотипически дебютированной ГКМП составляет 1:500, а среди обратившихся за медицинской помощью – 1:300. Прогресс в уровне визуализирующих методов исследования сердца и возрастающая доступность генетических исследований позволяют предполагать значительно большее количество пациентов с ГКМП, которое составляет, по расчетам некоторых авторов, 1:200.
Представления о генетической природе ГКМП за 30 лет исследования претерпели существенные изменения. Первоначальные открытия привели к идентификации генов саркомера, мутации в которых объясняют моногенный характер наследования. Благодаря крупным сегрегационным исследованиям в последнее десятилетие к списку генов саркомера удалось добавить еще несколько генов, продемонстрировавших убедительную ассоциацию с ГКМП. Тем не менее, сегодня патогенные мутации в ассоциированных с ГКМП генах обнаруживаются только у около 60% пациентов. В последние годы сформировалось представление о более сложной генетической структуре ГКМП, включающей наряду с генами, ответственными за первичный генетический эффект, гены-модификаторы, определяющие олигогенный характер наследования и формирования фенотипа у генотип-положительных пациентов. Все вышеперечисленное, а также разработка патогенетического лечения ГКМП, изложенного в обновленных рекомендациях ESC 2023 года, способного улучшить качество и прогноз жизни, позволят усовершенствовать понимание ведения пациентов с ГКМП.
Лечение обструкции выходного
тракта левого желудочка
Условно обструкцию выносящего тракта левого желудочка (ОВТЛЖ) определяют как пиковый мгновенный допплеровский градиент выходного тракта левого желудочка ≥30 мм рт. ст., но порогом для инвазивного лечения обычно считается ≥50 мм рт. ст. (порог, при котором теоретические модели, изучающие взаимосвязь между градиентом и ударным объемом, предсказывают, что это становится гемодинамически значимым). Большинство пациентов с максимальным градиентом оттока ЛЖ в состоянии покоя или при провокации <50 мм рт. ст. следует лечить в соответствии с рекомендациями по необструктивной ГКМП, но в очень небольшом числе отобранных случаев с градиентами в ВТЛЖ от 30 до 50 мм рт. ст. и при отсутствии других очевидных причин симптомов может быть рассмотрено инвазивное снижение градиента, учитывая, что данные, охватывающие эту группу, отсутствуют. Большинство бессимптомных пациентов с ОВТЛЖ не нуждаются в лечении, но в очень небольшом числе отдельных случаев может быть рассмотрено фармакологическое лечение для снижения давления в ЛЖ.
Всем пациентам с ОВТЛЖ следует избегать обезвоживания и чрезмерного употребления алкоголя, а также стимулировать снижение веса. Вазодилататоры, включая нитраты и ингибиторы фосфодиэстеразы 5-го типа, могут усугубить ОВТЛЖ, и их следует по возможности исключать. Впервые возникшая или плохо контролируемая ФП может усугубить симптомы, вызванные ОВТЛЖ, и ее следует лечить путем быстрого восстановления синусового ритма или контроля частоты сердечных сокращений (табл. 1).
Таблица 1. Рекомендации по лечению обструкции выводного тракта левого желудочка (общие меры)
|
Рекомендации
|
Класс
|
Уровень
доказательства
|
|
Следует рассмотреть возможность отказа от дигоксина и вазодилататоров, включая нитраты и ингибиторы фосфодиэстеразы 5-го типа, если это возможно, у пациентов с ОВТЛЖ в состоянии покоя или при провокации
|
IIa
|
C
|
|
Восстановление синусового ритма или соответствующий контроль частоты сердечных сокращений следует рассмотреть перед инвазивным лечением ОВТЛЖ у пациентов с впервые возникшей или плохо контролируемой ФП
|
IIa
|
C
|
Медикаментозная терапия у пациентов с обструкцией выходного тракта левого желудочка
На рисунке 1 представлена схема лечения ОВТЛЖ у пациентов с ГКМП. По общему мнению, пациенты с симптоматическим ОВТЛЖ первоначально должны получать невазодилатирующие бета-адреноблокаторы, титрованные до максимально переносимой дозы, но существует очень мало исследований, сравнивающих отдельные бета-адреноблокаторы. Недавнее небольшое рандомизированное плацебо-контролируемое исследование показало снижение ОВТЛЖ в состоянии покоя и при физической нагрузке, а также улучшение симптомов и качества жизни на фоне терапии метопрололом.

Если одни бета-адреноблокаторы неэффективны в лечении, может быть добавлен дизопирамид, титруемый до максимально переносимой дозы (обычно 400–600 мг/сут). Класс IA ААТ может устранить градиенты базального давления оттока ЛЖ и улучшить переносимость физической нагрузки и функциональные возможности с низким риском проаритмических эффектов и без повышенного риска ВСС. Ограничивающие дозу антихолинергические побочные эффекты включают сухость глаз и рта, затрудненное мочеиспускание или задержку мочи, а также констипацию. Интервал QTc следует контролировать во время повышения дозы и снижать дозу, если он превышает 500 мс. Прием дизопирамида следует избегать пациентам с глаукомой, мужчинам с простатитом и лицам, принимающим другие препараты, удлиняющие интервал QT, такие как амио-дарон и соталол. Дизопирамид можно применять в комбинации с верапамилом (табл. 2).
Таблица 2. Рекомендации по медикаментозному лечению обструкции выводного тракта левого желудочка
|
Рекомендации
|
Класс
|
Уровень
доказательства
|
|
Невазодилатирующие бета-адреноблокаторы, титруемые до максимально переносимой дозы, рекомендуются в качестве терапии первой линии для улучшения симптомов у пациентов с ОВТЛЖ в состоянии покоя или при провокации
|
I
|
B
|
|
Верапамил или дилтиазем, титруемые до максимально переносимой дозы, рекомендуются для улучшения симптомов у пациентов с симптоматической ОВТЛЖ в состоянии покоя или при провокации, которые не переносят бета-адреноблокаторы или имеют противопоказания к их приему
|
I
|
B
|
|
Дизопирамид, титруемый до максимально переносимой, рекомендуется применять в дополнение к бета-адреноблокатору (или, если это невозможно, к верапамилу или дилтиазему) для улучшения симптомов у пациентов с ОВТЛЖ в состоянии покоя или при провокации
|
I
|
B
|
|
Ингибитор сердечной миозин-АТФазы (мавакамтен), титруемый до максимально переносимой дозы при эхокардиографическом контроле ФВ ЛЖ, следует рассматривать в дополнение к бета-адреноблокатору (или, если это невозможно, верапамилу или дилтиазему) для улучшения симптомов у взрослых пациентов с ОВТЛЖ в состоянии покоя или при провокации
|
IIa
|
A
|
|
Ингибитор сердечной миозин-АТФазы (мавакамтен), титруемый до максимально переносимой дозы с эхокардиографическим контролем ФВ ЛЖ, следует рассматривать в качестве монотерапии у взрослых пациентов с симптомами ОВТЛЖ в состоянии покоя или при провокации (физическая нагрузка или маневр Вальсальвы), которые имеют непереносимость или противопоказания к бета-адреноблокаторам, верапамилу/дилтиазему или дизопирамиду
|
IIa
|
B
|
|
Пероральные или внутривенные бета-адреноблокаторы и вазоконстрикторы следует рассмотреть у пациентов с тяжелым провоцируемым отеком левого желудочка, проявляющимся артериальной гипотензией и острым отеком легких, которые не реагируют на введение жидкости
|
IIa
|
C
|
|
Дизопирамид, титрованный до максимально переносимой дозы, может рассматриваться в качестве монотерапии у пациентов с непереносимостью бета-адреноблокаторов и верапамила/дилтиазема или имеющих противопоказания к их применению для улучшения симптомов у пациентов с ОВТЛЖ в состоянии покоя или при провокации
|
IIb
|
C
|
|
Бета-адреноблокаторы или верапамил могут быть назначены в отдельных случаях бессимптомным пациентам с ОВТЛЖ в состоянии покоя или при провокации для снижения давления в ЛЖ
|
IIb
|
C
|
|
При симптоматической ОВТЛЖ может быть рассмотрено осторожное применение низких доз диуретиков для улучшения одышки при физической нагрузке
|
IIb
|
C
|
Верапамил (начальная доза 40 мг три раза в день до максимальной 480 мг в день) можно применять, когда бета-адреноблокаторы противопоказаны или неэффективны, но, основываясь на ограниченных данных, следует применять с осторожностью у пациентов с тяжелой обструкцией (≥100 мм рт. ст.) или повышенным систолическим давлением в легочной артерии, так как это может спровоцировать отек легких. Кратковременный прием внутрь может повысить физическую работоспособность, улучшить симптомы и нормализовать или улучшить диастолическое наполнение ЛЖ без изменения систолической функции.
Аналогичные результаты были продемонстрированы для дилтиазема (начальная доза 60 мг три раза в день до максимальной 360 мг в день), что следует учитывать у пациентов с непереносимостью или противопоказаниями к бета-адреноблокаторам и верапамилу.
Низкодозовые петлевые или тиазидные диуретики можно применять с осторожностью для улучшения одышки, связанной с ОВТЛЖ, но важно избегать гиповолемии.
Ингибиторы сердечной миозинаденозинтрифосфатазы. Мавакамтен – это первый в своем классе селективный ингибитор сердечной миозинаденозинтрифосфатазы (АТФазы), который действует путем уменьшения образования актин-миозиновых мостиков, тем самым снижая сократительную способность и улучшая энергетический потенциал миокарда. В недавно опубликованном клиническом исследовании по оценке мавакамтена у взрослых с симптоматической обструктивной гипертрофической кардиомиопатией (исследование EXPLORER-HCM) мавакамтен снижал градиент давления выходного тракта левого желудочка (ГД ВТЛЖ) и улучшал физическую работоспособность по сравнению с плацебо у пациентов с ГКМП и симптоматической ОВТЛЖ (NYHA II–III и EF >55%). У 27% пациентов, получавших мавакамтен, градиент давления ЛЖ снизился до <30 мм рт. ст. и улучшился до класса I ХСН по NYHA. Препарат хорошо переносился и имел хороший профиль безопасности; только у небольшой подгруппы пациентов развилась транзиторная систолическая дисфункция ЛЖ, которая разрешилась после временной отмены препарата.
Второе исследование (по оценке мавакамтена у взрослых с симптоматической обструктивной ГКМП с потребностью во вмешательствах по редукции межжелудочковой перегородки [VALOR-HCM]) у взрослых пациентов с обструктивной ГКМП, направленных на терапию по уменьшению межжелудочковой перегородки (SRT) из-за трудноизлечимых симптомов, показало, что мавакамтен значительно снизил долю пациентов, отвечающих критериям для SRT через 16 и 32 недели после начала лечения. Небольшие МРТ- и ЭхоКГ-исследования позволяют предположить, что мавакамтен также может приводить к положительному ремоделированию миокарда с уменьшением массы миокарда, толщины стенки ЛЖ и объема левого предсердия. Афикамтен, следующий в своем классе ингибитор сердечного миозина, также недавно был показан в рандомизированном плацебо-контролируемом исследовании II фазы (рандомизированная оценка дозирования CK-3773274 [REDWOOD-HCM]) для значительного снижения градиентов давления ВТЛЖ и уровней NT-proBNP у взрослых пациентов с симптоматической обструктивной ГКМП.
В отсутствие прямого сравнения результатов Task Force не смогла рекомендовать использование ингибиторов сердечной миозинаденозинтрифосфатазы в качестве медикаментозной терапии первой линии, но счел доказательства достаточно убедительными, чтобы поддержать рекомендацию о том, что следует рассмотреть возможность их применения в качестве терапии второй линии, когда оптимальная медикаментозная терапия бета-адреноблокаторами, антагонистами кальция и/или дизопирамидом неэффективна или плохо переносится. При отсутствии доказательств обратного ингибиторы сердечной миозинаденозинтрифосфатазы не следует применять вместе с дизопирамидом, но их можно назначать одновременно с бета-адреноблокаторами или антагонистами кальция. Повышение дозы препарата до максимальной дозы 15 мг следует контролировать в соответствии с лицензированными рекомендациями с использованием эхокардиографии. У пациентов с противопоказаниями или известной чувствительностью к бета-адреноблокаторам, антагонистам кальция и дизопирамиду ингибиторы сердечной миозинаденозинтрифосфатазы могут рассматриваться в качестве монотерапии.
Медикаментозная терапия у пациентов без обструкции выходного тракта левого желудочка
Лечение СН у пациентов без ОВТЛЖ должно осуществляться в соответствии с рекомендациями Руководства ESC 2021 года по диагностике и лечению острой и хронической сердечной недостаточности. Целью медикаментозной терапии является снижение диастолического давления в ЛЖ и улучшение наполнения ЛЖ путем замедления частоты сердечных сокращений с помощью бета-адреноблокаторов, верапамила или дилтиазема (в идеале под контролем амбулаторной записи ЭКГ) и осторожного применения петлевых диуретиков. Бета-блокаторы или антагонисты кальция следует рассмотреть у пациентов с физической нагрузкой или длительными эпизодами синдрома «стенокардии», даже при отсутствии стенокардии покоя или провоцируемой ишемии левого желудочка или обструктивной ИБС. При отсутствии ОВТЛЖ может быть рассмотрен вопрос об осторожном применении пероральных нитратов. Также может быть рассмотрено применение ранолазина для улучшения симптомов у пациентов с синдромом «стенокардии» и отсутствием ОВТЛЖ (табл. 3).
Таблица 3. Рекомендации при синдроме стенокардии при физической нагрузке у пациентов без обструкции выходного тракта левого желудочка
|
Рекомендации
|
Класс
|
Уровень
доказательства
|
|
Следует рассмотреть возможность применения бета-адреноблокаторов и антагонистов кальция (верапамил или дилтиазем) для улучшения симптомов у пациентов с синдромом стенокардии даже при отсутствии ОВТЛЖ или обструктивной ИБС
|
IIa
|
C
|
|
Считается, что пероральные нитраты улучшают симптомы у пациентов с синдромом стенокардии даже при отсутствии обструктивной ИБС, если нет ОВТЛЖ
|
IIb
|
C
|
|
Можно считать, что ранолазин улучшает симптомы у пациентов с синдром стенокардии даже при отсутствии ОВТЛЖ или обструктивной ИБС
|
IIb
|
C
|
Клиническое лечение сердечной недостаточности описано в Руководстве ESC по диагностике и лечению острой и хронической сердечной недостаточности от 2021 года [2]. В этом документе рекомендации, как правило, не зависят от этиологии сердечной недостаточности и включают медикаментозную и ресинхронизирующую терапию, а также вспомогательные устройства для ЛЖ (LVAD) и трансплантацию сердца.
Таким образом, рекомендации по лечению сердечной недостаточности следует рассматривать как общие, а не специфичные для различных форм кардиомиопатии. Медикаментозная терапия ХСН со сниженной ФВ ЛЖ, основанная на рандомизированных контролируемых исследованиях (РКИ) больших когорт, включая ингибиторы ангиотензинпревращающего фермента (иАПФ)/ингибиторы неприлизина рецепторов ангиотензина (АРНИ)/ антагонисты рецепторов ангиотензина II (АРА), бета-блокаторы (ББ), антагонисты минералокортикоидных рецепторов (АМКР) и ингибиторы натрий-глюкозного котранс-портера 2 (иНГКТ-2), была в основном применима к генетическим ДКМП, недилатационной кардиомиопатии ЛЖ и другим фенотипам, связанным с дисфункцией ЛЖ (например, терминальная стадия ГКМП, РКМП и АКПЖ).
Рекомендации по лечению ХСН со сниженной ФВ ЛЖ в основном применимы к необструктивной ГКМП. Согласно целенаправленному обновлению Руководящих принципов ESC 2021 года по диагностике и лечению острой и хронической сердечной недостаточности 2023 года [3], лечение ХСН с сохраненной ФВ ЛЖ включает диуретики при задержке жидкости (класс I), дапаглифлозин/эмпаглифлозин (класс I) и лечение сопутствующих заболеваний (класс I).
Терапия ХСН с умеренно сниженной ФВ ЛЖ включает диуретики при задержке жидкости (класс I), дапаглифлозин/ эмпаглифлозин (класс I) иАПФ/АРНИ/АРА (класс IIb) при этом, АРА назначают как альтернативу иАПФ: валсартан 40–160 мг/сут или лозартан 50–150 мг/сут, АМКР (класс IIb): спиронолактон 12,5–100 мг 1 – 2 раза/сут; бета-блокаторы (класс IIb).
При лечении ХСН со сниженной ФВ ЛЖ рекомендовано назначение бета-блокаторов (класс I), диуретиков (класс I) под контролем ЧСС и ГД ВТЛЖ (торасемид 5–20 мг/сут, или фуросемид 20–240 мг/сут, или гидрохлортиазид 12,5–100 мг/сут), АМКР (класс I): спиронолактон 12,5–100 мг 1–2 раза в сутки, дапаглифлозин/эмпаглифлозин (класс I); иАПФ/АРНИ/АРА (класс I). Из группы иАПФ рекомендованы: каптоприл 25–150 мг 3 раза в сутки, или эналаприл 5–20 мг 2 раза в сутки внутрь, или лизиноприл 2,5–35 мг 1 раз в сутки, или рамиприл 2,5–10 мг 1 раз в сутки, или фозиноприл 5–20 мг 1 раз в сутки, или периндоприл 2(2,5)–8(10) мг 1 раз в сутки внутрь. При почечной недостаточности целесообразно назначить иАПФ с двойным путем выведения: фозиноприл 5–20 мг 1 раз в сутки внутрь. При печеночной недостаточности – лизиноприл 2,5–20 мг 1 раз в сутки внутрь. АРА назначают как альтернативу иАПФ: валсартан 40–160 мг/сут или лозартан 50–150 мг/сут при необструктивной форме ГКМП. Пациентам с обструктивной ГКМП назначение иАПФ/АРА может вызвать усиление ГД ВТЛЖ вследствие уменьшения общего периферического сопротивления сосудов и снижения преднагрузки.
Индивидуальный ответ на терапию сердечной недостаточности может быть неодинаковым при различных специ-фических генетических причинах, как было продемонстрировано в нескольких наблюдательных исследованиях.
Амилоидоз сердца и некоторые формы РКМП заслуживают особого внимания при лечении сердечной недостаточности. Контроль жидкости и поддержание эуволемии играют центральную роль. При наличии симптомов сердечной недостаточности следует назначать петлевые диуретики, хотя ортостатическая гипотензия может вызвать непереносимость, а чрезмерная потеря жидкости может ухудшить симптомы из-за ограничения (например, при ГКМП или амилоидозе). Роль бета-блокаторов, иАПФ, АРА или АРНИ в лечении этих пациентов не определена, и они могут плохо переноситься из-за артериальной гипотензии. Кроме того, отмена этих препаратов часто приводит к улучшению симптомов, и это следует учитывать.
Сердечная недостаточность с ФВ ЛЖ >40–50%, восстановленная после лечения ХСН со сниженной ФВ ЛЖ или ХСН с умеренно сниженной ФВ ЛЖ (улучшенная ФВ ЛЖ), отдельно не рассматривается в рекомендациях ESC по диагностике и лечению острой и хронической сердечной недостаточности 2021 года, но особенно важна для генетической ДКМП, поскольку у значительной части пациентов с ХСН со сниженной ФВ ЛЖ или ХСН с умеренно сниженной ФВ ЛЖ улучшится ФВ ЛЖ с помощью медикаментозной терапии, согласно рекомендациям (guideline-directed medical therapy, GDMT) [2]. Пациенты и врачи сталкиваются с дилеммой: продолжать ли пожизненную фармакотерапию или в какой-то момент отказаться от нее. Исследование TRED-HF (Отмена терапии у пациентов с дилатационной кардиомио-патией и восстановившейся функцией миокарда) является единственным РКИ, в котором оценивалось, безопасна ли отмена GDMT. Результаты показали, что у значительной части пациентов наблюдалась рецидивирующая дисфункция левого желудочка или сердечная недостаточность, поэтому современные рекомендации предостерегают от отмены препаратов.
Рекомендации по стратификации риска внезапной сердечной смерти
За несколько десятилетий было проведено множество исследований, сосредоточенных на идентификации основных клинических факторов риска, которые позволяли бы стратифицировать пациентов по уровню риска для профилактики ВСС. Клинические факторы, ассоциированные с повышенным риском возникновения ВСС и которые были использованы в предыдущих руководствах для оценки риска, представлены в таблице 4.
Таблица 4. Основные клинические факторы риска ВСС
|
Факторы риска
|
Комментарии
|
|
Возраст
|
Показана значимая ассоциация с повышенным риском ВСС у более молодых пациентов. Некоторые факторы риска, такие как наличие неустойчивой желудочковой тахикардии (ЖТ), тяжелая ГЛЖ и необъяснимые синкопе более значимы для молодых пациентов
|
|
ВСС в семейном анамнезе
|
Семейный анамнез ВСС считается клинически значимым, когда один или больше родственников первой степени родства внезапно умерли в возрасте <40 лет с диагнозом ГКМП или без него или ВСС
|
|
Массивная толщина стенки ЛЖ: толщина стенки ≥ 30 мм в любом сегменте ЛЖ
по данным ЭхоКГ или МРТ сердца
|
Наибольший риск развития ВСС у пациентов с максимальной толщиной стенки ≥30 мм; однако данных о пациентах с более выраженной гипертрофией ≥35 мм еще очень мало
|
|
Необъяснимые синкопы
|
Синкопальные состояния >1 эпизода в анамнезе вряд ли имеют вазовагальную этиологию, а чаще связаны с обструкцией ВТЛЖ, особенно если они произошли спустя 6 месяцев после оценки события (события, произошедшие за 5 лет в прошлом, не имеют актуальность)
|
|
Размер левого предсердия (ЛП)
|
В нескольких исследованиях сообщалось о положительной связи между размером ЛП
и ВСС. Данных о связи между ВСС и площадью или объемом ЛП нет. Измерение размера ЛП также важно для оценки риска ФП
|
|
Обструкция выносящего тракта ЛЖ
|
В ряде исследований сообщалось о связи риска развития ВСС с обструкцией ВТЛЖ. Остаются
без ответа вопросы относительно провоцируемой физической нагрузкой обструкции ВТЛЖ
или обструкции в покое; и влияния лечения (медикаментозного или инвазивного)
|
|
Неустойчивая ЖТ при суточном
мониторировании ЭКГ
|
Целесообразно учитывать неустойчивую ЖТ, определяемую как более 3 последующих сокращений с частотой ≥120 уд в мин. и продолжительностью менее 30 сек, что обычно регистрируется при суточном мониторировании ЭКГ
|
Европейская модель оценки риска развития ВСС не учитывает влияния дополнительных факторов, включая систолическую дисфункцию (ФВ ЛЖ <50%), апикальную аневризму, предлагаемых Американскими рекомендациями 2020 года (AHA/ACC-2020) [4].
Аневризма верхушки ЛЖ была включена в последние рекомендации AHA/ACC-2020 как основной независимый фактор риска развития ВСС и считалась разумным показанием для имплантации ИКД. Однако в проведенных исследованиях было слишком мало событий, чтобы оценить независимую прогностическую ценность этого фактора риска. Кроме того, большая часть пациентов имела другие факторы риска, включая устойчивую ЖТ. В связи с чем Task Force ESC рекомендует принимать индивидуальные решения по ИКД с использованием хорошо известных факторов риска, а не только наличия аневризмы ЛЖ.
Многие исследования демонстрируют повышенную частоту событий у пациентов с систолической дисфункцией ЛЖ (чаще всего с ФВЛЖ <50%) от 7 до 20% по сравнению с таковыми у пациентов с нормальной функцией ЛЖ. Task Force ESC сохраняет свои рекомендации: оценить риск возникновения ВСС с использованием хорошо известных факторов риска, применяя калькулятор HCM-SCD Risk, а затем учитывать наличие фактора риска ФВ ЛЖ <50% для совместного принятия решения о профилактических мерах по имплантации ИКД.
В рекомендациях ESC 2014 года по диагностике и лечению ГКМП определение степени фиброза миокарда по данным МРТ сердца с отсроченным контрастированием (ОК) считалось полезным при прогнозировании сердечно-сосудистой смертности. Однако было недостаточно данных о количественной оценке фиброза миокарда для прогнозирования риска возникновения ВСС. За последние 8 лет были опубликованы дополнительные исследования, которые показали, что обширный фиброз, выраженный в процентах от массы ЛЖ, связан с увеличением риска развития ВСС и других событий, особенно при наличии других факторов риска, включая систолическую дисфункцию ЛЖ. Мета-анализ почти 3000 пациентов из нескольких исследований показал, что наличие фиброза миокарда связано с 2,32-кратным увеличением риска развития ВСС/ВСС с успешной реанимацией/срабатыванием ИКД; а также увеличение риска смерти от всех причин в 2,1 раза. Было высказано предположение, что добавление оценки фиброза миокарда по данным МРТ с ОК к текущему алгоритму ВСС, разработанному AHA/ACC, или в модель риска HCM-SCD улучшает стратификацию пациентов с низким и промежуточным риском развития ВСС. Task Force ESC придерживается следующей стратегии: оценить риск возникновения ВСС с помощью калькулятора риска HCM Risk-SCD. Для пациентов, которые относятся к категории низкого и промежуточного риска, использовать наличие обширного фиброза ≥15% для совместного принятия решения об имплантации ИКД.
Аномальная реакция АД на физическую нагрузкуопределяется как неспособность повысить систолическое давление, как минимум, на 20 мм рт. ст. от исходного уровня до пиковой нагрузки или падение более 20 мм рт. ст. от пикового уровня давления. Task Force ESC не рекомендует использовать аномальную реакцию АД на физическую нагрузку в качестве показания для первичной профилактики ВСС пациентам с низким или промежуточным риском.
До настоящего времени нет рандомизированных исследований или статистически подтвержденных проспективных исследований, которые можно использовать для принятия решения по имплантации ИКД у пациентов с ГКМП. В рекомендациях ESC 2014 года рекомендована модель прогнозирования рисков HCM Risk-SCD, которая предоставляет индивидуальные количественные оценки риска с использованием расширенного фенотипического подхода. С тех пор этот подход был проверен в независимых когортах и мета-анализе доступных опубликованных данных. Эффективность этого калькулятора для определения риска возникновения ВСС показала, что объединенные данные оценки согласуются с наблюдаемым риском развития ВСС у пациентов, отнесенных в группу высокого или низкого риска.
В отличие от этого подхода в рекомендациях AHA/ACC считается необходимым процесс совместного с пациентом принятия решений по имплантации ИКД, с учетом индивидуального восприятия пациентом заранее определенных медицинских вмешательств. Также рассматривается отсутствие таких клинических факторов риска, как систолическая дисфункция ЛЖ и аневризма верхушки ЛЖ в калькуляторе HCM Risk-SCD. Task Force ESC признает проблемы, связанные с определением универсальных порогов приемлемого риска, но считает, что основываться только на неколичественной оценке риска не помогает решить проблему. Task Force рекомендует более открытое совместное принятие решения на основе реальных данных и индивидуальных предпочтений. Аналогично конкурирующие риски, связанные с сопутствующими заболеваниями, возрастом, осложнениями, обусловленными устройствами, требуют дальнейшего обсуждения. Task Force ESC призывает к разработке усовершенствованных способов принятия решения для пациентов, нуждающихся в медицинской помощи, а также новых методов принятия решения для практикующих врачей.
На рисунке 2 обобщены рекомендации по первичной профилактике ВСС в каждой категории риска.
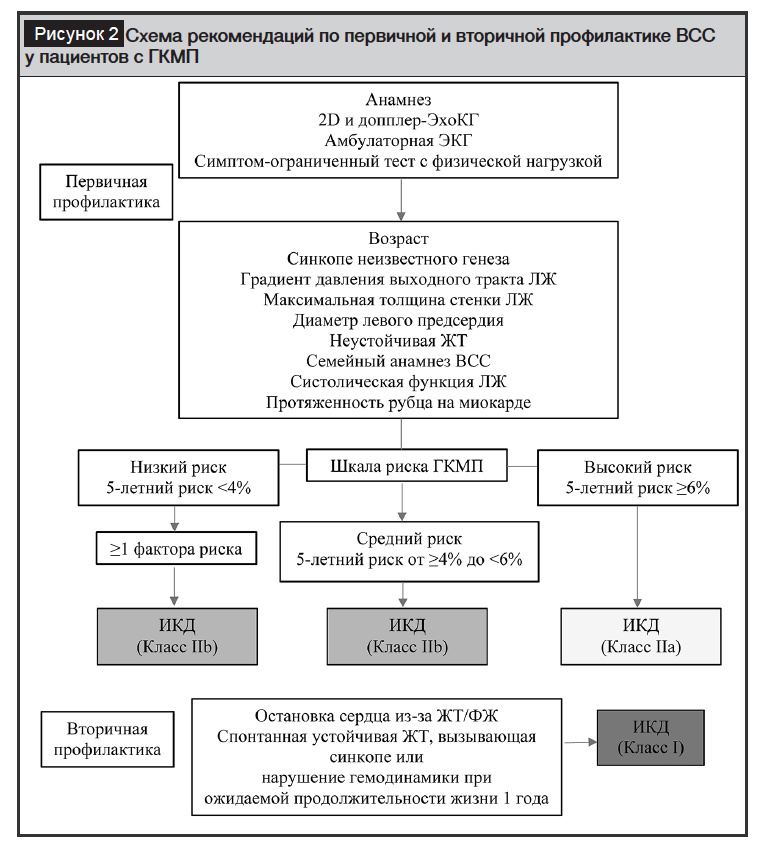
Рекомендации предназначены для того, чтобы достаточно гибко учитывать дополнительные факторы риска, которые не включены в модель HCM Risk-SCD. Модель не следует применять у профессиональных спортсменов, у лиц с заболеваниями накопления (болезнь Андерсона – Фабри) и синдромами (синдром Нунан). В модели не используются градиенты ВТЛЖ, спровоцированные физической нагрузкой, и они не были проверены до и после миосептэктомии. Модель HCM Risk-SCD была проверена в одном исследовании взрослых пациентов после спиртовой септальной аблации и сделано предположение, что тяжелая гипертрофия ЛЖ и резидуальный градиент ВТЛЖ связаны с повышенным риском развития ВСС после проведения спиртовой септальной аблации.
Л И Т Е Р А Т У Р А
1. Arbelo E., Protonotarios A., Gimeno J.R., et al. // Eur Heart J. – 2023. – Vol.44, N37. – P.3503–3626. doi: 10.1093/eurheartj/ehad194
2. McDonagh T.A., Metra M., Adamo M., et al. // Eur Heart J. – 2021. – Vol.42, N36. – P.3599–3726. doi: 10.1093/eurheartj/ehab368
3. McDonagh T.A., Metra M., Adamo M., et al. // Eur Heart J. – 2023. – Vol.44, N37. – P.3627–3639. doi: 10.1093/eurheartj/ehad195
4. Ommen S.R., Mital S., Burke M.A., et al. // Circulation. – 2020. – Vol.142, N25. – e558–e631. doi: 10.1161/CIR.0000000000000937
Медицинские новости. – 2023. – №11. – С. 56-62.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.